Commissioned by the project "Bevar Raet", the Institute of Marine Research has prepared a report on the state of the marine ecosystem in and around Raet National Park in Agder, Norway. The purpose of the report is to provide a knowledge base and policy advice for the faciliatory process underway to ensure that marine ecosystem attributes of Raet National Park can be restored to robust states. The report shows that Raet national park as of today may be classified as "unprotected" according to best available criteria, and thus, the positive effects of marine protection cannot be expected under the present management regime (e.g., effects on age- and size composition, biomass, biological diversity and resilience to effects of climate change). Raet National Park is not subject to regulations to fulfill its intended function in conservation of plant life, animal life and habitats/ nature types. By zoning the area that constitute Raet National Park into management zones with varying degrees of protection (especially with regard to regulation of fisheries) we deem it possible to achieve effective conservation with tangible effects on the ecosystem.
Raet nasjonalpark
— Kunnskap og råd for bevaring av marint naturmangfold
Rapportserie:
Rapport fra havforskningen 2024-38
ISSN: 1893-4536
Publisert: 03.09.2024
Prosjektnr: 15623-02
Oppdragsgiver(e): Prosjekt "Bevar Raet" ved Raet nasjonalparkstyre, Agder fylkeskommune, Tvedestrand kommune, Grimstad kommune og Arendal kommune
Referanse: 2921/471-0
Godkjent av:
Forskningsdirektør(er):
Geir Huse
Programleder(e):
Jan Atle Knutsen
English summary
Sammendrag
På oppdrag for prosjektet «Bevar Raet» har Havforskningsinstituttet utarbeidet en rapport om kunnskapsstatus for sjøområdene i og rundt Raet nasjonalpark. Formålet med rapporten er å bidra med et kunnskapsgrunnlag for at det marine økosystemet i Raet nasjonalpark kan gjenoppbygges til et robust nivå. Rapporten viser at Raet nasjonalpark per i dag kan klassifiseres som «ubeskyttet». Ut i fra dagens restriksjonsnivå kan det ikke forventes positive effekter på alders- og størrelsessammensetning, biomasse, biologisk mangfold samt robusthet mot klimaendringer. Raet nasjonalpark er derfor ikke regulert slik at det kan fungere etter hensikten med å bevare plantelivet, dyrelivet og naturtyper. Ved å dele opp Raet nasjonalpark i soner med ulik grad av beskyttelse (spesielt regulering av fiskeri) vil det være mulig å oppnå effektiv bevaring av naturmangfoldet. Samtidig bør det rettes økt fokus på vannkvalitet i indre kystområder, både med tanke på overvåkning og tiltak.
Geografisk omfang: Mens Raet nasjonalpark er kjerneområdet i vurderingene, er det også anbefalt at de kystnære områdene innenfor nasjonalparken og de dypere områdene ut i Norskerenna blir tatt med i vurderingen. Dette innebefatter «Transekt Skagerrak» i marin verneplan som også strekker seg utenfor 12 nautiske mil til dypet av Norskerenna.
Norskerenna (kapittel 3.1): Raet nasjonalpark er unik med at den strekker seg ut i dypet av Norskerenna. Norskerenna, inkludert Skagerrakrenna, er identifisert som et særlig verdifullt havområde basert på en rekke særlig verdifulle og sårbare arter og dyresamfunn i tillegg til viktige funksjoner for økosystem både i renna og i grunnområdene inn mot kyst og utover i Nordsjøen
Oksygenforhold (3.2): Oksygenkonsentrasjonen har siden 90-tallet blitt vurdert til «god». Data fra Ærøydypet viser årlige utskiftinger og gode forhold i bunnvann. I enkelte områder i fjorder og sund innenfor Raet nasjonalpark er det registrert oksygensvikt i bunnvannet.
Næringssalter (3.2): Basert på næringssaltvurderinger er den samlede tilstanden for Ærøydypet «svært god» og det har vært en bedring i næringssaltforholdene siden siste halvdel av 1990. For fosfat har tilstanden vært «svært god» hele perioden. For nitrogen har det vært en utvikling mot bedre tilstand. Fra 2001 og frem til i dag har tilstanden vært «svært god», mens den i perioden før varierte noe mer. En vurdering basert på ett år data i mer indre stasjoner (sommer 2023) viste at både «Hølen» og utløp av Nidelva ved Utnes hadde tilstand «god» for henholdsvis fosfat og nitrogen. Men det er kunnskapsbehov om næringssalter i indre kystvann.
Planteplankton (3.2): Høstoppblomstringer av planteplankton forekommer sjeldnere enn før, samtidig som det er tegn på at våroppblomstringer kommer tidligere enn før. Mulige forklaringer kan være mindre nitrat og klimaforandringer. Tilstandsvurderingen for planteplankton ved Ærøydypet og kystvannet «Arendal» har de siste årene vært «svært god».
Dyreplankton (3.3): Flere av artene i Raet nasjonalpark befinner seg i øvre tålegrense for temperatur og er derfor ekstra følsomme for andre menneskeskapte endringer i miljøet (som klimaendringer). Økt avrenning fra land, som fører til mørkere kystvann, kan gi fordeler for taktile predatorer som maneter, på bekostning av visuelle predatorer som fisk. Raudåte har gått kraftig tilbake som følge av stigende temperaturer. Samtidig har mer varmekjære arter økt. Introduksjon av fremmede arter av dyreplankton er observert og har innvirkning på stedegne arter gjennom konkurranse, predasjon og overføring av parasitter. Dette kan forårsake kaskadeeffekter i økosystemet.
Blå skoger (3.4): Det er registrert mange ålegressenger i Raet nasjonalpark og utbredelsen av ålegress ser ut til å øke langs norskekysten i Skagerrak. Sukkertareskogene er i betydelig tilbakegang i Skagerrak på grunn av intensifiering av hetebølger. De blir utkonkurrert av hurtigvoksende trådformede alger (lurv) som hindrer ny sukkertare i å spire. Tilstanden for stortare i mer bølgeeksponerte områder er god.
Skjellforekomster (3.5): Tidligere fantes det store bestander av flatøsters i nesten hele Europa. Disse er så å si forsvunnet på grunn av overfiske, bruk av destruktive høstemetoder, forurensning og østerssykdommen bonamiose. Det er identifisert viktige flatøstersrev i og rundt Raet nasjonalpark. I Sørlandsleia, innenfor Flosterøya, er Norges eneste fredningsområde for Europeisk flatøsters. Stillhavsøsters er en introdusert art og kan være i konflikt med rekreasjon og/eller sårbare naturtyper (blåskjellenger og flatøstersrev). Stillehavsøsters er observert flere steder i Raet nasjonalpark. Gjennom de siste 2-3 tiår har blåskjell vært i nedgang i den nordlige Atlanterhavet på grunn av den samlede belastning fra høsting og klimaendringer som fører til økt temperatur og nedbør.
Torskefisk (3.6): Torskefisk som torsk, lyr og hvitting har vært i betydelig tilbakegang og ligger nå på rundt 10 % av langtidsgjennomsnittet for både ung og voksen fisk i og rundt Raet nasjonalpark. Raet nasjonalpark, som mye av den norske Skagerrakkysten ellers, kjennetegnes med lave bestander av toppredatorer (slik som torsk) og smal alders- og størrelsessammensetning. Fiskerier har hatt betydelig påvirkning på fiskebestandene over flere hundre år og har fortsatt stor påvirkning. Årlig overlever 3 av 10 torsk. Av de som dør, står fiske for en større andel enn naturlige årsaker (som innebefatter samlet død fra blant annet predasjon, sykdommer og spøkelsesfiske).
Skalldyr (3.6): Hummer står på den nasjonale rødlisten som «sårbar». Det er betydelig fiske fra både fritidsfiskere og yrkesfiskere på hummer i Raet nasjonalpark. Fisket etter sjøkreps med teiner har økt de siste årene. I Raet nasjonalpark er fisket forventet å være dominert av fritidsfiskere. Det er begrenset med bestandsdata på sjøkreps langs Skagerrak-kysten. Taskekrabbe er populært å fiske både på sommeren og som bifangst under hummerfisket på høsten. Det er grunn til å forvente at fritidsfisket dominerer fangstene, men det er begrenset med data på innsats og fangst. Dypvannsreke er en nøkkelart i økosystemet og et viktig ledd i næringskjeden. Reker fiskes i hovedsak med reketrål, men et teinefiskeri er under utvikling. Rekebestanden i Nordsjøen har vært i negativ utvikling over lengre tid og Skagerrak er nå ansett som et viktig område for reker. Men også her har gytebestanden vært i betydelig tilbakegang.
Sjøpattedyr (3.7): Kystselen steinkobbe er det mest synlige sjøpattedyret i Rat nasjonalpark. Steinkobbene vandrer mye langs kysten og også over til Sverige og Danmark. Som topp-predator har den en bred diett av ulike fiskeslag som flyndrer, torskefisk og sild. Torsk utgjør kun 0,7 % av dietten (2,3 % i biomasse). Nise er den vanligste hvalarten i Raet nasjonalpark og forekommer året rundt. Også kvitskjeving, spekkhogger og vågehval er observert i nasjonalparken. Bifangst i fiskeri, opphopning av miljøgifter og undervannsstøy er identifisert som viktige trusler mot sjøpattedyrene i Raet nasjonalpark.
Sjøfugl (3.8): Sjøfugl er en av de mest truede artsgruppene i verden på grunn av menneskelig aktivitet. Mange ulike arter sjøfugl hekker i og rundt Raet nasjonalpark. Flere av artene er på den nasjonale rødlisten. I Raet nasjonalpark er hekkende sjøfugl utsatt for mange ulike stressfaktorer: predasjon (mink, kråke), menneskelige forstyrrelser (båttrafikk, støy, ilandstigelse på øyer i hekketiden), fiskeri, klimaendringer (som for eksempel ekstreme temperaturer), miljøgifter og marin forsøpling.
Fiskerier (4): Rundt 100 år med data fra kommersielle fiskerier viser at det har vært en nedgang i landinger for en rekke arter, spesielt for arter høyere oppe i næringskjeden. Reker har hatt en gradvis økning av landinger gjennom 100 år. Mye kan nok knyttes til teknologisk utvikling i fiskeriet. De siste tiårene er rekefisket regulert gjennom kvoter. Fritidsfisket er populært i og rundt Raet nasjonalpark og kan dominere uttaket på flere arter (som hummer og torsk). Det er registrert 53 kommersielle fiskefartøy i nasjonalparkkommunene. Båtstørrelsen strekker seg fra under 6 meter til opp mot 22 meter. Tolv båter fra nasjonalparkkommunene landet reker i 2022, men de tre største båtene stod for 73 % av rekefangsten. Reker dominerer fangstene (i biomasse) i det kommersielle fiskeriet, fulgt av sei, torsk, breiflabb, brosme og lange. De kommersielle fiskeriene fangster i dag på lavere trofisk nivå enn tidligere tiår. Dette kan være en indikator på at store topp-predatorer har blitt utfisket.
Spøkelsesfiske (4): Det er beregnet at det står rundt 10 000 tapte fiskeredskaper i Raet nasjonalpark, der teiner utgjør 82 %. Videre er det beregnet at 1000 nye fiskeredskap går årlig tapt i Raet nasjonalpark. Spøkelsesfiske kan ha en påvirkning på bestandene av blant annet torsk, hummer og krabber.
Samlet påvirkning og økosystemeffekter (5): Menneskelig aktivitet som kan påvirke økosystemet i Raet nasjonalpark innebefatter blant annet fiskeri, næringssalttilførsel, miljøgifter, klimaforandringer, fysisk påvirkning og plastforurensing. Det er sannsynlig at fiskeriaktivitet har vært og er den største påvirkeren på økosystemet i og rundt Raet nasjonalpark. Fravær at store topp-predatorer kan påvirke hele økosystemet og kan føre til trofiske interaksjoner og kaskader. Blant annet er det blitt vist at fravær av topp-predatorer kan medføre bedre vekstvilkår for hurtigvoksende trådformede alger (lurv).
Marine bevaringsområder (6): Marine bevaringsområder har en viktig rolle å spille i en økosystembasert forvaltning av havet, både for bevaring og som et verktøy i fiskeriforvaltningen. Den internasjonale kunnskapen om marine bevaringsområder kan i dag karakteriseres som omfattende; det er frembrakt solid kunnskap om bevaringseffekter, men det er fortsatt kunnskapsbehov om blant annet utforming, regionale effekter og optimalisering for å understøtte fiskeriforvaltningen. Det er også videre behov for forskning på effekter i omkringliggende områder. Det er stor forskjell på effekter i fullt eller delvis beskyttede områder og det er god dokumentasjon på at fullt beskyttede områder (inkludert null-fiske) har sterkest effekt.
Forskning på marine bevaringsområder i Norge (6.1): I hovedsak er det blitt forsket på hummerfredningsområder. Det har blitt observert en betydelig økning i både gjennomsnittsstørrelse og tetthet av hummer i fredningsområder. Det er også observert noe positive effekter på torsk og leppefisk. Men torsk kan fortsatt fiskes med stang og snøre i hummerfredningsområder og er utsatt for betydelig fangst, om enn noe lavere enn i åpne områder.
Marin bevaring i Norge og Raet (6.2): Norske marine verneområder og nasjonalparker har generelt sett få reguleringer på fiske sammenlignet med omkringliggende områder. Det er få begrensinger på fiske, til tross for at dette er identifisert som en betydelig påvirker av økosystemet. Generelt kan norske marine verneområder være å betrakte langt nede på skalaen av «delvis beskyttet», der det er svært få begrensninger på fiske og sågar foregår tråling i mange av områdene, deriblant Raet nasjonalpark. Det er derfor ingen grunn til å forvente sporbare effekter på marint naturmangfold i mange av de marine verneområdene i Norge.
Vurdering av effektiv vernestatus for Raet nasjonalpark (6.3): To ulike metoder for analyse av Raet nasjonalpark har blitt benyttet. Raet har tre ulike soner; i) åpne områder med generelle fiskerireguleringer (ca. 89 % av arealet), ii) områder der det er forbud mot bunnslepende fiskeredskaper (ca. 10 % av arealet) og iii) hummerfredningsområder (ca. 1 % av arealet). I åpne områder med generelle fiskerireguleringer foregår det industrielt trålfiske, hvilket ikke er forenlig med marin bevaring. Områder der det er forbud mot bunnslepende redskaper tillater en rekke andre fiskeredskaper og har en lav beskyttelsesgrad. Hummerfredningsområder oppnår en høyere beskyttelsesgrad da det er større begrensinger i antall fiskeredskap og de mest destruktive fiskeredskapene er forbudt. Evalueringene viser at Raet nasjonalpark per i dag kan klassifiseres som «ubeskyttet», og det bør ikke forventes positive effekter på alders- og størrelsessammensetning, biomasse, biologisk mangfold samt robusthet mot klimaendringer. Raet nasjonalpark er derfor mest sannsynlig ikke regulert slik at det kan fungere etter hensikten med å bevare plantelivet, dyrelivet og naturtyper.
Tilnærming til effektiv bevaring av Raet nasjonalpark (8.4): Industriell tråling i Raet nasjonalpark er et hinder for å kunne klassifisere nasjonalparken som et marint verneområde etter internasjonale standarder. Dette skyldes at slik fiskeriaktivitet påvirker økosystemet i så stor grad at bevaringseffekter har lav sannsynlighet for å oppnås. For å oppnå effektiv bevaring av naturmangfoldet vil det være behov for flere og større soner med økt grad av restriksjoner på fiske. Dette bør innebefatte null-fiskeområder. Det er skissert ulike teoretiske eksempler på hvordan en slik sonering kan utarbeides.
1 - Om oppdraget
Havforskningsinstituttet har mottatt en bestilling fra Raet nasjonalparkstyre med følgende vedtak (02.06.2021, ref: 2921/471-0):
Raet nasjonalparkstyre, med støtte fra Arendal, Grimstad og Tvedestrand kommuner, Agder Fylkeskommune, de tre lokale fiskerlagene m.flere, ønsker å iverksette en utredning av marine vernesoner i Raet nasjonalpark. Styre ber derfor Havforskningsinstituttet ta ansvar for en slik utredning som skal utføres med involvering av lokale fiskerlag, fritidsfiskere og baseres på et marint kunnskapsgrunnlag. Fiskeridirektoratet ønskes invitert til å bidra i prosessen.
Havforskningsinstituttet behandlet bestillingen fra Raet nasjonalparkstyre og svarte (ref: 21/0215):
Havforskningsinstituttet stiller seg positiv til å være kunnskapsleverandør til prosjektet. Dette forutsetter at det fremskaffes finansiering på et slikt nivå at kunnskap av høy kvalitet kan leveres. Det er også svært viktig at det tidlig fremskaffes finansiering for å forske på effekter, da det også må samles inn data før bevaringsområder blir etablert. For øvrig viser vi til vedlagte rapport for mer utfyllende informasjon.
Etter dette ble det etablert et eget prosjekt med navn «Bevar Raet» med deltakelse fra kommunene og fylkeskommunen. Styringsgruppen for prosjekt «Bevar Raet» har gjort følgende vedtak (https://agderfk.no/vare-tjenester/klima-natur-og-friluftsliv/marin-forvaltning/):
1. Legge til rette for at de de marine økosystemene i Raet nasjonalpark kan gjenoppbygges til et robust nivå. Dette krever kartlegging og kunnskap, både om hvordan de marine økosystemene virker i samspill, hvordan områdene brukes i dag, og hvilke endringer som gir effekt. Det krever også at Raet nasjonalpark vurderes i sin helhet, i tillegg til at de omkringliggende sjøområdene sees i sammenheng med arealene i nasjonalparken.
2. Gjennomføre prosjektet på en måte som gir en balanse mellom brukerinteresser og økt vern slik at brukerne er med på laget og vernet faktisk fungerer godt over tid.
Denne rapporten skal være en grunnlagsrapport for status for Raet nasjonalpark og hvordan areal-/sonebasert forvaltning kan bidra til å gjenoppbygge de marine økosystemene i og rundt Raet nasjonalpark til et robust nivå. Rapporten vil derfor, i hovedsak, vurdere soneforvaltning knyttet opp mot Naturavtalen (Kunming-Montreal protokollen).
2 - Innledning
Menneskelig bruk og påvirkning har medført et betydelig tap av naturmangfold i Norge og påvirkningen har økt de siste 50 årene. I marine økosystemer er det direkte utnyttelse (i hovedsak fiske) som har hatt den største relative påvirkningen globalt (Brondízio et al., 2019). I 2022 ble det global enighet om tiltak knyttet til ivaretakelse av natur og naturmangfoldet gjennom Kunming-Montreal-rammeverket for naturmangfold (ofte kalt Naturavtalen og en norsk oversettelse kan bli lest på nettsidene til Klima- og Miljødepartementet (KLD, 2023)). Formålet med rammeverket er å få på plass en gjennomgripende innsats fra regjeringer, samt regionale og lokale myndigheter, med involvering fra hele samfunnet, for å stanse og reversere tapet av naturmangfold. For å redusere truslene mot naturmangfold er det vedtatt en rekke mål. Mål 3 blir sitert i sin helhet her (KLD, 2023):
Sikre og legge til rette for at innen 2030 er minst 30 prosent av arealene på land og i elver og innsjøer, og av arealene langs kysten og i havet, spesielt områder som er særlig viktige for naturmangfold og økosystemfunksjoner og -tjenester, effektivt bevart og forvaltet gjennom økologisk representative, godt sammenhengende og rettferdig forvaltede systemer av verneområder og andre effektive arealbaserte bevaringstiltak, med anerkjennelse av urfolksområder og tradisjonelle områder der det er aktuelt, og integrert i større landskaper og sjø- og havområder, samtidig som det sikres at all bærekraftig bruk, der dette er aktuelt i disse områdene, fullt ut er i samsvar med bevaringsformål, og at urfolks og lokalsamfunns rettigheter anerkjennes og respekteres, herunder rettighetene til deres tradisjonelle områder.
Effektivt vern krever at det fungerer etter intensjonen. Er reguleringene svake i de marine verneområdene har det ingen effekt på biodiversitet, biomasse eller alders- og størrelsessammensetning sammenlignet med omkringliggende ikke-vernede områder. Som leder av Havpanelet advarte tidligere statsminister Erna Solberg (2020) mot «papirparker»; de eksiterer på papiret men bidrar ikke til naturbevaring. Det er begrenset kunnskap om hvilken effekt marine verneområder og nasjonalparker har i Norge i dag, men det er indikasjoner på at de i hovedsak kan karakteriseres som «ubeskyttet» (Roessger et al., 2022). I 2021 kom en Stortingsmelding om marin bevaring i Norge (Meld. St. 29 (2020-2021)) . En rapport fra Havforskningsinstituttet (Jørgensen et al., 2021) i forkant av Stortingsmeldingen poengterte at marine verneområder i Norge i dag har svakt vern mot fiskeri. Videre ble det pekt på at de marine nasjonalparkene i Skagerrak mest sannsynlig ikke kan defineres som et marint verneområde fordi industriell tråling tillates. Stortingsmelding 29 (2020-2021) kom med en rekke forslag til fremtidige tiltak på marint vern i Norge. Blant annet; Som eit ledd i arbeidet med bevaringstiltak og naturbaserte løysingar etablere eit pilotprosjekt i tilknyting til ein eller fleire av nasjonalparkane i området Skagerrak–Oslofjorden for å byggje opp igjen økosystem og byggje opp kunnskapen om effekt av slike tiltak. Videre har Regjeringen iverksatt et arbeid for å utarbeide en «Havlov» som også gjør det mulig å etablere marine verneområder utenfor territorialfarvannet (12 nautiske mil). Denne loven har vært på offentlig høring sommeren 2024.
Naturen i Skagerrak og langs Sørlandskysten er gjenstand for mange typer påvirkning som har resultert i den globale naturkrisen. Initiativet fra kommunene i Raet nasjonalpark og Agder fylkeskommune for prosjektet «Bevar Raet» kan sees i sammenheng med dette. Det erkjennes at vernet i Raet nasjonalpark ikke er godt nok til å ivareta naturmangfoldet. Det er derfor et mål å prøve ut nye metoder for å utforske hvordan vernet kan styrkes. Dette er metoder som har vist god bevaringseffekt i andre kyst- og havområder (se kap. 8), men som er relativt nye i norsk sammenheng. Samtidig kan det knyttes til kunnskapsbehovet om hvordan man effektivt kan bygge opp igjen (restaurere) økosystem i Skagerrak, jamfør Stortingsmeldingen 29 (2020-2021).
Det har vært økende oppmerksomhet langs Skagerrakkysten om økt næringstilførsel, formørkning av sjøvannet (Frigstad et al., 2023), tilgroing (Moy and Christie, 2012) , gradvis oppvarming (Knutsen et al., 2013; Barceló et al., 2016), hetebølger og tap av tareskog (Filbee-Dexter et al, 2020), endringer i dyreplanktonforekomster (Johannessen et al., 2012; Falkenhaug et al., 2022) og tilbakegang av viktige marine fiskeressurser som torsk (Sodeland et al., 2022), hummer (Kleiven et al., 2022) og reker (Cardinale et al., 2023). Data om det marine miljøets utvikling samles ofte inn i større skala og det er sjelden data tilgjengelig for å si noe om lokal variasjon, da dette krever intensiv lokal datainnsamling. Med tanke på vannkvalitet er det en rekke pågående tiltak knyttet til blant annet EUs Vannrammedirektiv (Vannportalen, 2024) . Samtidig har det vært økt oppmerksomhet rundt næringssalter, og eutrofiering spesielt, i tilknytning til den økologiske tilstanden i Oslofjorden (Klima- og Miljødepartementet, 2021) . Økte sjøtemperaturer er en konsekvens av menneskelige klimagassutslipp. Det er begrenset hva man kan gjøre lokalt for å redusere klimagassutslipp og klimaendringer, men endringene vil påvirke Raet nasjonalpark og er forventet å eskalere. Det er derfor et viktig spørsmål hvordan man skal sørge for at Raet nasjonalpark er robust nok til å kunne være motstandsdyktig for fremtidige miljøendringer. En måte å gjøre en bestand mer robust på er å sikre at den er av god nok størrelse til at genetisk variasjon og tilpasninger til endringer i miljøet bevares (Norderhaug et al., 2024).
Havforskningsinstituttet har blitt forespurt, og stilt seg positiv til, å være kunnskapsleverandør for «Bevar Raet»-prosjektet (18.11.2021, ref: 21/02015). Denne rapporten oppsummerer kunnskapsstatus om Raet nasjonalpark, vurdering av vernestatus og gjennomgang av hvordan soneringstiltak kan styrke ivaretakelsen av det biologiske mangfoldet i Raet nasjonalpark. Rapporten skal gi råd til beslutningstakere på lokalt og nasjonalt nivå, men har også et mål om å være nyttig for alle som engasjerer seg i Raet nasjonalpark og andre kystområder i Norge.
3 - Marine naturverdier i og rundt Raet nasjonalpark
Marine naturforhold og naturverdier i Raet nasjonalpark er beskrevet i rapporten fra Dahl et al. (2014). Rapporten dekker miljøforhold, fremmede arter, rødlistearter, bruk av Raet og kjente naturverdier og naturtyper. Innenfor naturtyper og naturverdier ligger blant annet skjellsandforekomster, bløtbunnsområder i strandsonen, ålegrasenger, større tareskogforekomster og gytefelt for torsk. Denne rapporten for «Bevar Raet»-prosjektet bygger på rapporten fra Dahl et al. (2014), slik at en del generell informasjon om Raet nasjonalpark ikke vil bli gjentatt. Status for ulike bestander er mindre dekket i Dahl et al. (2014). Dette kan nok skyldes at det ikke har vært på plass en direkte overvåkning med formål å dekke ulike naturtyper og bestander innenfor Raet nasjonalpark. Ved overvåkning av bestander, dekkes det gjerne større områder, slik som Skagerrakkysten. Raet nasjonalpark dekker både grunne områder med ålegress, tang og tareskog til dype områder ned i Norskerenna (dypere enn 400 meter). Kartlagte naturtyper er publisert i offentlige kart, blant annet i Naturbase (Miljødirektoratet) og Yggdrasil (Fiskeridirektoratet).
Raet nasjonalpark dekker et belte av ytre kystområde i Tvedestrand, Arendal og Grimstad kommuner. Større sjøområder på innsiden av Raet nasjonalpark (for eksempel Tromøysund, Oksefjorden/Tvedestrandsfjorden, Sandøyfjorden og Lyngørfjorden) er blant annet regionalt og lokalt viktige gyteområder for torsk (Figur 1). Det er derfor grunn til å forvente at torsk som lever i nasjonalparken bruker disse gyteområdene. Områdene på innsiden av nasjonalparken har mest sannsynlig også en viktig funksjon for andre arter som er tilknyttet nasjonalparken. Det er derfor viktig å se nasjonalparken og omkringliggende områder i sammenheng og vurderes inkludert i prosjektet.
3.1 - Norskerenna – Skagerrakrenna
Raet nasjonalpark er unik med at den dekker et transekt gjennom grunn til dyp marin natur som strekker seg ut i Norskerenna og derfor er store dypvannsområder også inkludert i nasjonalparken. Disse dypere områdene ble ikke inkludert i rapporten fra Dahl et al. (2014) som i hovedsak omhandlet områdene grunnere enn 100 meter. Norskerenna i tilknytning til Raet nasjonalpark og «Transekt Skagerrak» vil derfor få en grundigere gjennomgang i denne rapporten. Raet nasjonalpark sin yttergrense ligger 12 nautiske mil utenfor grunnlinjen. Dette er grensen for den juridiske rammen for Naturmangfoldloven og det er per i dag ikke hjemmel til å etablere marine verneområder utenfor 12 nautisk mil. Det er nå under utarbeidelse en ny lov (Lov om marine verneområder utenfor territorialfarvannet) som vil gjøre det mulig å etablere marine verneområder utenfor 12 nautiske mil (KLD, 2022). Loven har vært på offentlig høring sommeren 2024. I rådgivende utvalg til marin verneplan (Skjoldal, 2003, 2004) ble et transekt fra Tromøy og helt til dypet av Norskerenna foreslått (Figur 2). Transekt Skagerrak dekker 114 km2 utenfor 12 nautiske mil (dagens grense for Raet nasjonalpark). Dette kan bli aktuelt igjen med en ny lov. Det kan derfor være grunn til å inkludere hele dette området i prosjektet.
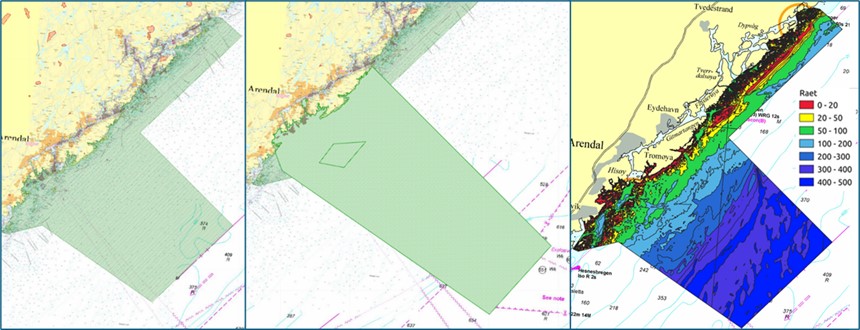
Figur 2 viser at store områder i Raet nasjonalpark er dypere enn 200 meter og det er betydelige arealer på mellom 4-500 meters dyp. Området er en del av en dypvannsrenne (Norskerenna) som kiler seg inn i Skagerrak og representerer et dyphav i miniatyr, gjerne kalt Skagerrakrenna. Dette dyphavet har betydning for tilførsel av Atlantiske vannmasser inn i Skagerrak (Figur 3) og innehar en rekke dypvannsarter og økosystemprosesser som er unikt for den ellers grunne Nordsjøen (Buhl-Mortensen et al. 2023).
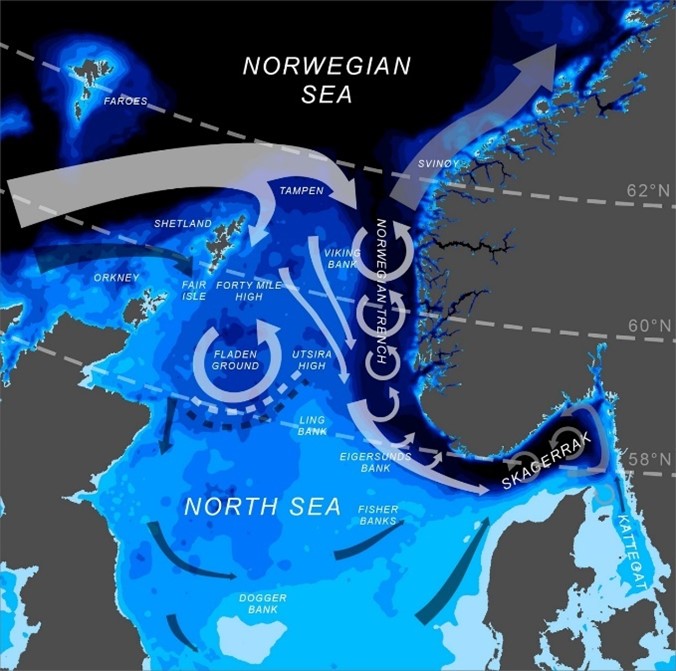
Siden Skagerrakrenna er den østligste delen av Norskerenna, er det viktig å forstå hva slags betydning hele Norskerenna har for både norskekysten og store deler av Nordsjøen. I en miljøverdivurdering basert på EBSA (Ecologically or Biologically Significant marine Area) metoden, ble Norskerenna, inkludert Skagerrakrenna, identifisert som et særlig verdifullt havområde basert på en rekke særlig verdifulle og sårbare arter og dyresamfunn i tillegg til viktige funksjoner for økosystem både i renna og i grunnområdene inn mot kyst og utover i Nordsjøen ( Meld. St. 21 (2023–2024), Eriksen et al., 2021). Dette tverrfaglige arbeidet ligger til grunn for miljøverdibeskrivelsen i Norskerenna. Det betydelige dypet i et ellers grunt sokkelhav, fører til at Norskerenna har unike lys-, temperatur-, strøm- og andre fysiske miljøforhold. Nedover i dypet er vannet mørkere, kaldere og saltere enn i Nordsjøens grunnere områder.
3.1.1 - Miljøverdier i Norskerenna
Norskerenna huser en stor andel mesopelagiske arter, både i form av dyreplankton, fisk og hval. Mesopelagisk sone er frie vannmasser som ligger så dypt at lite lys trenger ned dit (under 100-200 meter) men likevel over bunnen. Mange dyr i den mesopelagiske sonen døgnvandrer og beveger seg opp mot overflaten om natten for å beite på plante- og dyreplankton.
Blant disse artene inngår dyreplanktonarter som ikke opptrer i grunne områder av Nordsjøen, der maneter og en rekke krepsdyr som pelagiske reker, maneter, krill og store hoppekreps har en viktig plass i næringsnettet (Calanus hyperboreus, Paraeuchaeta norvegica) (Bergstad, 1991a; Bakketeig et al., 2017; Franzè et al., 2023). Det er i tillegg forekomster av betydelige mengder krill i Norskerenna, særlig storkrill (Meganyctiphanes norvegica), som har vist seg å være viktig føde for en rekke fiskearter i dette området (Bergstad, 1991a) .
Raudåte (Calanus finmarchicus) er en nøkkelart i det marine næringsnettet og har stor betydning for rekruttering og overlevelse hos en rekke fiskearter langs kysten. Mengden av raudåte i Skagerrak er avhengig av tilførsel fra havområdene utenfor Nordsjøen (Gao et al., 2021). Denne innstrømningen av raudåte foregår i Norskerenna, der atlanterhavsvann strømmer inn fra nord og følger vestskråningen av Norskerenna inn i Skagerrak. Bestanden av raudåte i området er derfor en kombinasjon av advektiv tilførsel og lokal produksjon. Gjennom sesongen foregår også egenproduksjon av C. finmarchicus i kystområdet, men det er ikke kjent hvor stor denne er i forhold til tilførselen. Raudåte overvintrer på store dyp for å redusere energiforbruket i vintermånedene (diapause), men fjordene langs Skagerrak er for grunne til å kunne opprettholde en stor stående biomasse av denne arten gjennom vinteren. Norskerenna er det eneste området i Nordsjøen/Skagerrak hvor raudåte overvintrer (Heath et al., 2004; Melle et al., 2014, Falkenhaug pers. obs.). De dype områdene i Norskerenna er derfor særdeles viktige som reservoar for raudåte og forsyner nærliggende kystområder tidlig vår da den vandrer opp til overflaten for å gyte. Denne overvintringspopulasjonen kan derfor ha stor betydning for å opprettholde populasjonene av C. finmarchicus langs Skagerrakkysten.
I Norskerenna overvintrer raudåte ved temperaturer på 7-8ºC (Heath et al., 2004), som er adskillig varmere enn foretrukket temperatur for overvintring (3–6°C). Dette gjør populasjonen i dette området sårbar for oppvarming. Basert på områdets betydning for plankton, ble Norskerenna foreslått som nytt SVO i 2021 (Eriksen et al., 2021). Rapporten avdekker imidlertid flere kunnskapshull om mengder, utbredelse og sårbarhet hos overvintrende raudåte i Norskerenna.
Bestanden av dypvannsreke i Skagerrak/Norskerenna er mye større enn de små geografisk adskilte rekefeltene langs norskekysten (Hjort and Ruud, 1938; Søvik and Thangstad, 2021). Slik sett utgjør rekebestanden i Norskerenna/Skagerrak et viktig reservoar for rekene nordover langs kysten. De dypere områdene av Skagerrak kan bli et klimarefugium for dypvannsreke i sør når havet varmes opp ytterligere. Dypvannsreke har sin sørligste utbredelsesgrense i Nordøst-Atlanteren nettopp i Nordsjøen og Skagerrak (NAFO/ICES, 2022) .
Det er ikke registrert dypvannskoraller i Raet nasjonalpark, men det behøver ikke å bety at de ikke finnes. Bambuskorallen (Isidella lofotensis) er en bløtkorall som finnes mange steder i norske kyst- og havområder. Den er vurdert som «nær truet» i norsk rødliste (Tandberg A.H.S and Mortensen, 2021). I en nylig publisert studie ble det ikke identifisert bambuskorall i Raet nasjonalpark (Buhl-Mortensen et al., 2023). Studien fant derimot større forekomster av sjøfjær og piperensere (Figur 4) på bløtbunn i de dypere områdene i og rundt Raet nasjonalpark. I den vestlige del av Norskerenna er det påvist høy tetthet av bambuskorall og sjøfjær, noen av de rikeste forekomstene av bambuskorall i Norge bortsett fra noen forekomster i fjorder. På dyp under 200 m er det mest mudderbunn med mudderbunndyr av andre arter og samfunn enn på platåene i Nordsjøen der sand-, grus- og hardbunn dominerer (Bergstad, 1991a, 1991b) .
Dyreplankton, reker og flere fiskearter er viktig føde for arter med tilhold i Norskerenna, inkludert sårbare rovdyr som håkjerring (upublisert data) og nebbhval (Stavenow et al 2022, Mokoroa-Alberdi 2024). Også fisk, sjøfugl og sjøpattedyr på grunnere områder langs renna og inn mot kysten beiter på arter som har opprinnelse og refugium i Norskerenna. Artsrikdommen og næringsgrunnlaget tiltrekker seg sel og andre sjøpattedyr, samt. fiskespisende og overflatebeitende sjøfugl som hekker langs Skagerrakkysten (Fauchald et al., 2015; Nilssen and Bjørge, 2019).
I det årlige reketråltoktet i og ved Nordsjøen og Skagerrakrenna har det blitt registrert 66 ulike fiskearter i perioden 2006-2022 (Paulsen, 2023). Disse beiter på krepsdyrplankton og maneter fra dypet i Norskerenna. Siden Nordsjøen og Skagerrak består av hovedsakelig grunne havområder, er Norskerenna det eneste området i Nordsjøen der dypvannsfisk kan leve (Bergstad, 1991a, 1991b). I dypet er laksesild (Argentina silus) en dominerende art, men også skolest (Coryphaenoides rupestris) finnes bare her i hele Nordsjøbassenget. Vassild (Argentina silus) finnes langs hele norskekysten, men i Nordsjøen bare i Norskerenna, inkludert i Skagerrakrenna. Dette er sentvoksende og langtlevende arter og derfor sårbare for høsting. Skolesten har vært vernet siden 2006. Arten er dessuten avhengig av overvintrende hoppekreps, særlig raudåte, mens vassild i stor grad lever av manet (Bergstad, 1991a, 1991b; Bergstad et al., 2014). Andre fiskearter beskrevet i Skagerakrenna er blant annet kloskate, piggskate, rundskate, hvitskate, havmus, lysprikkfisk og gapeflyndrer (Bergstad, 1990) . Dette er ikke en fullstendig liste av dypvannarter i Skagerrakrenna, men viser mangfoldet. I prosjektet «SAMSKAG» finansiert av Nordisk Ministerråd gjennomføres det nå en analyse av Havforskningsinstituttets reketokt i Nordsjøen og Skagerrak. Dette er tidsserier der det samles inn data fra en rekke stasjoner (med trål) og startet opp i 1991. All fangst registreres og en rekke arter måles. Informasjon fra disse analysene vil bli inkludert som kunnskapsgrunnlag i «Bevar Raet»-prosjektet.

3.2 - De frie vannmasser
3.2.1 - Næringssalter, status og utviklingstrekk
Nitrogen og fosfor er nødvendige næringssalter for vekst av alger i sjøen, både mikroalger og makroalger. Nitrat regnes ofte å være det begrensende næringsstoffet for den årlige produksjonen av planktonalger. Kyststrømmen vår er naturlig næringsrik fordi underliggende, næringsrike vannmasser strømmer opp til de øvre lag av kyststrømmen mens den renner vestover. Utover 1970- og 1980-tallet ble i økende grad næringssalter ført til våre kyster fra sydlige Nordsjøen med havstrømmene. Forhøyet tilførsel av næringssalter medførte økt planteplanktonproduksjon og flere og mer intense oppblomstringer av potensielt skadelige alger i Skagerrak (Dahl et al. 2005). I siste halvdel av 1990-tallet ble det registrert en avtagende mengde av uorganisk nitrogen, særlig nitrat, som følge av rensetiltak og reduksjon i langtransporterte næringssalter (Aure & Magnusson 2008; Aure, Danielssen & Naustvoll 2014). I tillegg til langtransporterte næringssalter påvirker lokale tilførsler næringssaltkonsentrasjonen på kysten av Agder. Det foreligger ikke systematiske målinger over tid fra de indre, beskyttede områdene (indre skjærgård og fjorder) på Agder. Sommeren 2023 ble det gjennomført en sommerundersøkelse som dekket Hølen, Galtesund, Tyholmen, Hovekilen og Utnes. Selv om dette var en enkelt dekning, var det markante forskjeller mellom disse stasjonen og stasjonen i kyststrømmen (Torungen). For Fosfat var det 1-2 µgP/l høyere konsentrasjoner i de indre områdene sammenlignet med kyststrømmen, mens det for nitrogen var mellom 1-6 µgN/l. Lokalitetene Hølen og områder nedstrøms hadde betydelig høyere næringssaltkonsentrasjoner enn i kyststrømmen. Selv om dette var en enkeltstående undersøkelse (kun sommerperioden 2023), viser dataen at det kan være betydelige høyere næringssaltkonsentrasjoner i de indre kystnære sund og fjorder av Agder sammenlignet med målepunkt i kyststrømmen. Dette viser at det kan være store lokale variasjoner i tid og rom og årsakene kan både være naturlige og menneskeskapt. Et fremtidig overvåkningsprogram av næringssalter i kystnære farvann må ta hensyn til denne variasjonen.
3.2.2 - Tilstandsvurderinger næringssalter og utvikling over tid
I vannforskriften inngår næringssalter (nitrat, nitritt, ammonium, fosfat, totalt nitrogen og fosfat) som støtteparametere, men benyttes samtidig til vurderinger av tilstanden når det gjelder eutrofieringsbelastninger. I vurderingen skal data fra vinterperioden brukes som skal avdekke stor-skala eutrofieringseffekter, samt sommerperioden med fokus på lokalt bidrag til eutrofiering. Basert på systematiske data fra sommerperioden (juni-august) og vinterperioden (desember-februar) er det til denne rapporten foretatt en analyse av tilstanden basert på vannforskriftens metodikk for perioden 1980-2023. Vurderingen er foretatt på 3-årsperioder, for å fange opp eventuell naturlig variasjon.
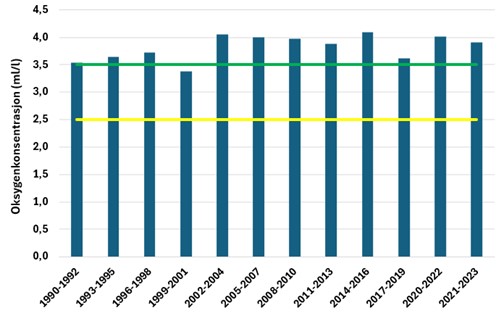
I Figur 4 er tilstandsvurderingen gitt for sommerperioden ved Ærøydypet for parameterne fosfat og nitrogen. Basert på næringssaltvurderinger er den samlede tilstanden for Ærøydypet «svært god» og det har vært en bedring i næringssaltforholdene siden siste halvdel av 1990. For fosfat har tilstanden vært «svært god» hele perioden. Konsentrasjonen har variert en del mellom de enkelte vurderingsperiodene og det har ikke vært noe klare trender i dataene. For nitrogen har det vært en utvikling mot bedre tilstand. Fra 2001 frem til i dag har tilstanden vært «svært god», mens den i perioden før varierte noe mer. I periodene 1983-1985, 1986-1988 og 1998-2000 var tilstanden «moderat» ved Ærøydypet i sommertilstanden. En vurdering basert på ett år data i mer indre stasjoner (sommer 2023) viste at både «Hølen» og utløp av Nidelva ved Utnes hadde tilstand «god» for henholdsvis fosfat og nitrogen, noe som viser at det kan være forskjeller innen små områder. Tilsvarende vurderinger for vinterperioden er gitt i Figur 5. Også for vinterperioden (desember-februar) er det en bedring i tilstanden over tid. Før 2001 var tilstanden «god», mens den fra 2002 og frem til i dag er i tilstandsklasse «svært god» og har vist avtakende konsentrasjoner av nitrogen. Tilstandsvurderinger basert på fosfat viser «god» tilstand frem til 1992, for deretter stort sett falle ut i «svært god» tilstand for fosfat i vinterperioden. Etter 1992 har fosfatkonsentrasjonen vært mer eller mindre stabil i vinterperioden.
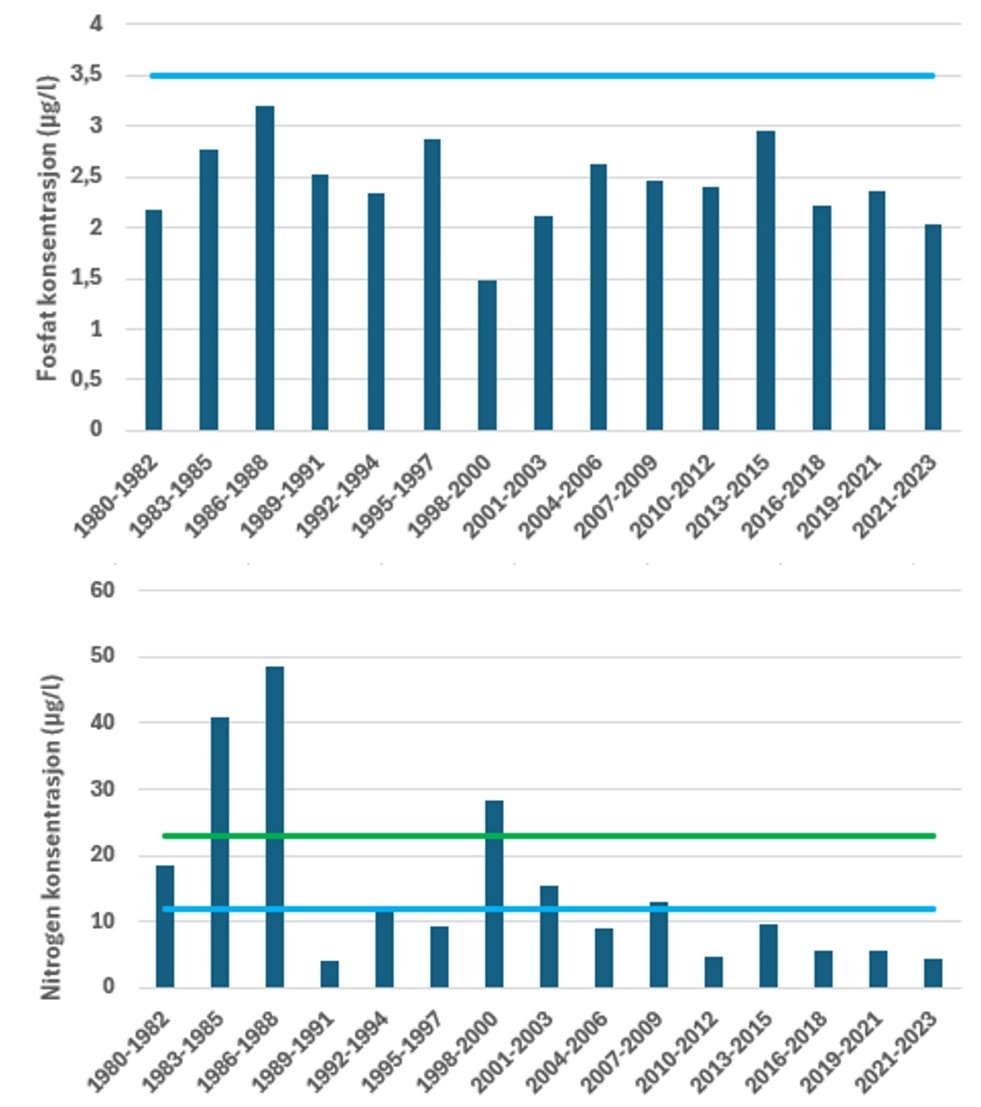
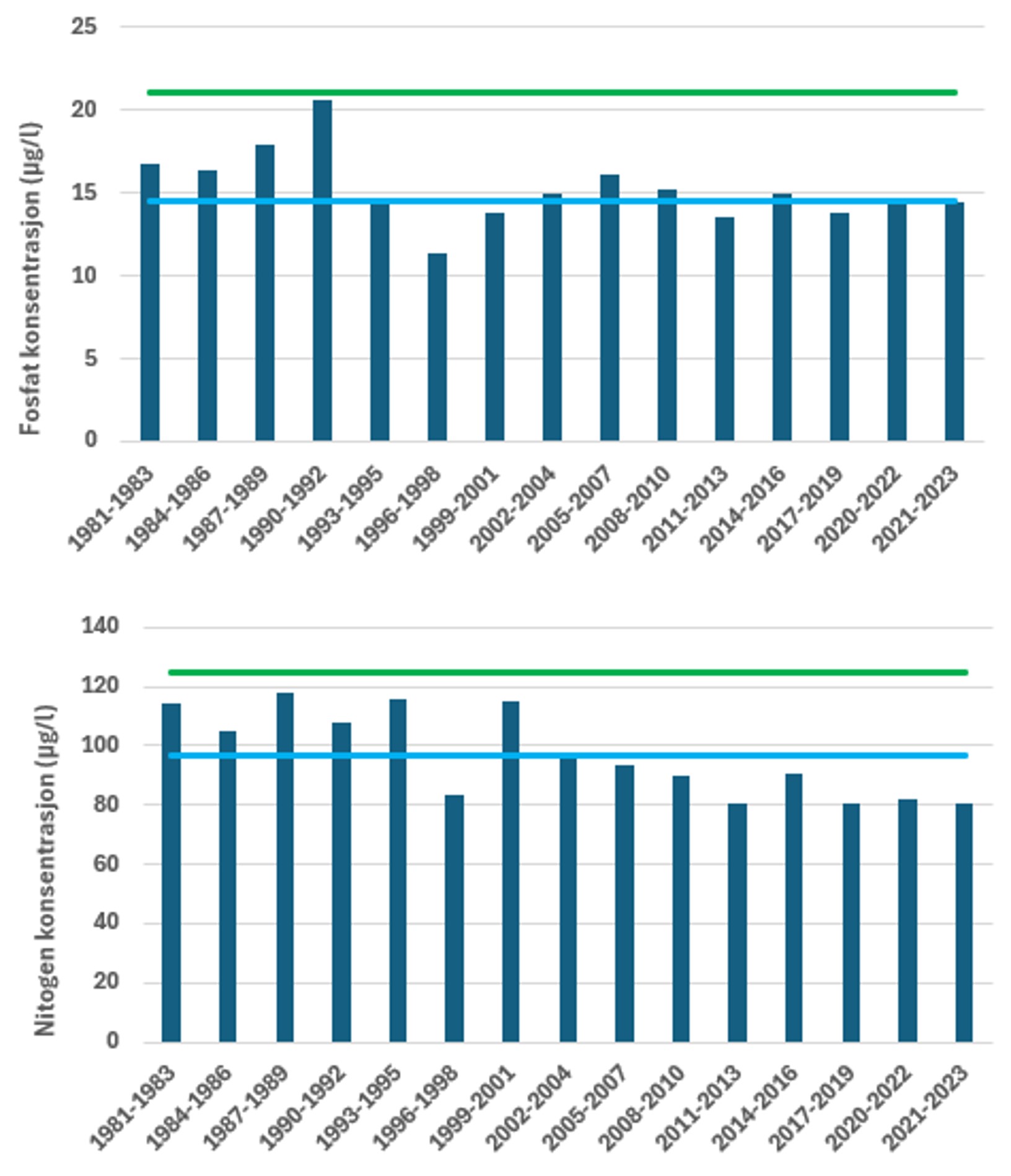
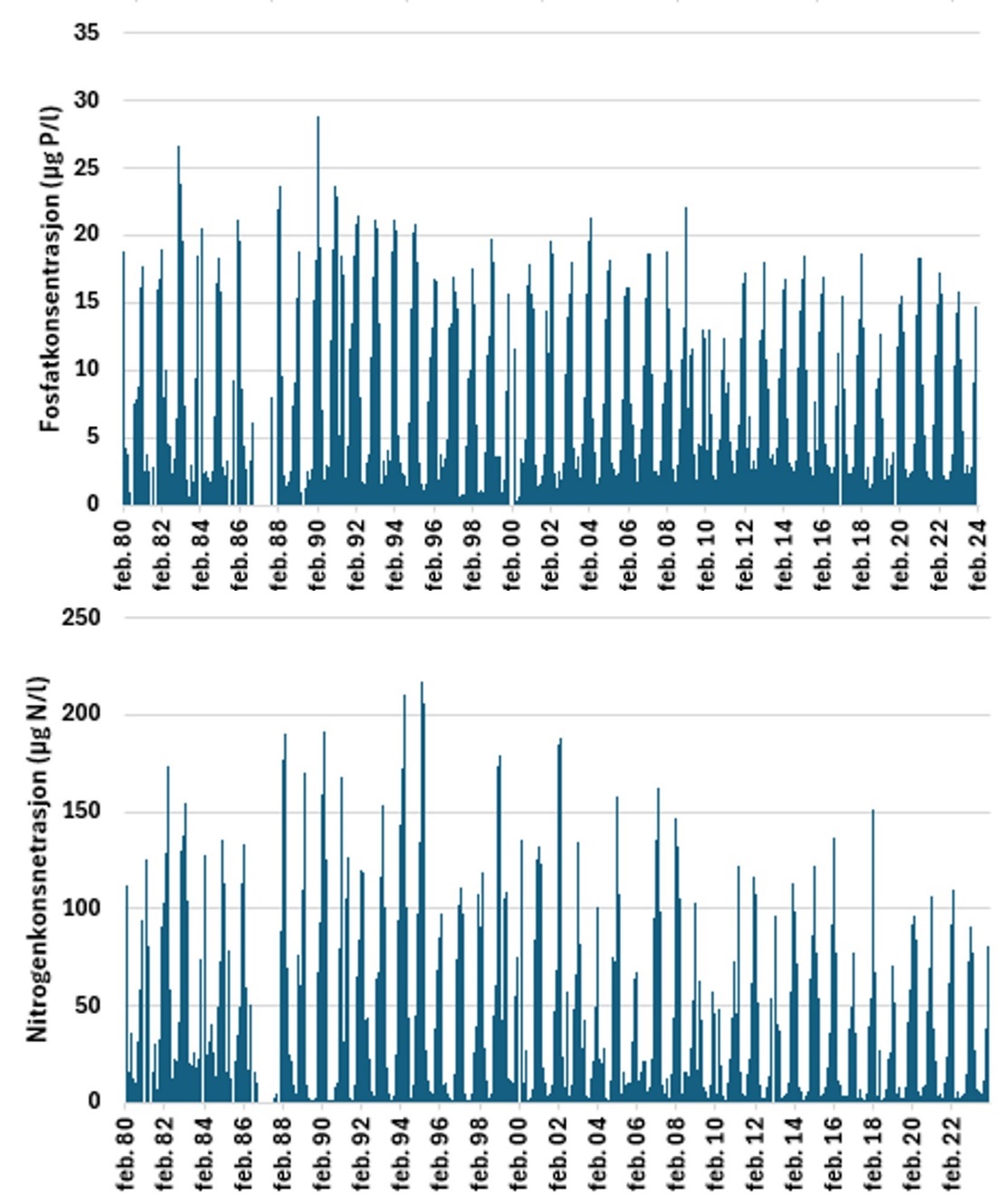
Stasjonen «Torungen» inngår i det nasjonale overvåkningsprogrammet «Økokyst delprogram Skagerrak», der det er foretatt tilstandsvurderinger basert på næringssalter jevnlig siden 1990-tallet (eks. Lundsør et al. 2023). Næringssaltforholdene i kyststrømmen i perioden 1980-2023 er vist i Figur 6. I likhet med Ærøydypet har næringssaltkonsentrasjonene gått ned siden årtusenskiftet og dagens konsentrasjon av nitrogen og fosfat er også lavere enn ved oppstart av overvåkningen i 1980. I perioden 1980-2023 har konsentrasjonen av fosfat variert, fra relativt høye vintermaksimum frem til 2004, for deretter å avta frem til 2024. For fosfat er det først og fremst reduksjon i vinterkonsentrasjonen, mens sommerkonsentrasjon har vært relativ stabil hele perioden. For nitrogen har det vært en økning i perioden fra 1980 frem til ca 1995, deretter avtakende konsentrasjoner av nitrogen frem til 2011 i vinterperioden. For perioden 2012-2023 har vinterkonsentrasjonen variert uten noen klar trend. Sommerkonsentrasjonen av nitrogen viser samme utvikling i perioden 1980-2023 som vinterperioden, selv om variasjonen mellom årene har vært noe større.
3.2.3 - Planteplankton, status og utviklingstrekk
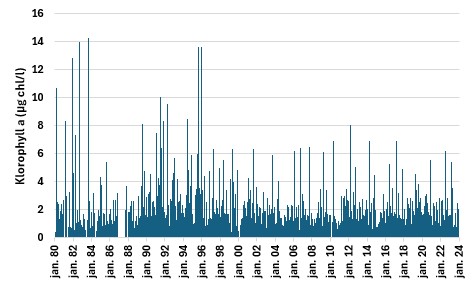
Systematisk overvåkningen av planktonalger utenfor Arendal går tilbake til 1980-tallet. Den viser at vi normalt har en våroppblomstring av kiselalger i februar-mars, lite alger gjennom sommeren, og av og til høstoppblomstringer, ofte preget av gruppen fureflagellater om høsten. Figur 7 viser planteplanktonbiomassen, uttrykt som klorofyll a (µg/l) for overvåkningspunktet «Arendal». Dataene viser relativt høy biomasse av planteplankton frem til siste halvdel av 1990-tallet, for deretter å avta. I de påfølgende årene er det enkelte topper i biomassen, men generelt en reduksjon. Data fra Flødevigen (ikke vist) gir mer detaljert informasjon omkring planteplanktonbiomassen. Data fra denne stasjonen viser samme overordnede mønster, men i tillegg viser dataene en ytterliggere reduksjon fra 2001. Denne reduksjonen knyttes til bortfallet av høstoppblomstringen, som etter 2001 bare har forekommet sporadisk. Siden 2002 har våroppblomstringene i gjennomsnitt kommet litt tidligere enn før. Årsaken til disse forandringene er foreløpig ikke omfattende analysert, men mindre nitrat til Nordsjøen og Skagerrak kan ha redusert oppblomstringer av fureflagellater, og skifter i klima kan tenkes å påvirke oppblomstringstidspunkter på våren.
3.2.4 - Tilstandsvurderinger basert på klorofyll a
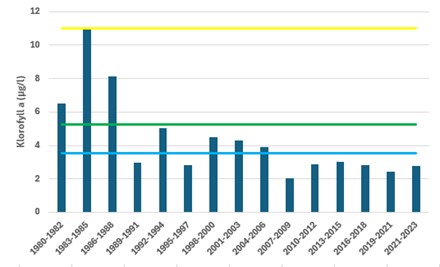
I forbindelse med tilstandsklassifisering av en vannforekomst benyttes både biologiske og kjemiske parametere (kvalitetselementer) i forbindelse med «Vannforskriften». For det pelagiske miljøet benyttes klorofyll a, som et mål på planteplanktonbiomassen i den biologiske tilstandsvurderingen av eutrofieringsbelastning. I Figur 8 er det endringer i tilstanden basert på planteplankton ved lokaliteten «Ærøydypet» gitt. Tilstanden har variert fra «Moderat» til «Svært god» ved denne lokaliteten. I perioden fra 1980 til 1988 var tilstand «moderat», deretter fulgte en periode (1992-2006) med «god» tilstand. I de senere årene har tilstanden basert på planteplankton biomasse vært «svært god» i «Ærøydypet». Tilstandsvurderinger for kystvannet (stasjon «Arendal») viser langt på vei samme utvikling, men en bedring i forholdene fra 1980-90 tallet frem til i dag. Ved siste vurdering (perioden 2021-2023) var tilstanden ved «Arendal» også «svært god».
3.2.5 - Oksygenforhold
Forhold i de frie vannmasser kan påvirke vannkvaliteten i dypere lag. Økte tilførsler av nitrat fra sydlige Nordsjøen fra rundt 1980 kan ha gitt større og hyppigere høstoppblomstringer fra den tiden. Det kan igjen ha gitt økt sedimentasjon av organisk plantemateriale til bassengene i terskelfjorder langs kysten av Skagerrak, og ført til at oksygenforbruket økte og oksygenforholdene etter hvert forverret seg i mange fjordbasseng langs kysten. I tillegg til den pelagiske produksjonen vil tilførsel ved elveavrenning ha stor betydning for den organiske belastningen. De topografiske forholdene, oppholdstiden av bunnvannet, vil styre utskiftningsraten i et fjordbasseng. Det er ikke mange dypere basseng innenfor Raet, mest fremtredende er Ærøydypet (160 m) og Gråholmdypet (198 m). Data fra Ærøydypet viser at dette området har årlige utskiftninger av bunnvannet og godt forhold i bunnvannet. I perioden 1990-2023 har det vært en svak bedring i minimumskonsentrasjon på høsten i Ærøydypet (Figur 9). Bare i pollen Sandumkilen, innenfor Hovekilen, kan det oppstå oksygensvikt i bunnvannet innenfor Raet, så langt vi har oversikt. Oksygensvikt i bunnvannet skyldes produksjon av hydrogensulfid (H2S). Lokaliteter som ligger i den ytre eksponerte delen av Raet vil ikke oppleve oksygensvikt eller perioder med stort oksygenforbruk. Ved stasjonen «Arendal» er det jevnlige utskiftninger av bunnvannet og oksygenkonsentrasjonen viser liten svingning gjennom året.
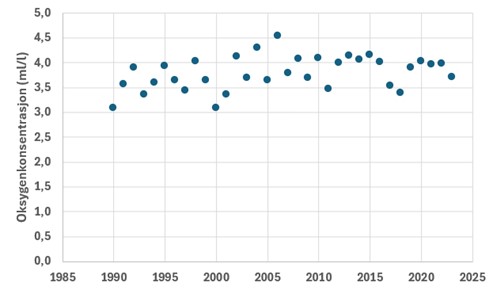
Tilstandsvurderinger basert på oksygenmålinger er vist i Figur 10 for perioden 1995-2023. I hele denne perioden har tilstanden blitt vurdert som «god». I perioden 1990 – 98 var konsentrasjonen noe lavere og så vidt innenfor tilstandsklasse «god». Unntaket var perioden 1999-2001 da tilstanden var «moderat». Dette var innenfor perioden med relativt høy pelagisk produksjon (planteplankton) som kan være årsaken til høyere forbruk i dypet.
3.3 - Dyreplankton
Dyreplankton omfatter alle former for dyr som driver fritt i vannmassene, og utbredelsen bestemmes derfor i stor grad av havstrømmene. De fleste dyreplanktonartene lever hele livet i de frie vannmassene (holoplankton), som for eksempel kopepoder og krill. Til dyreplankton hører også fiskelarver, fiskeegg og larver av bunnlevende organismer som oppholder seg i de frie vannmassene kun i de tidlige fasene av livsløpet (meroplankton).
Dyreplankton har en nøkkelrolle i det marine næringsnettet og bidrar til flere viktige økosystemtjenester (Botterell et al., 2023). Herbivore dyreplankton beiter på planteplankton, mens de selv spises av organismer på høyere trofiske nivå, som fisk og sjøfugl. Slik transporteres energien fra primærprodusentene og oppover i næringskjeden. Krepsdyr, og særlig kopepoder, er viktigst for energiomsetningen i det pelagiske økosystemet. Unge individer av raudåte (Calanus finmarchicus) er viktig føde for fiskelarver, og kan ha betydelig innflytelse på rekrutteringen av fiskebestander. Blant dyreplankton finner vi også flere rovdyr, for eksempel krill, amfipoder og pilorm som beiter på andre dyreplankton. En annen viktig komponent i planktonet er ulike arter av maneter (også kalt geleplankton), som er særlig tallrike i kystnære områder. Maneter livnærer seg av annet dyreplankton og kan utøve et sterkt beitepress på andre organismer i systemet. De ulike gruppene av dyreplankton inngår i et komplekst næringsnett og variasjoner i mengder og sammensetting av dyreplankton vil derfor ha store konsekvenser for produksjon på høyere nivå. Dyreplankton spiller også en rolle for klima og hvordan CO2 blir absorbert av havet. Ved å beite på planteplankton i de øvre vannlagene og så vandre eller synke ned i dypet, transporteres karbon fra atmosfæren til havbunn der det kan lagres i lang tid (the Biological Carbon Pump, BCP; Steinberg and Landry, 2017) .
Dyreplankton har blitt overvåket ved Arendal, utenfor Torungen (1 nautisk mil) siden 1994. I de øvre vannlag i Raet nasjonalpark er dyreplanktonet dominert av store herbivore kopepoder i vårperioden, som for eksempel raudåte (C. finmarchicus), mens C. helgolandicus og små kopepoder (Pseudocalanus, Oithona) dominerer senere på sesongen. I de dypere lagene lenger ut fra kysten forekommer krill, pelagiske reker, amfipoder samt store kopepoder (C. hyperboreus, Paraeuchaeta norvegica). Området i og rundt Raet nasjonalpark har relativt høye forekomster av raudåte med opptil 80 % av den totale biomassen av dyreplankton i vårsesongen. Dette kan ha sammenheng med nærheten til lokale overvintringspopulasjoner i Norskerenna samt tilførsel med innstrømmende atlantisk vann fra Norskehavet (Gao et al., 2021; Falkenhaug et al., 2022).
Dyreplankton er sårbare for klimaendringer, avrenning fra land og fremmede arter. Flere av artene i Raet nasjonalpark befinner seg nær øvre tålegrense for temperatur, og er derfor ekstra følsomme for andre menneskeskapte endringer i miljøet. Utslipp av næringssalter påvirker dyreplankton indirekte på grunn av endringer i planteplanktons vekst og sammensetning (Zervoudaki et al., 2009). Økt avrenning fra land med partikulært organisk materiale (POM) og oppløst organisk materiale (DOM), forårsaker mørkere kystvann som kan gi konkurransefortrinn for taktile predatorer som maneter, på bekostning av visuelle predatorer som fisk (Aksnes et al., 2009).
Som følge av stigende temperaturer har raudåte gått kraftig tilbake i Skagerrak, samtidig med at den mer varmekjære artsfrenden C. helgolandicus har økt. Sistnevnte gyter seinere på året og er mindre næringsrik mat for fisk og sjøfugl. I tillegg er sesongsyklusen hos raudåte i Skagerrak forskjøvet med en måned de siste 20 årene (Falkenhaug et al., 2022). I samme periode har kopepodene Pseudocalanus og Paracalanus avtatt med 80% (Johannessen et al., 2012; Alvarez-Fernandez, S. Licandro et al., 2015). Disse endringene har ført til redusert sekundærproduksjon, lavere total dyreplanktonbiomasse samt et endret sesongmønster hos dyreplankton.
Raudåte overvintrer på store dyp og høyere temperaturer vil føre til økt metabolisme, og forkorte overvintringsperioden. Stigende temperaturer samt lave oksygennivåer i Norskerenna som følge av klimaendringer vil redusere mulighetene for overvintring av raudåte i dette området.
Introduksjon av fremmede dyreplanktonarter har en negativ innvirkning på stedegne arter gjennom konkurranse, predasjon og overføring av parasitter. Stigende havtemperaturer og båttrafikk fra andre havområder øker sannsynligheten for at flere fremmede arter etablerer seg i Raet nasjonalpark. Et eksempel på dette er den fremmede arten Amerikansk lobemanet (Mnemiopsis leidyi) som ble introdusert i Skagerrak i 2005 ( Hosia and Falkenhaug, 2015) . Maneten kan ha stor innvirkning på økosystemet gjennom høy predasjon på kopepoder som igjen medfører økning i mengden av planteplankton (kaskadeeffekt, Dinasquet et al., 2012) .
3.4 - Blå skoger
Blå skog er tangbelter, tareskog og ålegressenger som i likhet med skog på land er viktige levesteder for mange arter, også mennesker. De produserer mat, danner skjulesteder, oppvekstområder og myldrer av smådyr og fisk, og gir oss mange økosystemtjenester (Eger et al., 2023; UNEP, 2023). Blå skog spiller også en rolle for klimaet ved at de tar opp og lagrer karbon, såkalt blått karbon ( Krause-Jensen and Duarte, 2016) . Karbonet bindes i stående biomasse av tang, tare, ålegress og planteplankton gjennom fotosyntese. En ukjent, men antagelig stor del av det organiske materialet fra døde alger synker ned på dypt vann og lagres mer permanent i sedimentene.
I Raet nasjonalpark er det registrert 87 ålegressenger med et samlet areal på 0,87 km2 (Dahl et al., 2014). I tillegg er det større arealer av ålegress i gruntvannsområder på innsiden av Raet nasjonalpark. De to viktigste tareartene i Raet er stortare og sukkertare. Stortare, som man blant annet finner på moreneryggen, «raet», vokser i hovedsak på stein- og fjellbunn (hardbunn) i bølgeeksponerte områder. Det er beregnet at det er 33,6 km2 med tareskog i Raet nasjonalpark (Dahl et al., 2014). Sukkertaren vokser på hardbunn i mer beskyttede områder som ikke blir mye påvirket av bølger. Skagerrak er et randområde for sukkertarens tålegrense for temperatur og den har vist seg å være sårbar for høye sommertemperaturer (Filbee-Dexter et al. 2020). Tangbeltet i tidevannssonen består av en rekke ulike arter som grisetang, blæretang og sauetang. Figur 11 viser kartlagte områder for ålegress og stortare i og rundt Raet nasjonalpark.
Den blå skogen trues av klimaendringer og den intense aktivitet til mennesker i kystsonen. Overfiske fører til kollaps i økosystemene, global oppvarming truer blå skog i randområder og utslipp av næringssalter og avrenning fra land fører til dårlig vannkvalitet og formørkning (UNEP, 2023) . Globalt tapes 1,8% av verdens tareskoger hvert år (Krumhansl et al., 2016) og så mye som 7% per år for ålegress (Waycott et al., 2009).
I Skagerrak og Raet har mesteparten av sukkertareskogen forsvunnet siden årtusenskiftet på grunn av intensifiering av hetebølger (Filbee-Dexter et al., 2020). Sukkertaren utkonkurreres av hurtigvoksende, trådformede alger (såkalt «lurv») som dekker bunnen som tepper og hindrer ny sukkertare å spire. Tilstanden for stortaren i mer bølgeeksponerte områder er god (Lundsør et al., 2023) og ålegress ser ut til å øke i Skagerraksområdet som omfatter Raet (data fra Havforskningsinstituttets strandnotserie).
3.5 - Skjellforekomster
Det finnes flere skjellarter i Raet nasjonalpark. Mest kjent er nok arter som blåskjell og østers. Andre arter som også er å finne i nasjonalparken er knivskjell, hjerteskjell, kamskjell, O-skjell og kuskjell. Stillehavsøsters er en introdusert art som potensielt kan danne rev og påvirke naturlige habitater.
3.5.1 - Flatøsters (Ostrea edulis)
Flatøsters finnes fra Marokko i syd, i Middelhavet, Svartehavet, og nordover langs kysten av Europa nord til Trøndelag. Flatøsters lever like under tidevannssonen og ned til noen få meters dyp. Tidligere fantes det store bestander av flatøsters i nesten hele Europa. Disse er så å si forsvunnet på grunn av overfiske, bruk av destruktive høstemetoder, forurensning og østerssykdommen bonamiose (Mortensen et al. , 2023; Pouvreau et al. , 2023) .
I Norge er det ikke tillatt å høste østers med bunnskrape, noe som gjør at flatøsters ikke er overbeskattet i like stor grad i Norge som i deler av Europa. I tillegg er det kun østers i Norge og Sverige som er dokumentert fri for bonamiose, en østerssykdom som kan utrydde hele bestander (Mortensen et al. , 2020, 2023) . Våre levedyktige og friske flatøstersbestander i Sør-Norge er derfor særlig unike og verdifulle.
Mellom 2021 og 2023 har UiA kartlagt flatøsters mellom Risør i øst og Karmøy i vest. I noen områder er det funnet banker eller østersrev med mer enn fem individer per kvadratmeter. Dette er blant annet i Arendal og Tvedestrand. I Sørlandsleia, innenfor Flosterøya, er Norges eneste fredningsområde for Europeisk flatøsters. Dette området har en av de tetteste østersbestandene som er registrert i Norge og er mest sannsynlig et viktig rekrutteringsområde for østers i større omkringliggende områder. Østers var også, fra 2012 til 2023, fredet i Kvastadkilen. En kartlegging av østers i Tvedestrand ble gjennomført i 2021-2022 (Marcussen et al. , 2024) .
3.5.2 - Stillehavsøsters (Magallana gigas)
Stillehavsøsters er en av verdens viktigste oppdrettsarter og har blitt introdusert over nesten hele verden som akvakulturart. Den ble introdusert i Europa i 1960-årene og har gradvis spredd seg ut fra dyrkingsområdene. Stillehavsøstersen er svært tilpasningsdyktig og etablerer raskt ville bestander utenfor dyrkingsområdene. Larvene spres med strømmen til nye områder. Stillehavsøsters ble observert i Norge på starten av 2000-tallet (Bodvin et al., 2014), og finnes nå langs store deler av kysten i Sør-Norge og helt nord til Møre og Romsdal (Mortensen 2022). Stillehavsøsters lever hovedsakelig i tidevannssonen, men har også blitt observert på dypere vann ned til ca. 5 meters dyp.
Det er nå akseptert at stillehavsøstersen er permanent etablert i våre farvann. Selv om de er klassifisert som fremmed art, så endres gradvis fokus fra å se stillehavsøsters som problem til en ny og spennende matressurs (Mortensen et al., 2022). Mange steder organiseres det ryddeaksjoner for å fjerne stillehavsøsters fra områder hvor de er i konflikt med rekreasjon eller sårbare naturtyper (blåskjellenger eller flatøstersrev). Fjerning av stillehavsøsters stanser ikke videre spredning, men kan være aktuelt for å redusere at arten dominerer sårbare habitater, eksempelvis tette og verneverdige flatøstersbestander. Stillehavsøsters er observert flere steder i Raet nasjonalpark, blant annet er det observert og ryddet større tettheter i Hovekilen.
3.5.3 - Blåskjell (Mytilus spp.)
Blåskjell er utbredt i hele nordlige Atlanterhavet og langs hele norskekysten. I likhet med stillehavsøsters, lever blåskjell hovedsakelig i tidevannssonen, men finnes også på dypere vann ned til ca. 10-15 meters dyp. Blåskjell finnes på fjell, steingrunn og grunne områder med substrat for yngelpåslag, som grus og skjellbunn med tomme skall. Blåskjell er føde for en rekke arter, både fisk, ærfugl, tjeld og krabber.
Gjennom de siste 2-3 tiår har blåskjell vært i nedgang i den nordlige Atlanterhavet på grunn av den samlede belastning fra overfiske og klimaendringer som fører til økt temperatur og nedbør (Baden et al., 2021). Gjennom de siste 15 årene har Havforskningsinstituttet fått meldinger fra publikum at blåskjell også har forsvunnet fra norskekysten. Med bakgrunn i den bekymringen, startet Havforskningsinstituttet et prosjekt i 2021 for å kartlegge blåskjellbestandene over tid (Strohmeier et al., 2022). Kartleggingen ble gjennomført for fire regioner (Øst, Sør, Vest og Nord) i 2021 og 2022, og resultatene viser at blåskjell forekommer i alle regioner fra innerst i fjord til eksponert kyst. Data om forekomst av blåskjell i region Sør ble samlet fra Risør til Homborøya, og inkluderte flere stasjoner i Raet nasjonalpark. Av alle regioner som ble undersøkt, hadde region Sør størst andel av kystlinje med få eller ingen blåskjell (Strohmeier et al., 2022).
Østers og blåskjell er mer enn bare en delikatesse på middagsbordet; de spiller også en viktig rolle som økosystemingeniører som skaper habitat der de vokser. Østers og blåskjell kan danne store banker som blir til viktige oppvekst- og leveområder for andre arter. Døde skjell og hulrommene i en østersbanke blir til nye hjem for mark, krepsdyr og mange arter av småfisk. I tillegg filtrerer de store mengder av vann som forbedrer vannkvaliteten og reduserer eutrofiering.
3.6 - Fisk og skalldyr med utvalgte nøkkelarter
Når man skal si noe om fiskebestanders utvikling er det viktig med lengre tidsserier som kan vurdere trendene i utviklingen, da det kan være svingninger fra år til år. Det er to ulike datasett man ofte benytter i slike vurderinger. «Fiskeriavhengige» data hentes inn fra fiskeriene. Her kan man skaffe store mengder data og mye av dette kan strekke seg langt tilbake i tid. Dette kan for eksempel være fangster i kommersielle fiskerier. Utfordringen med fiskeriavhengige data er at de ikke er standardiserte og datainnsamlingen blir påvirket av fiskerienes dynamikk og endring over tid (teknologisk utvikling, reguleringer, marked osv.). «Fiskeriuavhengige» data er ofte forskningens egen datainnsamling. Dette er en mer standardisert datainnsamling der samme prosedyrer gjentas med samme utstyr og det er mindre usikkerhet knyttet til endring i datainnsamling over tid. Derfor har ofte fiskeriuavhengige data færre mulige feilkilder og gir ofte et mer nøyaktig bilde av utviklingen.
3.6.1 - Torskefisk
Standardiserte strandnotundersøkelser har blitt gjennomført i og rundt Raet nasjonalpark i mange år og representerer en fiskeriuavhengig tidsserie. Strandnotundersøkelsene har vært tilnærmet uforandret siden 1919 og foregår i perioden fra midten av september til midten av oktober. Strandnoten trekkes på rundt 130 stasjoner mellom svenskegrensen og Søgne. All fangst, som fisk og andre marine arter blir identifisert og lengdemålet. Det er en rekke faste strandnotstasjoner inne i eller i nær tilknytning til Raet nasjonalpark. Figur 12, 13 og 14 viser at historisk sett har det vært høyere tetthet av både ung og voksen torskefisk (torsk, lyr og hvitting) i dette området sammenlignet med snittet for Skagerrakkysten. Men nedgangen har vært betydelig og ligger nå på 10% av langtidsgjennomsnittet for både ung og voksen torskefisk.
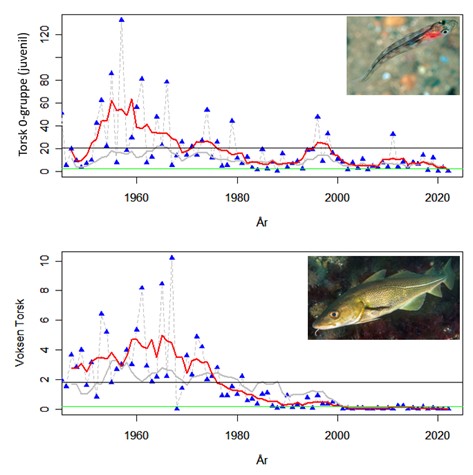
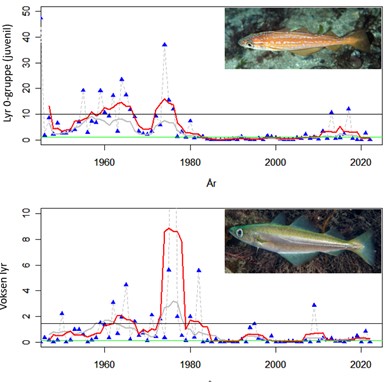
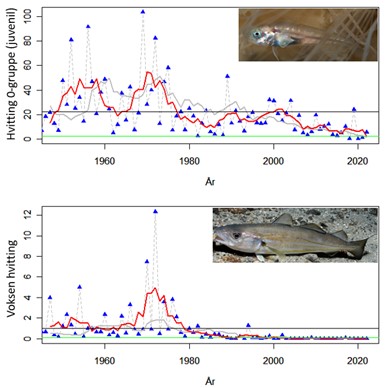
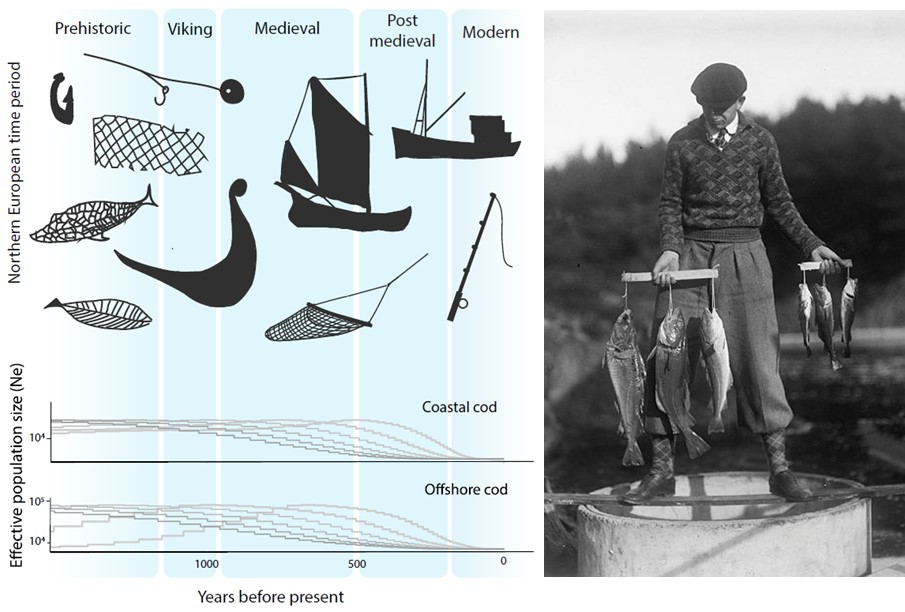
Standardiserte tidsserier som strekker seg 60-70 år tilbake er sjeldne i marin sammenheng og er svært verdifulle for å få innsikt i hvordan naturen endrer seg. Men også for 100 år siden var kystnaturen allerede betydelig påvirket av menneskelig aktivitet. Fiskerier har blant annet pågått i Skagerrak i århundrer med stadig økende intensitet og fangstkapasitet. Nye genetiske metoder har gitt ny innsikt i endringer i fiskebestander gjennom flere århundrer. En studie som analyserte torskens genetiske variasjon viser utviklingen torsken har vært gjennom i Skagerrak (Sodeland et al., 2022). En art i rask vekst kan akkumulere sjeldne genetiske varianter. Derimot, hvis en art er under press vil det bli underskudd av disse genetiske variantene. Genene til torsk i Nordsjøen og Skagerrak har et betydelig underskudd av disse sjeldne genvariantene. Dette forteller at torskebestanden i dette området har vært under press lenge. Den negative trenden startet mest sannsynlig allerede i vikingtiden, men har eskalert over tid (Figur 15). Dette viser at størrelsen på torskebestanden for 60-70 år siden, som man vil se på som stor i dag, sannsynligvis allerede da var kraftig redusert. Studien viser at torskebestanden sank betydelig før andre menneskelige påvirkningsfaktorer som økte næringssalter, utbygging i strandsonen og økning i drivhusgassutslipp var relevante. Det ser dermed ut til at fiske har vært en stor påvirkningsfaktor på torskebestanden langs Skagerakkysten helt siden middelalderen.
Også fiskeriavhengige data, som offisielle fangster i kommersielle fiskerier, forteller den samme historien om torskefisk. Fiskerienes landinger kan være påvirket av mange faktorer som fisketrykk/-innsats, reguleringer (for eksempel kvoter) og endring i bestanden. Store teknologiske fremskritt tidlig på 1900-tallet bidro blant annet til utviklingen av motorisering av fiskeflåten og utvikling av trålredskaper (Tveit, 2023) . Dette økte effektiviteten og fangstkapasiteten i fiskeflåten. Landingene av torskefisk langs Aust-Agderkysten steg betydelig fra 1920 og frem til etterkrigsårene. Deretter var det en kraftig nedgang på 1950- og 1960-tallet. Dagens fiskerifangster av torskefisk er i dag lav sammenlignet med 1930-tallet (Figur 19).
Hva påvirker torsken i dag?
Torskebestanden er i dag på et historisk lavt nivå og er fortsatt utsatt for sterke påvirkninger, noe som sannsynliggjør videre nedgang hvis ikke riktige tiltak iverksettes. For å identifisere riktige tiltak, er det viktig å vite hva som er de største påvirkningsfaktorene torsken utsettes for i dag. Man snakker ofte om samlede påvirkninger. Skagerrak er i det sørlige utbredelsesområdet for torsk. Økte temperaturer i Skagerrak som følge av klimaendringer kan redusere overlevelsen til torskebestanden. Blant annet kan overlevelse av ungfisk (0-gruppe) bli redusert fordi mattilgangen blir redusert som følge av endrede miljøbetingelser (Barceló et al., 2016). Det er derfor forventet at økte temperaturer som følge av menneskeskapte klimagassutslipp vil gjøre torskefiskene mindre robuste i Skagerrak. Det er lite som tyder på at denne endringen vil kunne hindres, da man globalt ikke ligger an til å nå klimamålene (IPCC, 2023) . Hvis det er et ønske om å restaurere og ivareta torskefiskbestandene langs Sørlandskysten er det derfor behov for å styrke bestandenes motstandsevne for å takle fremtidige klimaendringer. Dette innebærer å redusere presset fra andre påvirkningsfaktorer.
En torsk som overlever første år (0-gruppe) kan dø av flere årsaker, slik som sykdommer, sult, predasjon eller fiske. I perioden 2005 til 2013 ble det merket over 9000 torsk mellom Risør og Lillesand, inkludert Raet nasjonalpark (Kleiven et al., 2016). Hvert merke har en unik kode som gjør at den kan spores ved eventuell gjenfangst. Torsken ble i hovedsak fisket med ruser og representerer derfor den delen av torskebestanden som lever i mer beskyttede lokaliteter mellom holmer, skjær og i fjorder. Lengden på den merkede torsken var fra 16 til 93 centimeter, med et gjennomsnitt på 40 cm. Dette har gitt muligheten til å studere grundig hvilken skjebne torskeindividene møter.
Årlig dør rundt 76 % av små torsk (mindre enn 40 cm) og 68 % av stor torsk (Fernández-Chacón et al., 2016; Kleiven et al., 2016). Dette betyr at rundt 3 av 10 torsk overlevde fra ett år til det andre. Når sannsynligheten er så stor for en torsk til å dø i løpet av ett år, er det liten sjans for å kunne få eldre og store torsk i økosystemet. Det er verdt å se nærmere hva som er hovedårsaken til at torsken dør. Rundt 56 % av torsken dør fra fiske og 44 % dør av naturlige årsaker. Ser man på torsk over minstemål, ser fisket ut til å ha en enda større påvirkning, der Fernández-Chacón et al. (2016) fant at 65% av torsken dør av fiske, og da bare 35 % dør av andre årsaker. I noen år var nær 100% av dødeligheten til torsk over minstemål forårsaket av fiske. Av den torsken som ble fisket og rapportert, stod fritidsfiske med stang og snøre for 61 %, yrkesfisket for 27 % og faste redskaper i fritidsfisket for 12 % (Kleiven et al., 2016, Figur 16) .
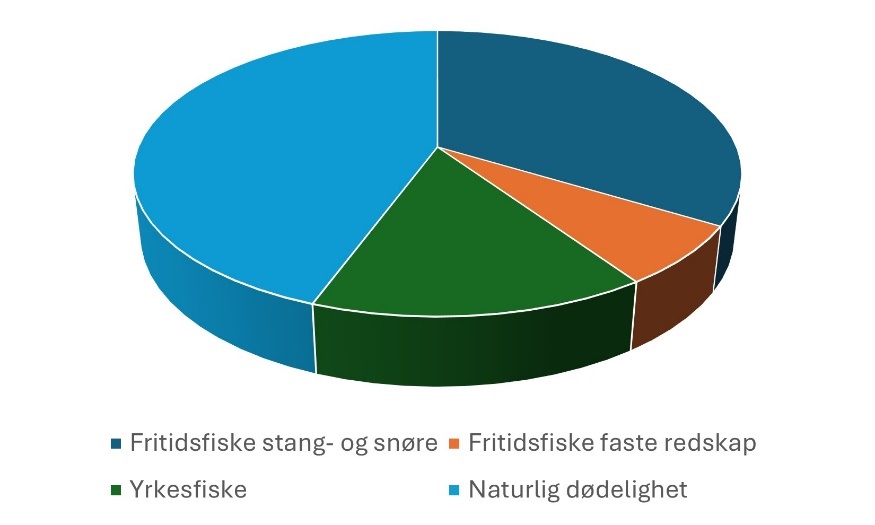
Disse resultatene indikerer at en gjenoppbygget bestand med redusert fisketrykk bestående av flere store, eldre torsk ville oppleve lavere naturlig dødelighet enn hva som er tilfelle i dag. Naturlig dødelighet innebefatter dødsårsaker som ikke kan relateres direkte til fiske/ fangst. Dette kan dermed innebære sykdom, predasjon (for eksempel fra større fisk, sjøpattedyr og sjøfugl), forurensing og sult. Men også sekundære effekter av fiske, slik som spøkelsesfiske, vil ligge under dette i slike beregninger. Mange er opptatt av påvirkninger fra sel og skarv på torskebestanden. Det er verdt å merke at dette ligger under naturlig dødelighet og dermed ser ut til å være betydelig lavere enn det som blir fisket opp årlig. Dette viser også diettstudier på sel, der Sørlie et al. (2020) samlet inn avføringsprøver fra typiske selskjær i Telemark og Agder, blant annet Askerøya i Tvedestrand og Ryvingen i Grimstad. I avføringsprøvene finner man øresteinene til fisken og man kan da både bestemme art og alder (Figur 17). Hos steinkobbe, som er den vanligste selarten i Raet, består dietten av et bredt utvalg fisk. Torsk utgjorde kun 0,7 % av dietten og 2,3 % i biomasse (vekt). Totalt for området Telemark til Lillesand ble det beregnet at steinkobbe spiste 315 tonn fisk, av dette utgjorde flyndrer 121 tonn, hyse/lyr/sei 61 tonn, sild 35 tonn og torsk 7 tonn. Dette utgjør da rundt 5 % av årlige torskelandinger i det kommersielle fiskeriet i samme område.
3.6.2 - Skalldyr
Hummer (Homarus gammarus)
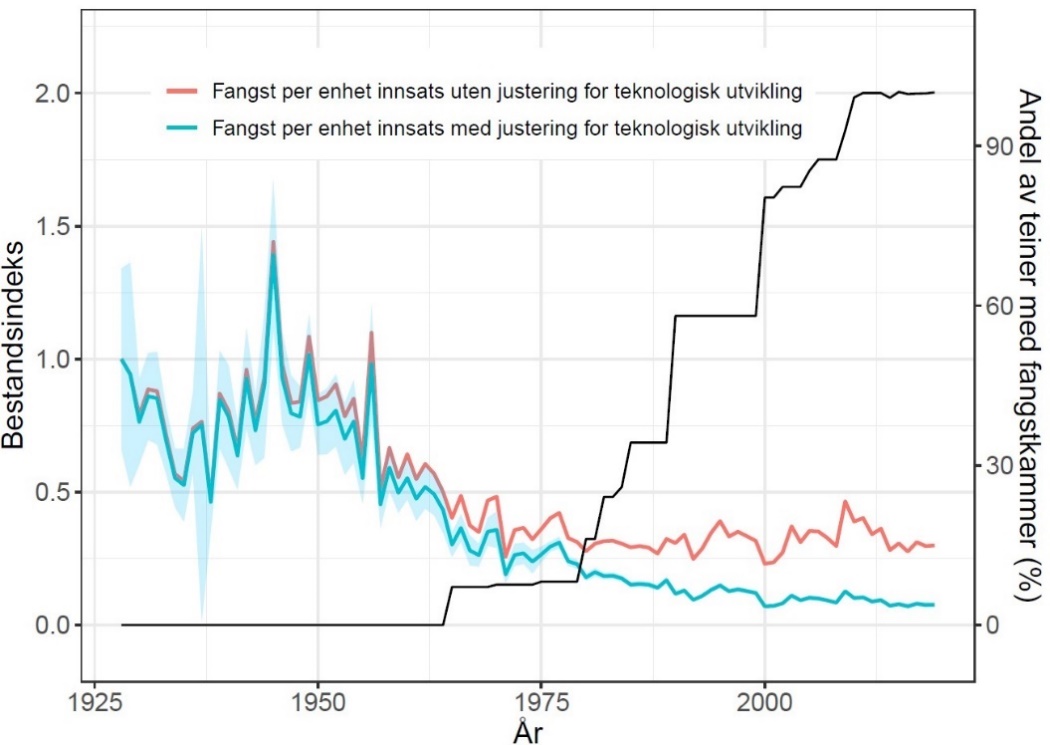
Hummer kom inn på rødlisten i 2021 som «sårbar» (Tandberg et al., 2021). Bakgrunnen er en betydelig nedgang i bestanden de siste 60 årene, der også en del av bestandsnedgangen har blitt kamuflert av teknologisk utvikling der blant annet teinene har blitt mer effektive (Kleiven et al., 2022). Den mest betydelige nedgangen var på 1950- og 60-tallet. Nye tiltak etter 2008 ser ut til å ha stabilisert bestanden på et lavt nivå (Figur 18). Forsøk med fredningsområder har vist en betydelig økning i bestand ved fravær av fiske, noe som er en klar indikator på at fiske er en drivende årsak til bestandsnedgangen (Moland et al., 2013a; Kleiven et al., 2019b; Knutsen et al., 2022). Bevaringseffekten på hummer i fredningsområder har nå blitt en del av hummerforvaltningen og det er nå over 60 hummerfredningsområder i Norge, deriblant to i Raet nasjonalpark. I Skagerrak utgjør fritidsfisket i overkant av 80 % av totale landinger på hummer (Kleiven et al., 2019a).
I 2017 ble det innført en obligatorisk påmeldingsordning for alle som skal delta i hummerfisket. Dette la grunnlag for å beregne deltakelse og fangster (Kleiven et al., 2019a). I 2020 ble det gjennomført en egen utvalgsundersøkelse for alle fritidsfiskere som var påmeldt i nasjonalparkkommunene og kommunene innenfor (Froland og Vegårshei). Undersøkelsen fanger derfor ikke opp de som bor i andre kommuner og som fisker i og rundt Raet nasjonalpark. I så måte kan det forventes at tallene er et underestimat. I 2020 var det 2409 påmeldte fritidsfiskere. Like etter at hummerfisket var over, ble det sendt ut et nettbasert spørreskjema til 193 tilfeldig utvalgte fiskere. Det ble mottatt svar fra 154 personer. Av de påmeldte var det 86 % som hadde deltatt i hummerfisket. Snittet for alle påmeldte var 10,4 (SE 1,2) landet hummer. Snittet for alle som både var påmeldt og som deltok i fisket var 12,2 (SE 1,3) hummer per fisker. Totalt estimat på landet hummer blant fritidsfiskere i nasjonalparkkommunene for 2020 var 25 057 (95 % CI: 19 604 – 30 510) hummer. Samme år ble det offisielt omsatt 2936 hummer fra yrkesfiskere i nasjonalparkkommunene (Loga, 2022) . Dette innebefatter ikke nødvendigvis all hummer landet av yrkesfiskere, da Kleiven et al. (2012) estimerte at kun en av fire hummer landet av merkeregistrerte fartøy ble offisielt landet på Sørlandet. Urapporterte landinger fra merkeregistrerte fartøy er ukjent i Raet nasjonalpark for 2020 og er derfor ikke tatt med i estimatet. Basert på utvalgsundersøkelser blant påmeldte fritidsfiskere og offisielle landinger fra yrkesfiskere estimeres det at det ble landet rundt 29 000 hummer i nasjonalparkkommunene i 2020.
Sjøkreps (Nephrops norvegicus)
Det er flere gode områder for sjøkreps i Raet nasjonalpark. Sjøkreps lever på 20-800 meters dyp, på bløtbunn av sandblandet mudder eller leire hvor de graver hulene sine 20-30 cm ned i sedimentet. Voksne sjøkreps er stedbundne. De er «altetende» og spiser gjerne krepsdyr, bløtdyr, børstemark og åtsler (https://www.hi.no/hi/temasider/arter/sjokreps). Sjøkreps har over lang tid blitt fanget som bifangst i reketrål. Fisket etter sjøkreps med teiner har økt de siste årene, både blant fritids- og yrkesfiskere (Zimmermann et al., 2022). Sammenlignet med hummerbestanden er det lite data på bestandsutviklingen av kystnær sjøkreps. I Raet nasjonalpark er det forventet at fritidsfisket dominerer teinefisket etter sjøkreps, men dette er ikke kartlagt.
Taskekrabbe (Cancer pagurus)
Taskekrabben foretrekker hardbunn, men kan vandre ut på bunn med skjellsand og leire. De trives best på områder grunnere enn 50 meter og har overlappende leveområder med hummer. Det er populært å fiske krabbe i og rundt Raet nasjonalpark, men det er begrenset med data på hvor mange som fisker og hvor mye som blir fisket. Loga (2022) beregnet at det i perioden 2019 til 2021 ble fisket årlig 5 tonn krabber (rundt 10 000 krabber) av yrkesfiskere i nasjonalparkkommunene. I Raet nasjonalpark ble det beregnet at det ble fisket i snitt 3200 krabber i samme periode. Dette utgjør mest sannsynlig en liten andel av krabbefisket, da det er grunn til å forvente at fritidsfisket dominerer fangstene. Krabbefisket er populært i sommermånedene og tas også som bifangst under hummerfisket på høsten. Det er observert at krabbefangstene går ned i hummerfredningsområder, noe som indikerer en interaksjon mellom krabbe og hummer ( Glemarec, 2016) .
Dypvannsreke (Pandalus borealis)
Dypvannreken er en av mange rekearter i Raet nasjonalpark, men det er nok denne de fleste kjenner til og som man typisk finner i fiskedisken. Dypvannreken trives best på dypt vann og lever hovedsakelig på leire- eller mudderholdig bunn. Om natten foretar den vertikalvandring opp i vannsøylen på næringssøk og beiter på dyreplankton. Reke er en nøkkelart i økosystemet og er et viktig ledd i næringskjeden (Tengvall et al., 2024). Reken er mat for blant annet en rekke fiskearter. Trålfisket etter reker startet i Skagerrak allerede på begynnelsen av 1900-tallet, men effektiviteten til fiskebåtene har naturlig nok endret seg (Tveit, 2023) . Nye studier viser at gytebestanden i Skagerrak og Norskerenna kun er en åttedel av det den var på begynnelsen av 1900-tallet og at det har foregått en serie-utryddelse av reker i Nordsjøen (Melaa et al., 2022; Cardinale et al., 2023).
3.7 - Sjøpattedyr
Sjøpattedyr er en del av Raet Nasjonalparks naturverdier. Kystselen steinkobbe (Phoca vitulina) er det mest synlige sjøpattedyret i nasjonalparken. Arten ble nesten utryddet fra Skagerrak på 1900-tallet, grunnet jakt og utbrudd av virusepidemier, den siste i 2002 (Olsen et al., 2018). I de siste 20 år har området blitt rekolonisert, og en koloni på ca. 30-40 individer kan ofte observeres på innsiden av Askerøy, rett ved nasjonalparken (Nilssen et al., 2023; van Meurs et al., 2024). Satellittmerking viser at steinkobber merket i Raet og norsk Skagerrak generelt, vandrer mellom fylker og nasjonalparker, og også sørover til Sverige og Danmark. De kan dykke til bunnen av Norskerenna, men oppholder seg mest ved kysten. Steinkobbene er avhengig av å oppholde seg på land for å hvile, varme seg, kaste unge, die og bytte pels. Tilgang til uberørte liggeområder er spesielt viktig i kasteperioden i juni. Antall sel på land ved Askerøy er likevel lavest i denne perioden. Noen steinkobber ser ut til å flytte til yttersiden av Askerøy i denne perioden, muligens pga. økt båttrafikk ved Lyngør. Havert, den andre kystselen som forekommer i Norge, er sett sporadisk i Raet Nasjonalpark og har ingen kasteplasser i området.

Når det gjelder hval, er nise (Phocoena phocoena) den minste og mer tallrike arten i Norge. Nise forekommer i Raet året rundt, ifølge nylig forskning (Mokoroa-Alberdi, 2024). Internasjonale undersøkelser viser at Skagerrak er en av områdene i Europa med høyest tetthet av nise, med en estimert bestand til ca. 75000 individer (Hammond et al., 2021). Andre hvalarter som har blitt registrert i Raet inkluderer kvitskjeving ( L agenorhynchus acutus), spekkhoggere (Orcinus orca), vågehval (Balaenoptera acutorostrata ) og nebbhval (Hyperoodon ampullatus ) .
Både steinkobber og niser er opportunister som beiter på en lang rekke fiskearter, uten å fokusere spesielt på torsk (Aarefjord et al., 1995; Sørlie et al., 2020). Begge står på et høyt trofisk nivå og er derfor eksponert for miljøgifter som akkumuleres i næringskjeden. Bifangst i fiskeri er en av hovedtruslene for niser og steinkobber i deres utbredelsesområder. Den årlige bifangsten i norske kystgarnfiskerier er nesten 3000 niser (Moan et al., 2020) og rundt 555 steinkobber (Elnes et al., 2023).
Niser og andre hval benytter lyd for å oppdage mat, orientere seg og kommunisere. Undervannsstøy kan forstyrre sentrale livsfunksjoner til sjøpattedyr (f.eks. beiting, parring, die, hvile, migrering) ved å svekke hørselsfølsomheten, maskere akustiske signaler, fremkalle atferdsreaksjoner eller forårsake fysiologisk stress (Erbe et al., 2018). Seismikkundersøkelser og militære sonarer kan ha spesielt akutte konsekvenser for hval, inkludert dødelighet i visse tilfeller (Fernandez et al., 2005).
3.8 - Sjøfugl
Sjøfugl er en viktig del av det marine økosystemet i Raet nasjonalpark og fungerer som gode indikatorer på økologisk tilstand i kyst- og havområder (Piatt et al., 2007, Rajpar et al., 2018). I Raet nasjonalpark hekker det til sammen 18 sjøfugl-arter: ærfugl (Somateria mollissima), svartbak (Larus marinus ), gråmåke (Larus argentatus ), fiskemåke (Larus canus), sildemåke (Larus fuscus ), mellomskarv (Phalacrocorax carbo sinensis), tjeld (Haematopus ostralegus), makrellterne ( Sterna hirundo ), hettemåke (Chroicocephalus ridibundu ), siland (Mergus serrator ), gravand ( Tadorna tadorna ), teist (Cepphus grylle), hvitkinngås (Branta leucopsis), knoppsvane (Cygnus olor), sandlo (Charadrius hiaticula) og rødstilk (Tringa totanus). I tillegg er havhest (Fulmarus glacialis) i ferd med å etablere seg som hekkende art i området (Kjøstvedt & Fjærbu, 2014). Betegnelsen sjøfugl omfatter fugler som er avhengig av det marine miljøet for å finne næring. Noen av artene som hekker i Raet nasjonalpark, som for eksempel knoppsvane og grågås, kan også ha innslag av terrestrisk eller ferskvannsdiett, men regnes som sjøfugl i denne sammenhengen fordi majoriteten av dietten deres kommer fra det marine miljøet. Det er også observert havsuler (Moranus bassanus ), storjo (Stercoarius skua) og havlire (Puffinus puffinus) på trekk. Flere arter er observert rastende ute på havet om vinteren, som for eksempel havelle (Clangula hyemalis), smålom (Gavia stellata) og horndykker (Podiceps auritus). Sangsvanen (Cygnus cygnus) er også observert i området på vinterstid.
Det er ni sjøfuglreservater (restriksjonsnivåer bestående av flere holmer og skjær) i Raet nasjonalpark. men nesten halvparten av sjøfuglbestanden hekker utenfor disse. Både makrellterne og hettemåke hekker utelukkende utenfor de etablerte sjøfuglreservatene. Sommeren 2024 kartla pilotprosjektet Seabird-MPA, som undersøker potensielle effekter av marine vernetiltak på sjøfuglenes hekkesuksess og kondisjon, rundt 100 svartbakreir og 90 ærfuglreir utenfor sjøfuglreservatene i Tvedestrandsfjorden og i Raet nasjonalpark.
Sjøfugltellinger i Vest-Agder er gjennomført siden 1970-tallet med ulike metoder, av BirdLife Norge, Statens Naturoppsyn og frivillige (Kjøstvedt & Fjørbu, 2014, Homme & Pfaff, 2021). Bestandsutviklingen til sjøfugl som hekker i Raet nasjonalpark følger det samme nedadgående mønsteret som i resten av Norge (med noen få unntak). Ifølge den siste rapporten fra BirdLife Norge (2022), hvor de har gjennomført tellinger hovedsakelig i sjøfuglreservater, er alle måkefugler i nedgang (utenom svartbak) og fiskemåkene har ikke fått fram en eneste unge de siste fem årene (2017-2022). Tjeld har hatt en nedgang på 40 % de siste 30 årene. Ifølge tall fra frivillig ringmerking av unger i Tvedestrandsfjorden og i nasjonalparkområder utenfor Tvedestrand, har det vært en stabil hekkesuksess i bestandene av svartbak, gråmåke og sildemåke siden 2010, med unntak av sommeren 2024 hvor kun ca. 30 % av svartbak- og gråmåkeungene overlevde til de ble flygedyktige (pers. kommunikasjon Carsten Lome, upubliserte data fra Seabird-MPA).
Sjøfugl er en av de mest truede artsgruppene i verden på grunn av menneskelig aktivitet (Dias et al., 2019). I Raet nasjonalpark er hekkende sjøfugl utsatt for mange ulike stressfaktorer: predasjon (mink, kråke), menneskelige forstyrrelser (båttrafikk, støy, ilandstigelse på øyer i hekketiden), klimaendringer (som for eksempel ekstreme temperaturer), fiskeri, miljøgifter og marin forsøpling (Kjøstvedt & Fjærbu et al., 2014). Selv om det ikke er gjennomført spesifikke studier i området er det svært sannsynlig at sjøfugl i Raet nasjonalpark, på lik linje med andre sjøfugl langs norskekysten, også påvirkes av endringer i mattilgang grunnet fiskerier, forurensning, inntog av fremmede arter og utbygging som forsterkes av klimaendringer. Mink er en fremmed art i den norske skjærgården og er vurdert til svært høy risiko på grunn av stort invasjonspotensial og stor økologisk effekt (Eldegard et al., 2023). Statens naturoppsyn har igangsatt uttak av mink for å redusere bestanden. Det er godt dokumentert at båttrafikk kan påvirke sjøfuglers atferd og bevegelser, og føre til at de må bruke mer energi på å finne mat og dette kan påvirke hekkesuksess (Bellefleur et al., 2009; Schwemmer et al., 2011). Andre menneskelige forstyrrelser, som for eksempel friluftsliv og spesielt ilandstigelse under hekketiden, kan føre til økt predasjon og økt sannsynlighet for at foreldre forlater ungene sine (Yorio et al., 2001). Det er også veletablert at hetestress som følge av hetebølger (klimaendringer) kan føre til at sjøfugl-foreldre forlater eggene sine (Olin et al., 2023). Sommeren 2024 ble det gjort flere observasjoner av rugende svartbak med klare tegn til hetestress (upubliserte data fra Seabird-MPA), i tillegg ble det observert plast i flere gulpeboller som tyder på at svartbakforeldre forer ungene sine med plast de finner i nærmiljøet.
4 - Fiskeriene i og rundt Raet nasjonalpark
4.1 - Historiske fiskerilandinger
Utviklingen av fangster i det kommersielle fiskeriet kan påvirkes av ulike elementer som bestandssituasjon, teknologisk utvikling og marked. Går fiskebestandene ned kan man forvente at fangstene også går ned. Men teknologisk utvikling, der fiskeriet blir mer effektivt, kan kamuflere en bestandsnedgang, noe som har blitt vist for hummer der økt teineffektivitet har kamuflert noe av bestandsnedgangen (Kleiven et al., 2022). Markedet kan også påvirke fangstene. Hvis for eksempel etterspørselen og prisene øker for en fiskevare, kan fiskerne legge økt innsats inn for å fiske disse. Et eksempel på dette er steinbit som lenge var sett på som en ufisk, det vil si fisk som ikke ble ansett som matfisk. Økt etterspørsel på 80-tallet førte til en utvikling av nye fiskemetoder og større fiske på steinbiten. Dette førte videre til bestandsnedgang for steinbit som Norderhaug et al., (2021) viste for steinbitbestander i Midt- og Nord-Norge. Samtidig kan reguleringer spille inn på fangstmengden. Reguleringer kan blant annet være kvoter, redskapsreguleringer, sesongreguleringer og minstemål. Lange tidsserier på landingsdata fra kommersielle fiskerier er likevel interessante for å forstå utviklingen i fiskeriene og fiskebestandene. En masteroppgave ved Universitetet i Agder har rekonstruert alle landingsdata i Skagerrak tilbake til 1860 (Tveit, 2023). Ved å filtrere ut data for tidligere Aust-Agder fylke kan man få en oversikt over hvordan fangstene har endret seg over tid i og rundt Raet nasjonalpark.
For torskefisk var det en betydelig økning i fangster fra 1920 og frem til 1950, og det er torsk som dominerte fangstene. På denne tiden var det også en betydelig teknologisk utvikling med tanke på overgang til motorbåter og mer moderne fiskeredskaper. Etter 1950-tallet har fangstene variert. Det siste tiåret har fangstene av torskefisk vært betydelig lavere enn i perioden 1920 til 1950 (Figur 19).
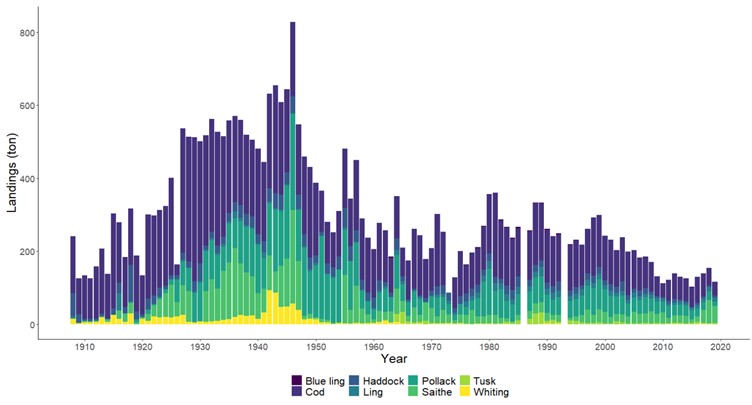
De kommersielle fangstene av hummer i Aust-Agder var på sitt høyeste på 1930-tallet. På 1950- og 1960-tallet ble det en betydelig reduksjon i fangstene. De siste ti-årene har landingene av hummer vært ubetydelige sammenlignet med tidligere år. I begynnelsen av tidsserien ble mest sannsynlig ikke sjøkreps registrert i offisiell landingsstatistikk. Men på 1990-tallet var det en betydelig økning av landinger av sjøkreps og dette har holdt seg relativt stabilt siden 2000. Taskekrabbe har det blitt fisket noe av, men det er først de siste årene det har blitt registrert større kommersielle landinger av dette i Aust-Agder (Figur 20).
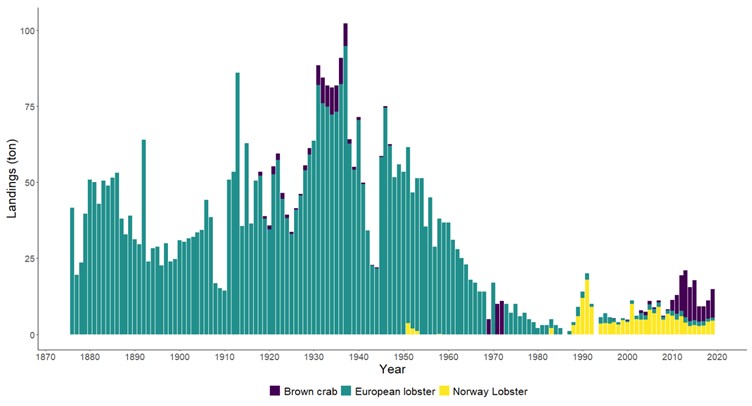
Reker fiskes i hovedsak med trål og landes av kommersielle fiskerier. Et teinefiske er under utvikling, men er foreløpig ubetydelig i fangstmengde sammenlignet med trål (Haugland et al., 2023). Tråling begynte så smått å utvikle seg som fiskemetode på begynnelsen av 1900-tallet. Men det har vært en betydelig utvikling i teknologi i dette fiskeriet, der en moderne reketrål i dag har en vesentlig høyere effektivitet enn i tidligere tider. Rekelandingene har hatt en gradvis økning gjennom tidsserien og fikk en større økning rundt 1980. Fangstene har holdt seg relativt stabile de siste ti årene. Rekefisket er et av de få kvoteregulerte fiskeriene i Raet nasjonalpark. Statistikken på reke viser noen av utfordringene med fiskeriavhengige data. I Figur 21 kan man få inntrykk av at bestanden har økt gjennom tidsserien. Forskere ved Havforskningsinstituttet har vist at gytebestanden av reke i Norge i dag kun er en åttendel av hva den var i 1908 (Melaa et al., 2022). Fangstene man ser i dag kan derfor skyldes at den moderne fiskeflåten er mer effektiv og kan opprettholde store fangster til tross for en lavere rekebestand.
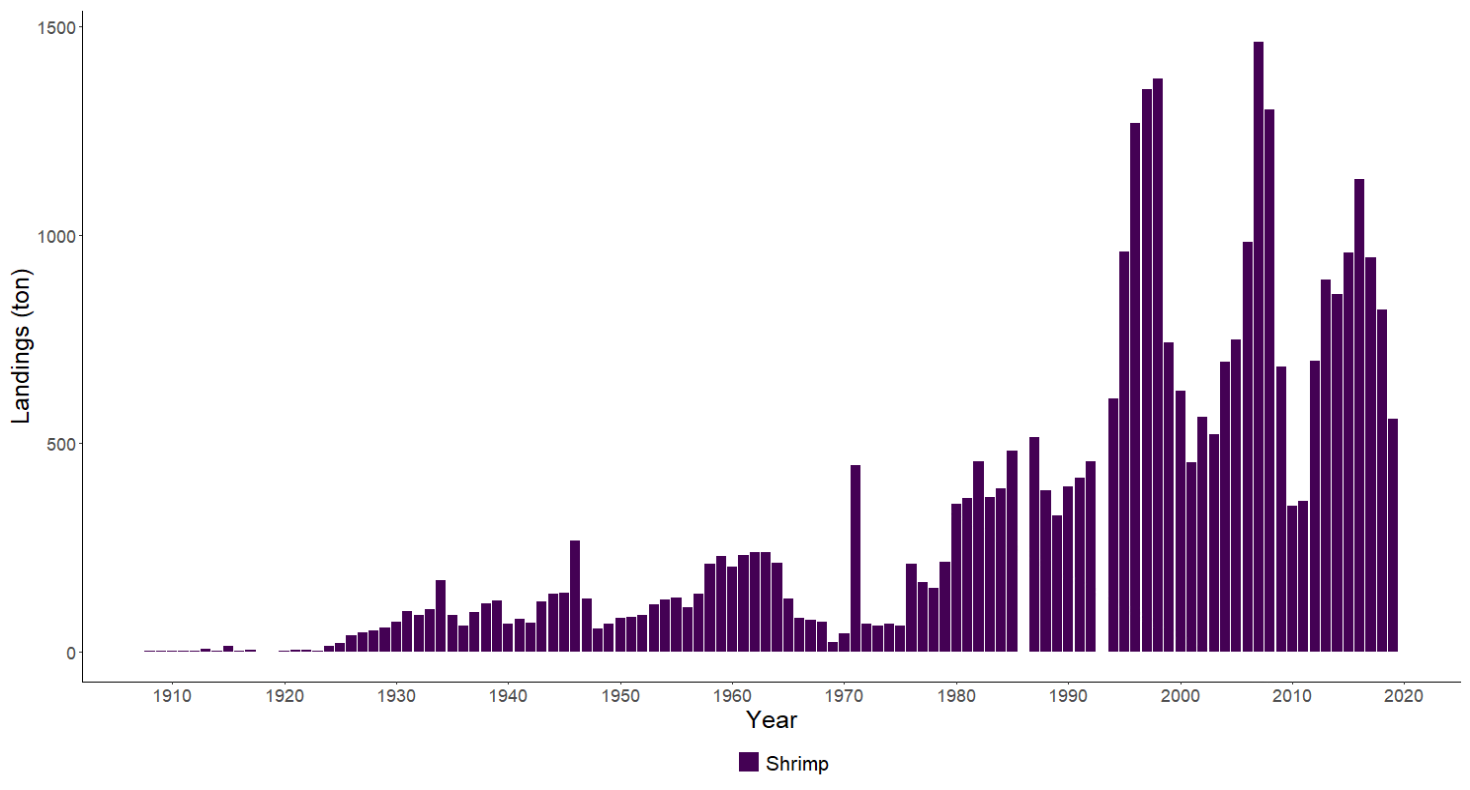
Sild og makrell har vært historisk viktige fangster i Aust-Agder. Ladningene har variert betydelig i perioder (Figur 22). Siden 1990-tallet har det knapt vært registrert landinger av sild, makrell og brisling i Aust-Agder. Det har nok vært fisket en del mer enn dette, men siden statistikken er basert på hvor fisken er landet og ikke fisket kan noe av forklaringen være at det ikke er større mottak for pelagisk stimfisk i Aust-Agder og at fangstene har blitt levert andre steder.
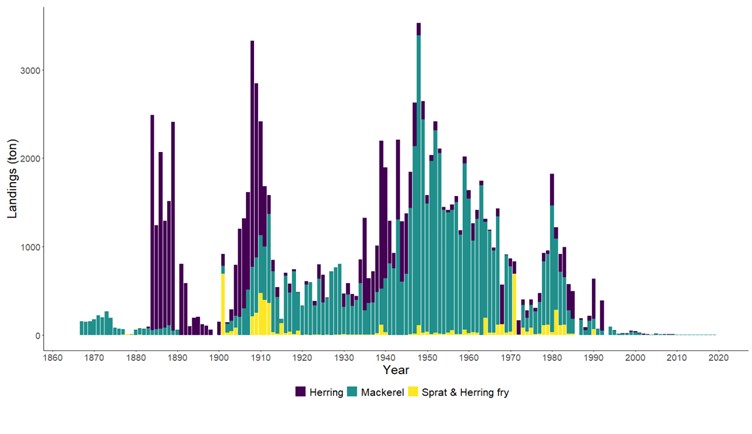
Steinbit har knapt blitt registrert i offisielle landinger i Aust-Agder siden 2000. Det ble registrert noen landinger på 1970- 1980-tallet, men etter det har fangsten vært fraværende. Kveita har det blitt fanget noe av siden starten på tidsserien, med en oppgang i landinger på 1990-tallet. Også mellom 2010-2020 har det blitt landet noe kveite. Fangstene av lysing økte på slutten av 1980-tallet, men er det siste tiåret noe redusert (Figur 23).
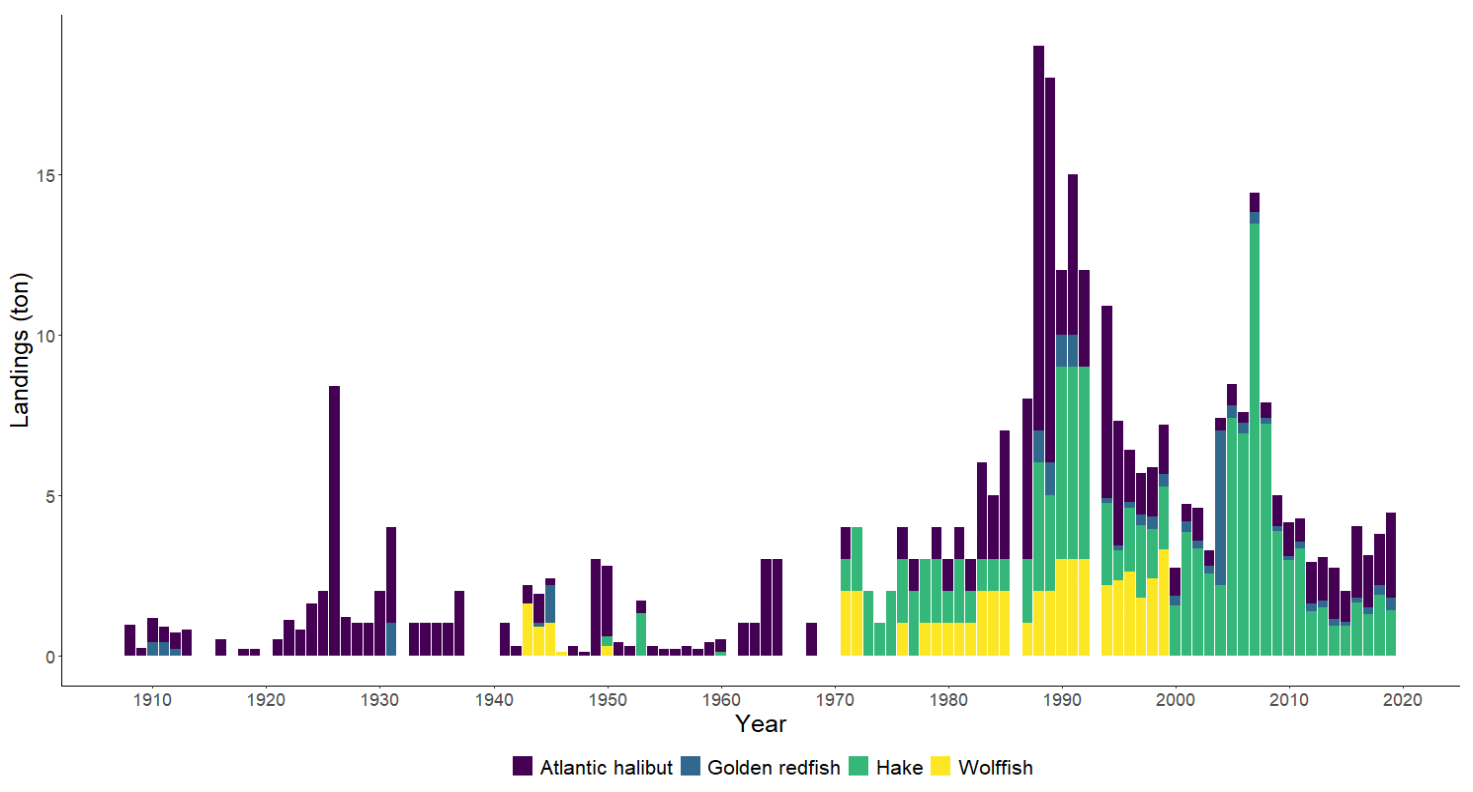
Fangstene av bruskfisk var høyest på 1980-tallet (Figur 24). Dette skyldes en vekst i landinger av pigghå. På 2000-tallet ble det innført fredning av pigghå grunnet betydelig tilbakegang i bestanden. I 2015 var pigghå ført opp på «Rødlista» som sterkt truet, men er i dag listet som «sårbar». Fangstene har derfor vært lave det siste ti-året. I 2023 ble det igjen åpnet for et bifangst-fiske på pigghå. Skater blir i hovedsak fanget som bifangst i reketrål. Offisiell statistikk skiller ikke på ulike arter av skater. Landinger av skater har holdt et relativt jevn nivå gjennom de siste 100 årene. Håbrann er vår største hurtigsvømmende rovhai og kan bli opptil 3 meter lang (150-200 kilo). Det har tidligere blitt drevet et direktefiske på håbrann i Norge, noe som gjenspeiles i landingene fra 1930-1980. De siste ti-årene har det blitt landet få håbrann i Aust-Agder.
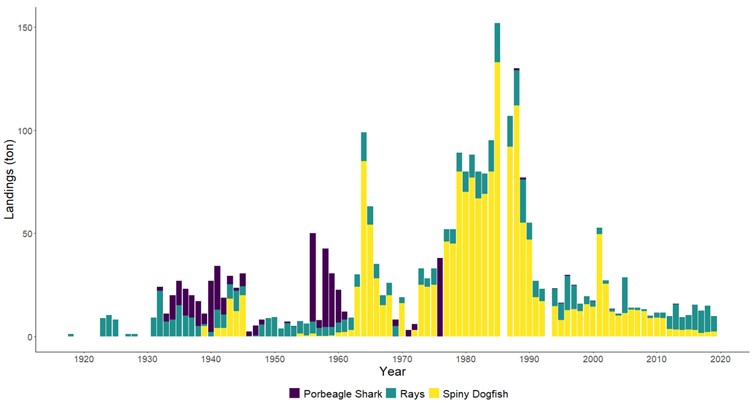
4.2 - Endringer i trofisk nivå i fiskeriene
Globalt er det observert at fiskeriene has fisket seg nedover i næringskjeden (Fishing down marine food-webs (Pauly, 1998)). I dette ligger det at fiskeriene har hatt en overgang fra å fiske på langt-levende arter høyt oppe i næringskjeden (høyt trofisk nivå) til kort-livede fisk og skalldyr lavere nede i næringskjeden. Endringen skyldes at artene høyt opp i næringskjeden har blitt overfisket og fiskeriene begynner å fiske på arter lengre nedover i næringskjeden. For mer informasjon om trofisk nivå, se kapittel 5.
Ved å benytte data fra Tveit (2023) for historiske landinger for hele Agder kan vi evaluere hvordan endringene har vært over tid. I perioden 1940 til 1970, da fiskeriene i Agder var i stor teknologisk utvikling var det større fangster av arter på høyere trofisk nivå, slik som pigghå, torsk, brosme, lyr og sei. I perioden 1990 til 2022 har fangstene av disse artene blitt betydelig redusert, mens fangstene av reke og sild har dominert fangstene. I løpet av denne perioden har biomassen (vekten av totalfangst) gått fra et gjennomsnitt på 10 078 tonn per år (1940-1970) til 3086 tonn per år (1990-2022). Samtidig har gjennomsnittlig trofisk nivå i totalfangsten gått fra 3,6 (1940-1970) til 3,3 (1990-2022, Figur 25). For å illustrere endringen så har sei et trofisk nivå på 3,61 og sild har et trofisk nivå på 3,3. Fiskeriene i Agder fisker i dag på et betydelig lavere trofisk nivå enn tidligere. Dette kan indikere at topp-predatorene har blitt fisket ut og at fiskeriene nå i hovedsak høster på arter lengre ned i næringskjeden (slik som reker).
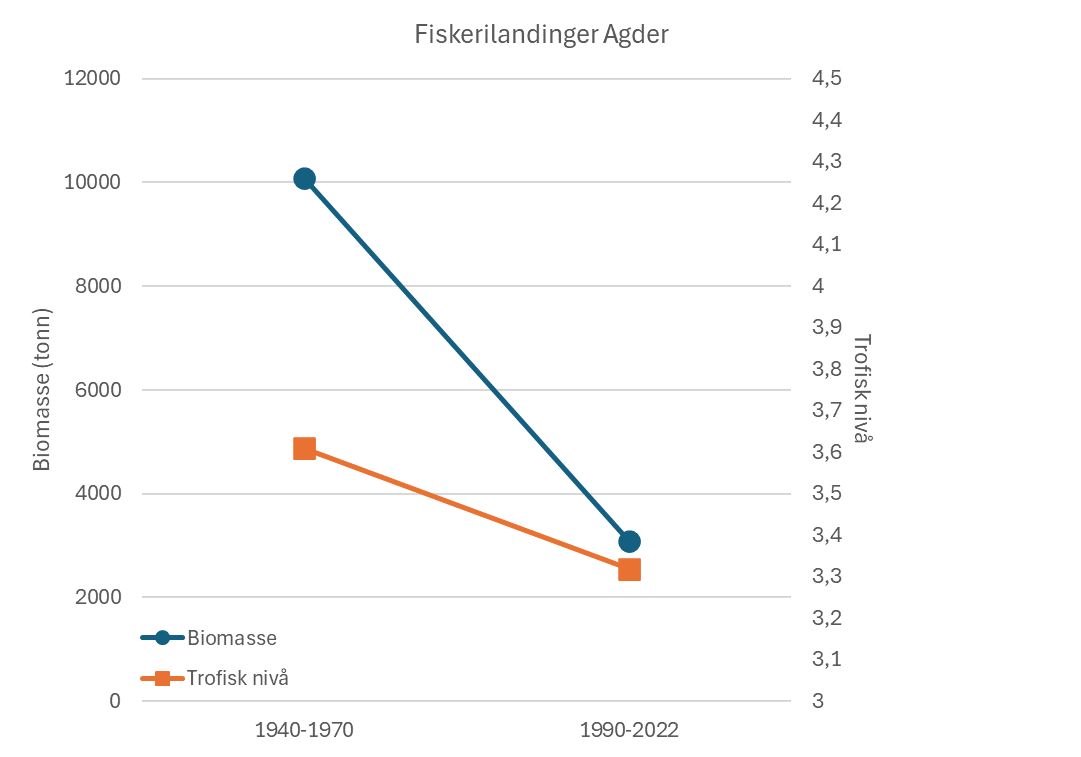
4.3 - Fiskeriene i Raet nasjonalpark
Fiske har lange tradisjoner på Sørlandet og Raet nasjonalpark. Nasjonalparken er populær for fritidsfiskere samtidig som det det foregår et kommersielt fiskeri med en rekke ulike fiskeredskaper.
4.3.1 - Fritidsfiske
Norge har den høyeste andelen fritidsfiskere i Europa (Hyder et al., 2018), samtidig som at reguleringene i fritidsfisket kan anses som liberale (Ferter et al., 2023). I og rundt Raet nasjonalpark har en fritidsfisker lov til å fiske med inntil 210 meter garn, 300 krok på line, 20 teiner eller ruser i tillegg til en maskindrevet jukse og håndsnøre/fiskestang. Det er ingen begrensninger på uttak (kvoter). Men det er minstemål på en rekke arter og noen sesongreguleringer (hummer). Fullstendig oversikt over reguleringer i fritidsfisket kan leses på Fiskeridirektoratets nettsider (https://www.fiskeridir.no/Fritidsfiske). Det er nok ingen land i Europa som har så få begrensninger på fritidsfiske som Norge. Samtidig er reguleringene ganske like langs hele norskekysten og lite tilpasset de store forskjellene i befolkningstetthet/fiskertetthet og ressurssituasjonen. Det blir i hovedsak ikke samlet inn standardiserte data på deltakelse og fangst i fritidsfisket i Norge.
Populære redskaper i fritidsfisket i Raet nasjonalpark er teinefiske etter hummer, krabbe og sjøkreps, og stang- og snørefiske etter en rekke fiskearter som makrell, torsk og lyr. Det foregår også et fiske med garn. Men også redskaper som line, fisketeine, fiskeruse og undervannsjakt er lovlig og foregår i mer ukjent grad. En merke-gjenfangststudie på torsk beregnet at rundt 12 % av torsken ble fisket med faste redskaper (i hovedsak garn) av fritidsfiskere (Kleiven et al., 2016). Fritidsfisket dominerer de kystnære fangstene for blant annet torsk (Kleiven et al., 2016) og hummer (Kleiven et al., 2012) i og rundt Raet nasjonalpark. For andre arter er det begrenset med kunnskap om uttaket i fritidsfisket.
I 2017 ble det innført en obligatorisk påmeldingsordning i hummerfisket. Dette har gitt muligheten til å beregne deltakelse og fangst i dette fiskeriet. Videre er det gjennomført studier på merke-gjenfangst av torsk som gjør det mulig å beregne fritidsfisket på torsk.
Basert på påmeldingssystemet og etterundersøkelse (Kleiven et al., 2019a) blant fritidsfiskere i nasjonalparkkommunene beregnet Loga (2022) at det ble landet rundt 7900 hummer under hummerfisket i 2020 i Raet nasjonalpark. Samtidig ble det beregnet at yrkesfisket landet rundt 700 hummer (basert på offisiell landingsstatistikk). Det er observert en underrapportering av hummer i yrkesfisket (Kleiven et al., 2012) og det er grunn til å forvente at ladningene fra yrkesfisket er høyere også i Raet nasjonalpark.
4.3.2 - Kommersielt fiske
Det er samtidig et kommersielt fiskeri i og rundt Raet nasjonalpark med fiskemottak i Grimstad, Arendal og Risør. Siden alle kommersielle fiskebåter er offentlig registrert og det er påbud om rapportering av landinger så er det mer tilgjengelig kunnskap om dette fiskeriet.
I nasjonalparkkommunene er det totalt registrert 53 fiskefartøyer fordelt på 41 eiere/rederier (2022). Dette fordeler seg på 9 fartøyer i Tvedestrand, 26 i Arendal og 18 i Grimstad. Det er ikke gitt at alle fisker innenfor nasjonalparken og det kan også være fiskefartøyer som er registrert utenfor disse kommunene som fisker i nasjonalparken. Flåten består i hovedsak av mindre fiskebåter, der 34 av fartøyene er under 8 meter og 9 båter er større enn 12 meter (figur 26).
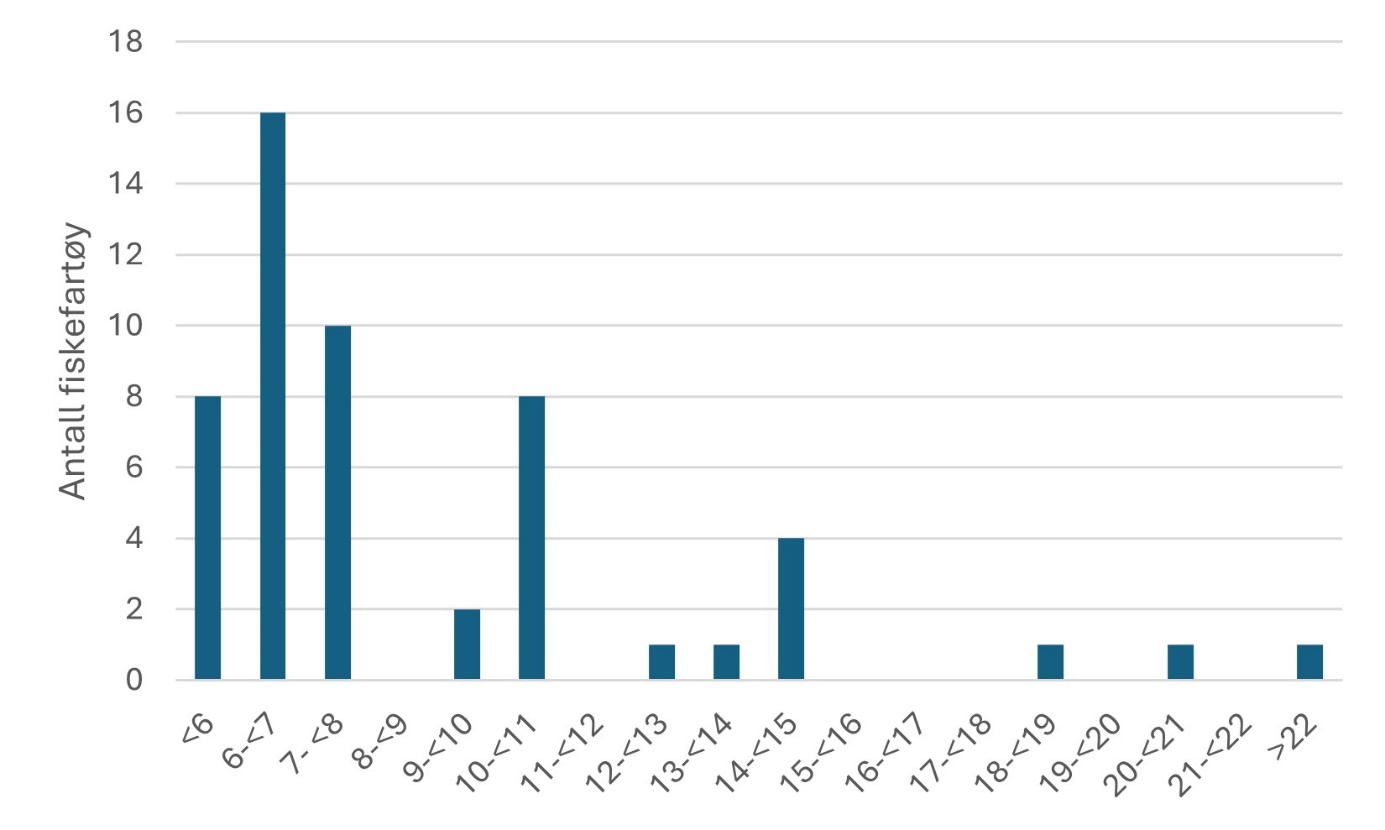
I nasjonalparkkommunene er det 69 manntallsførte fiskere (Tvedestrand: 13, Arendal: 30, Grimstad: 26), hvorav 58 er registrert som «hovedyrkefisker» (Blad B – fiskeri som sin viktigste inntekt). Aldersfordelingen er noe forskjøvet mot eldre fiskere, men det er også 10 fiskere som er yngre enn 40 år (Figur 27). Fiskerne trenger nødvendigvis ikke å operere i Raet nasjonalpark. I dette registeret kan det også være fiskere som arbeider på større fiskebåter andre steder i Norge.
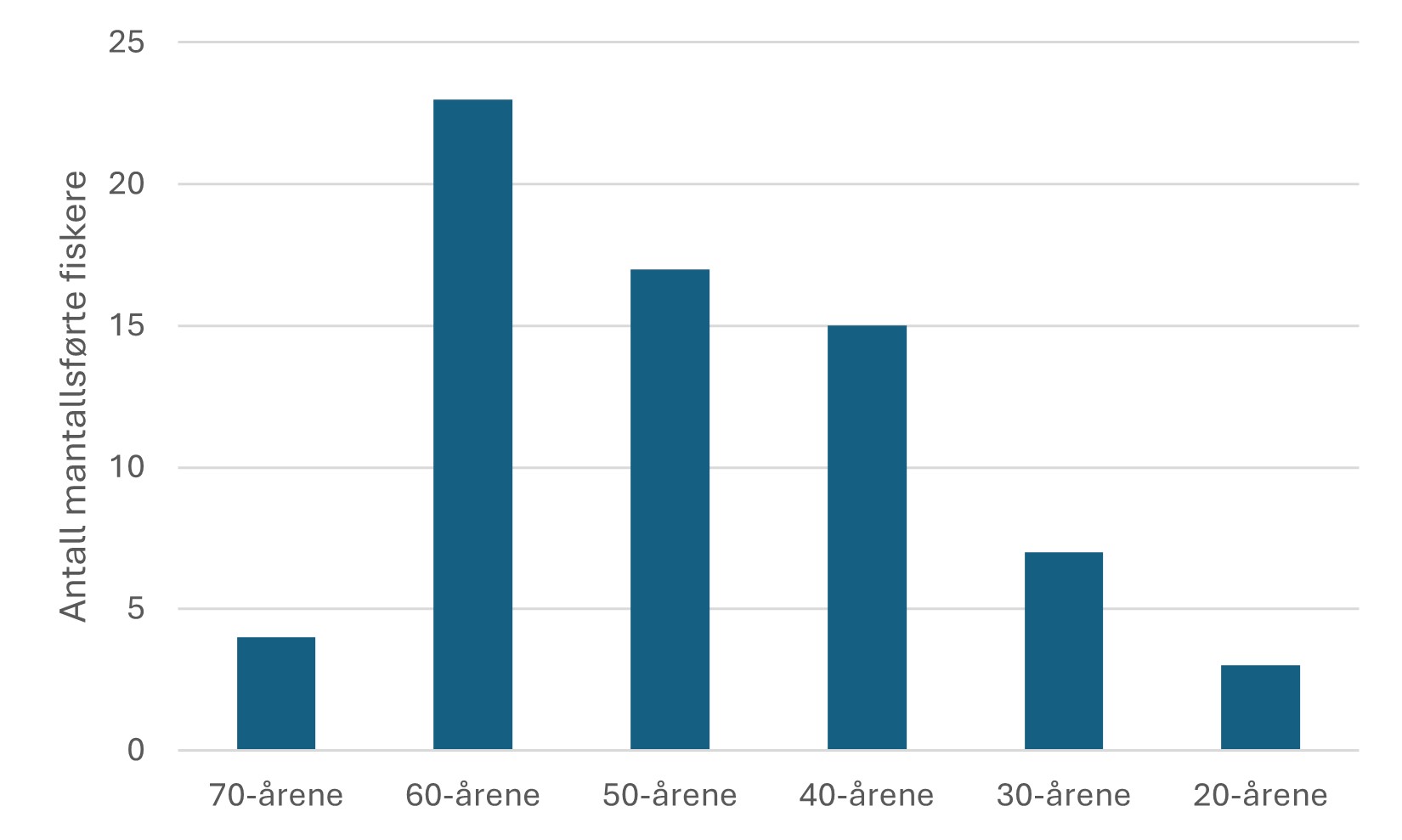
Fiskeaktivitet
Det brukes en rekke ulike kommersielle fiskeredskaper i og rundt Raet nasjonalpark, slik som teiner (hovedsak til fangst av hummer, krabbe og kreps), garn (hovedsak til fangst av fisk) og trål (hovedsak til fangst av reker og sjøkreps). Ulike typer fiskeredskap har ulik påvirkning på bestander og økosystemet. Mens teiner er ansett som relativt skånsomme mot bunnen, har trål større grad av påvirkning på bunnsedimenter og bunnsamfunn (Eigaard et al., 2016) og er den menneskelige aktiviteten i havet som i geografisk utstrekning har størst påvirkning på havbunnen (Løkkeborg et al., 2023). I en rapport om effekter av bunntråling, skriver Løkkeborg et al. (2023) følgende (2.1.2):
Flåten som fisker langs kysten og i Nordsjøen og Skagerrak består av fartøyer fra ca. 10 m til knapt 40 m. De fleste reketrålerne fisker med dobbelttrål, mens en del mindre fartøy fisker med enkelttrål. Ett fartøy har begynt å fiske med kvadruppeltrål (4 tråler samtidig). De minste fartøyene fisker kystnært.
Tråldører varierer i vekt fra 500 til 2000 kg. Senterklump på dobbelttrål veier ca. 70% mer enn vekten av tråldørene. Døravstanden er ca. 50 m for enkelttrål og 180 m for dobbelttrål og sveipene er fra 30 til 50 m.
Løkkeborg et al. (2023) summerer opp kunnskapen om effekter av bunntråling:
Fiske med bunntrål fører til oppvirvling av sedimenter, og tråldører og senterklump (for dobbel- og trippeltrål) lager spor på bunnen som er inntil 30 cm dype, mens det er sveipene som arealmessig gir størst bunnpåvirkning. Graden og varigheten av fysisk påvirkning avhenger av type bunntrål (f.eks. type tråldører og bunngir), fartøyets fart, type sedimenter, strømforhold, bølgeaktivitet og biologisk aktivitet. Effektene er størst på bløt mudderbunn bestående av leire og silt. Remineralisering av organisk karbon (med marint eller terrestrisk opphav) lagret i sedimenter, dvs. omdannelse til uorganisk karbon (f.eks. CO2), kan påvirkes av bunntråling.
Kommersielle fiskebåter har krav om posisjonsrapportering via VMS (Vessel Monitoring System). Dette brukes sammen med elektronisk fangstdagbok. Det samme må utenlandske fartøy som fisker i norske farvann. Frem til juli 2022 var det bare båter over 15 meter som hadde krav om VMS. Fra 1. juli 2023 ble dette gjeldende for alle fartøy på eller over 10 meter. Fra 1. januar 2025 må alle fartøy på eller over 8 meter bruke VMS (Se mer informasjon om VMS hos Fiskeridirektoratet: https://www.fiskeridir.no/Yrkesfiske/Rapportering-paa-havet/Posisjonsrapportering).
Det er noe ulik praksis på når fiskefartøyene slår på sporingen. Derfor kan det komme inn en del støy i data hvis det ikke er kun fiskeoperasjonen som blir sporet. Ved hjelp fra Fiskeridirektoratet har det blitt hentet ut VMS-data i og rundt Raet nasjonalpark for trålingsaktivitet for perioden 2019 til august 2024. For å få mer presis oversikt over hvor det forekommer tråling ble det filtrert slik at kun båthastighet fra 0,8 til 2,5 knop ble hentet ut. Dette ble valgt ut etter dialog med skippere på to trålere som operer i Raet nasjonalpark.
Kartet i Figur 28 viser sporene for trålingsaktivitet for norske og utenlandske fartøy etter filtrering. Det vil sannsynligvis fortsatt forekomme noe støy i kartet der det kan være tilfelle at båten har en fart på mellom 0,8 og 2,5 knop, samtidig som den ikke fisker og at fiskeaktivitet fortsatt rapporteres via VMS. Men presisjonen er forventet å være betydelig høyere enn i ufiltert versjon som kan finnes på Fiskeridirektoratets kartsider (Yggdrasil). I appendix er det også presentert kart for perioden 2022 til august 2024 og 2023 til august 2024. Fiskeintensiteten fra utenlandske trålere varier en del fra år til år. Som vist i Figur 29 kommer det godt frem at disse fartøyene i hovedsak fisker lengre ute, og på dypere vann, enn de norske fartøyene (Figur 30). Dette viser at også de ytre områdene av Raet nasjonalpark er utsatt for trålaktivitet.
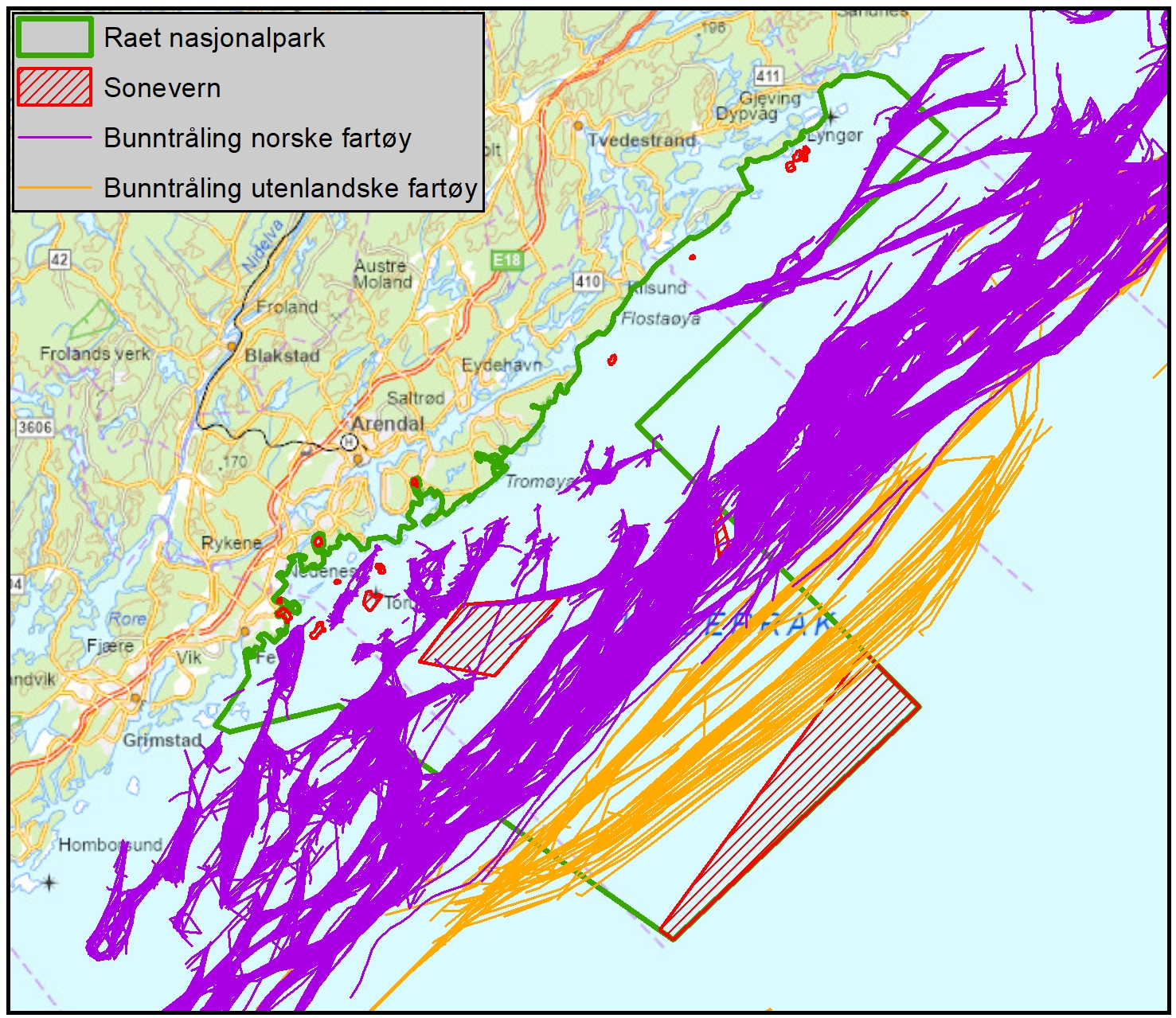
I perioden fra 1. januar 2022 til 31. juli 2024 var det 12 norske trålere (båtenes lengde mellom 12 og 34 meter, snittlengde: 21 meter) som opererte innenfor nasjonalparkens grenser med varierende grad av hyppighet. Fem av båtene stod for 95 % av innsatsen (målt som antall trålspor). I samme periode var det 19 trålere (båtenes lengde mellom 12 og 37 meter, snittlengde: 23 meter) som operererte innenfor nasjonalparkkommunene. Fem av båtene stod for 88 % av innsatsen (målt som antall trålspor). Det er verdt å merke at trålspor kan ha stor variasjon i lengde og trålredskapets størrelse.
Landinger
Det er ikke hentet detaljert statistikk for å beregne hvor mye som landes av fiskeflåten i nasjonalparken. Dette skal være mulig basert på fangstrapportering tilnyttet VMS, men har ikke blitt gjort for denne rapporten. Det ble sortert ut landinger fra fiskebåter som er registrert i nasjonalparkkommunene og som har oppgitt fangsten landet i fangstfelt 09-12, 09-16 og 09-13 innenfor 12 nm (kode 8) og som har levert fangsten i Grimstad, Arendal, Tvedestrand eller Risør. Dette ekskluderer eventuelle fangster fra fartøy registrert utenfor nasjonalparkkommunene. Ikke alt fiske er forventet å være i nasjonalparken. Det var 36 båter som falt innenfor disse kriteriene i 2022.
Reketrål stod for den største fangsten med i overkant av 550 tonn, fulgt av teiner (16 tonn), Garn (9 tonn), ruser (0,9 tonn), snørefiske (0,5 tonn) og krepsetrål (0,1 tonn). Det ble landet minst 32 ulike arter i fiskeflåten i studieområdet i 2022, der reker utgjorde 80 % (466 tonn) av vekten. Resterende landinger er gitt i figur 29. Det var 12 båter som landet reker med trål. Tre reketrålere stod for 73 % av rekefangsten. Seks reketrålere stod for 96 % av landingene (Figur 30).
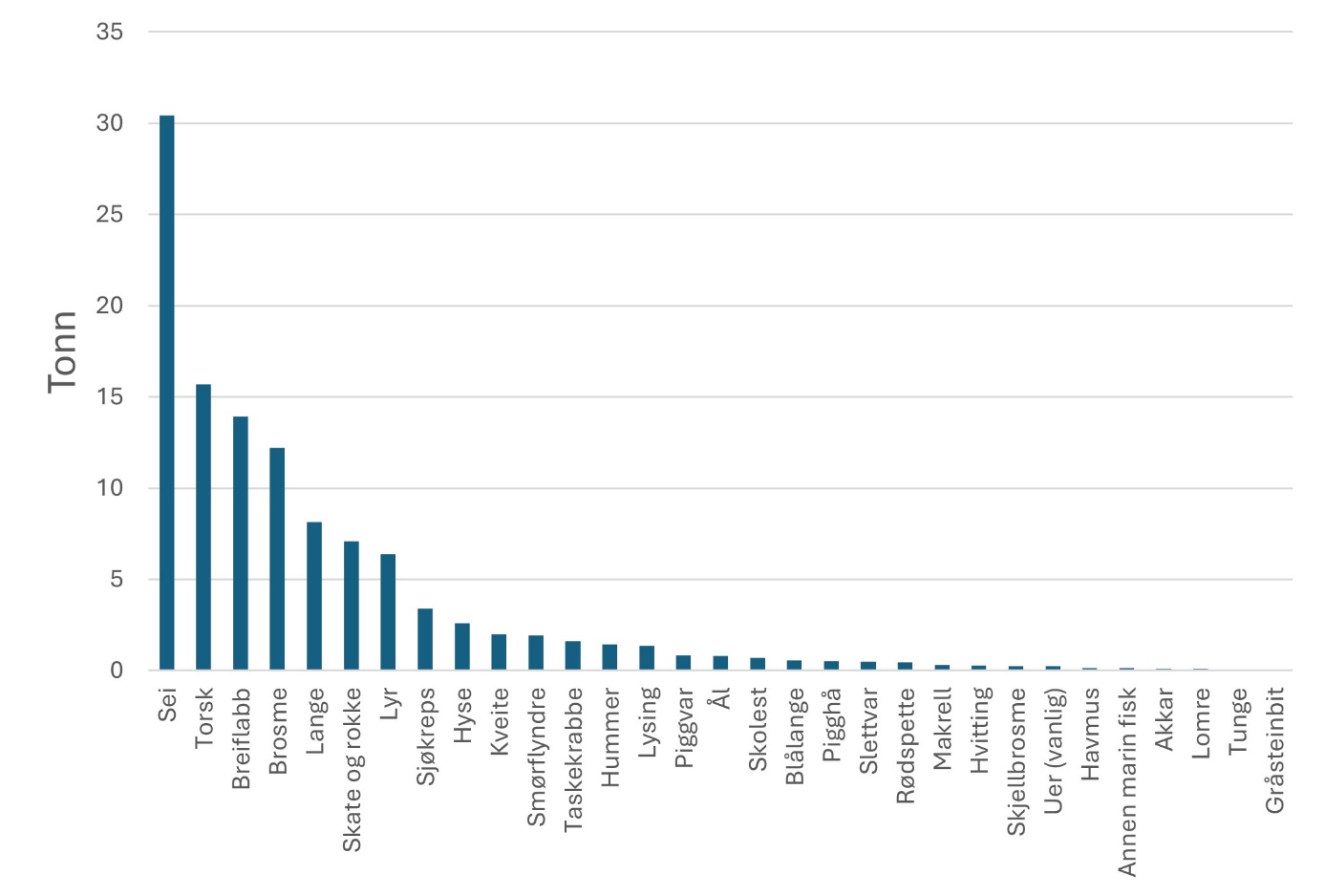
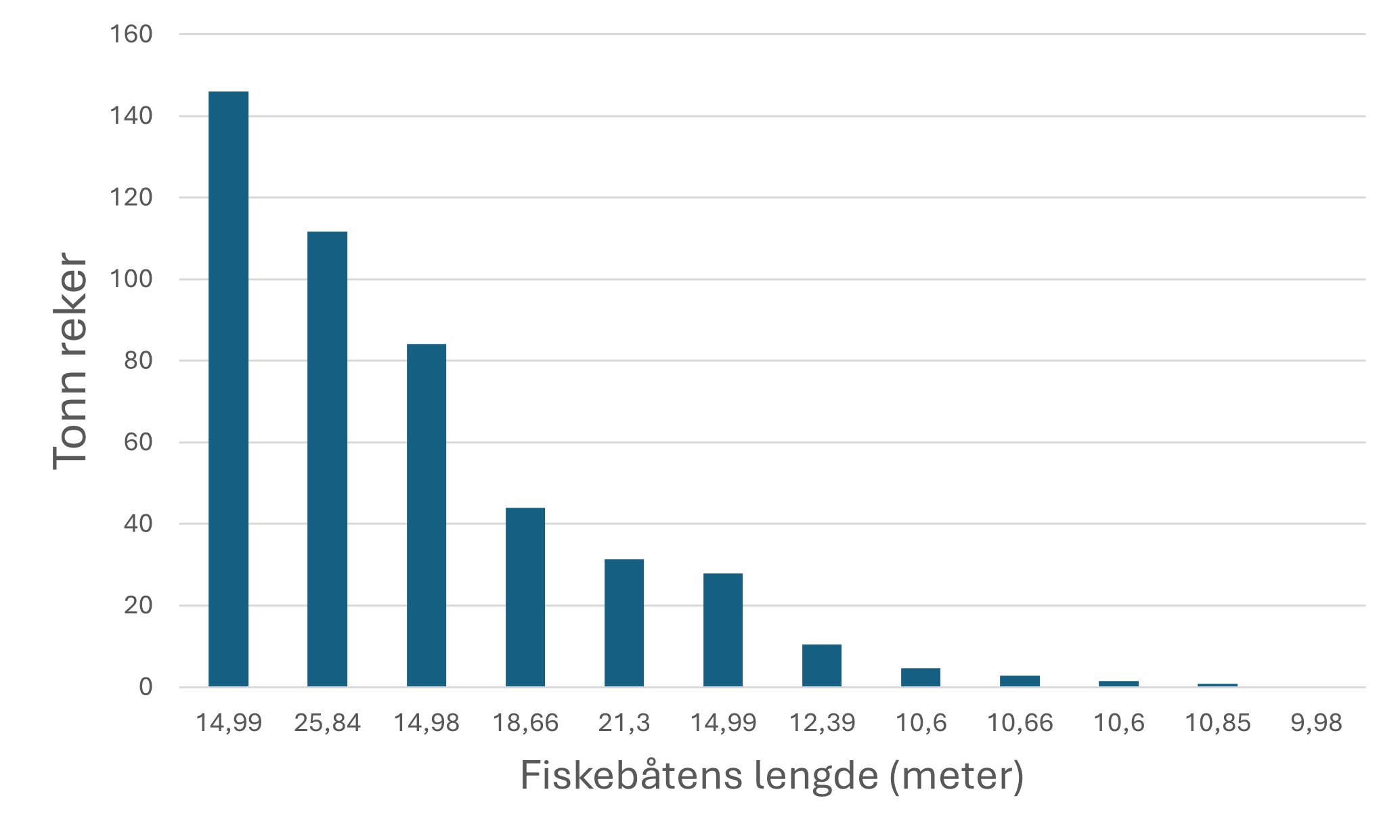
4.3.3 - Spøkelsesfiske
Det er blitt lagt ned en betydelig innsats i kampen mot spøkelsesfiske i Raet nasjonalpark siden 2019 gjennom prosjektene «Tiltak mot spøkelsesfiske i Raet Nasjonalpark» og «Tiltak mot spøkelsesfiske i marine nasjonalparker» (figur 31). Samtidig har lokale dykkerklubber ryddet opp tapte fiskeredskaper. Raet nasjonalpark har gjennom dette også vært fokusområde for forskning på spøkelsesfiske. Estimatet på antall tapte fiskeredskaper i Raet Nasjonalpark fra 0-90 meter er 10 292 (95 % konfidensintervall: 4 749-18 023) (Kleiven et al., 2021). Teiner utgjør mesteparten av de tapte redskapene (82 %), etterfulgt av garn (9 %) og ruser (8 %).

Gjennom to masteroppgaver fra Universitetet i Agder (UiA) er det blitt undersøkt hvordan spøkelsesfiske påvirker lokale bestander av hummer, krabbe, torsk og leppefisk. Estimatene for hvor mye dyr som går tapt i spøkelsesfiske ble sammenlignet med offisielle fangstdata fra nasjonalparkens kommuner og estimater på hvor mye som fiskes i fritidsfisket, der det finnes datagrunnlag for det. For krabbe så det ut som om det gikk tapt flere dyr til spøkelsesfiske enn det som ble fisket i det kommersielle fisket (Loga, 2022) . For hummer lå også antall dyr tapt i spøkelsesfiske rundt nivået på det kommersielle fisket, mens fritidsfisket på hummer er det største (Loga, 2022) . For leppefisk og torsk tok spøkelsesfiske færre dyr enn det kommersielle fisket (Numme, 2022) . En tredje masteroppgave tok for seg bruk av råtnetråd for å begrense spøkelsesfisket. Råtnetråden er laget av bomull og er designet for å råtne etter en viss tid i sjøen slik at teina åpner seg og dyr som står fanget slipper ut. Oppgaven fant at det er 50 % sjanse for at råtnetråden har råtnet etter 4,7 måneder (Kerlefsen, 2022) . Ifølge forskriften skal bomullstråd brukt i fritidsfiske ikke være tykkere enn 3 mm, være ubehandlet og ikke ha kjerne. Det ble antatt at tråder som ikke hadde råtnet innen et år ikke fulgte disse kravene (Kerlefsen, 2022) . De fleste dyrene (80 %) stod fanget i redskap som ikke hadde råtnetråd. Oppgaven viste at det er et stort potensial for å spare dyreliv dersom alle teiner har råtnetråd. Årsaken til at en teine ikke hadde råtnetråd kan være at teinen ble tapt før råtnetråd ble påbudt i det gjeldende fiskeriet, eller at råtnetrådpåbudet ikke er fulgt. I tillegg ble antall redskap som går tapt i Raet nasjonalpark hvert år beregnet til 1072 (Kerlefsen, 2022) . Utregningene er basert på tall fra utvalgsundersøkelser av påmeldte hummerfiskere i Raet Nasjonalpark, samt redskap tatt opp under opprydning i Raet nasjonalpark. Se rapporten «Tiltak mot spøkelsesfiske i marine nasjonalparker» (Thorbjørnsen et al., 2023) for metode og flere detaljer om forskningen på spøkelsesfiske i Raet nasjonalpark.
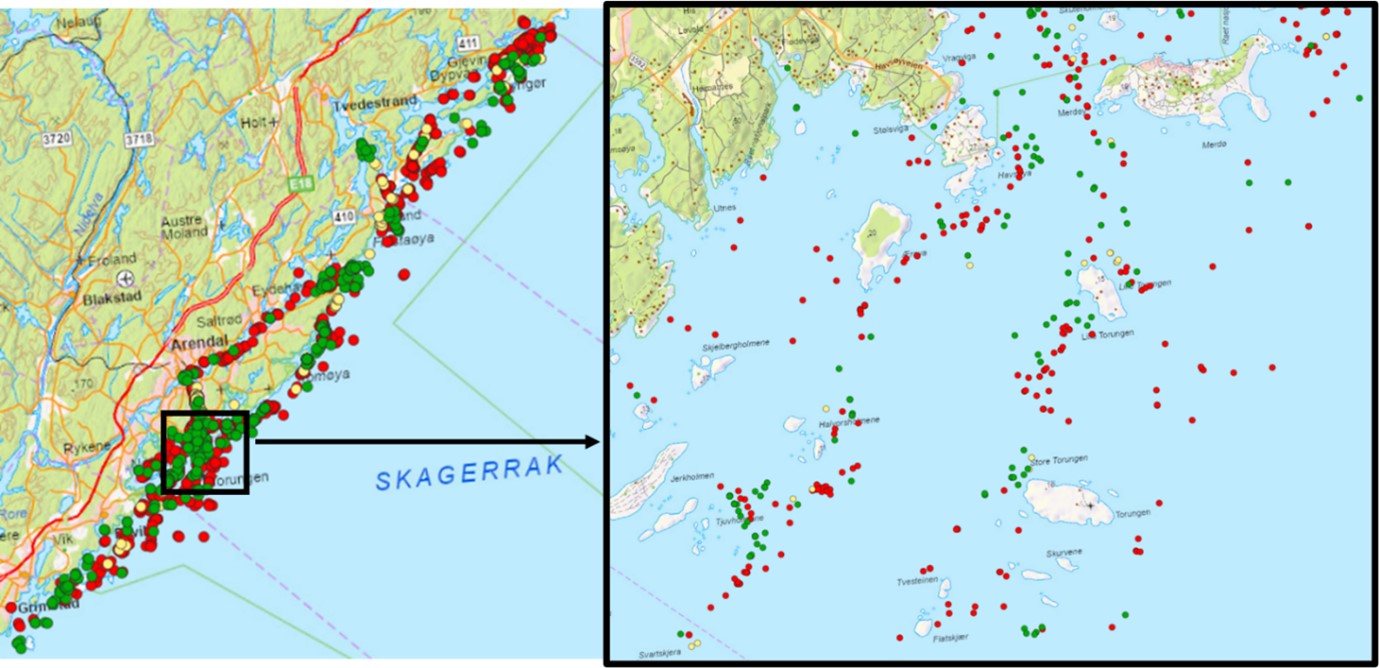
Gjennom ryddeprosjektet er det blitt tatt opp mye plast fra teiner, tauverk og blåser i Raet nasjonalpark. I en bacheloroppgave fra UiA ( Kutke and Strømø, 2022) fant studentene ut hvor mye plast det er i en typisk skotteteine, leppefisketeine og firkantede og runde klappteiner. De fant at det i snitt er 2,26 kg plast i en skotteteine, 1,38 kg plast i en leppefiskteine, 0,36 kg plast i en rund klappteine og 0,22 kg plast i en firkantet klappteine (se Figur 32 for ulike teinetyper). Totalt er det beregnet å ligge 8,4 tonn plast fra disse fire teinetypene i Raet Nasjonalpark.

Det er mange ulike årsaker til at redskap tapes. En vanlig årsak er at redskapen enten er satt for dypt eller har havnet på dypere vann etter å ha blitt flyttet av vind og strøm. På en del av redskapen der blåsen mangler er det også tegn til propellkutt på tauet. Redskap kan også sette seg fast på bunnen, for eksempel rundt en stein eller i gjørme. Det finnes flere enkle løsninger for å redusere risikoen for redskapstap, for eksempel å sørge for at teinen har nok vekt i seg og ikke blir tatt av strømmen eller å ha en massiv, godt synlig blåse. Se nettsiden teinevett.no for tips for å redusere risikoen for redskapstap.
5 - Samlet påvirkning og økosystemeffekter i og rundt Raet nasjonalpark
Menneskelig aktivitet som kan påvirke økosystemet i Raet nasjonalpark innebefatter blant annet fiskeri, næringssalttilførsel, miljøgifter, klimaforandringer, fysisk påvirkning og plastforurensing. Det er ikke gjennomført en analyse av samlet påvirkning i og rundt Raet nasjonalpark. Et slikt pilotprosjekt har derimot blitt gjennomført for ytre del av Oslofjorden (Aarflot et al. 2024). Ytre Oslofjord har mange likheter, men også ulikheter, med områdene i og rundt Raet nasjonalpark. Høyere befolkningstetthet rundt Oslofjorden kan medføre potensielt høyere belastning i form av avrenning, nitrogentilførsel og aktivitet på sjøen. I ytre Oslofjord var det høsting (i hovedsak fiskeri), miljøgifter, mikroplast, fysisk påvirkning og næringssalter som ble identifisert som de fem faktorene som gir størst bidrag til risiko for samlet påvirkning (Figur 33). Merk at analysen fokuserte på lokale påvirkninger og at for eksempel klima ikke er tatt med i analysen. Foruten direkte konsekvens av høsting fra fiskerier utgjør fiskeri også en risiko for fysisk påvirkning, spøkelsesfiske, bifangst og mikroplast. Det er grunn til å forvente at mange av funnene er overførbare til Raet nasjonalpark og omkringliggende områder. Mest sannsynlig har Raet nasjonalpark lavere påvirkning fra næringssalter enn ytre Oslofjord, da befolkningstetthet er lavere og det er færre store vassdrag i området. Det er begrenset med data på næringssalter i de kystnære områdene innenfor Raet nasjonalpark. Dette kan være områder som er mer påvirket av lokale utslipp og det er behov for mer kunnskap om disse områdene.
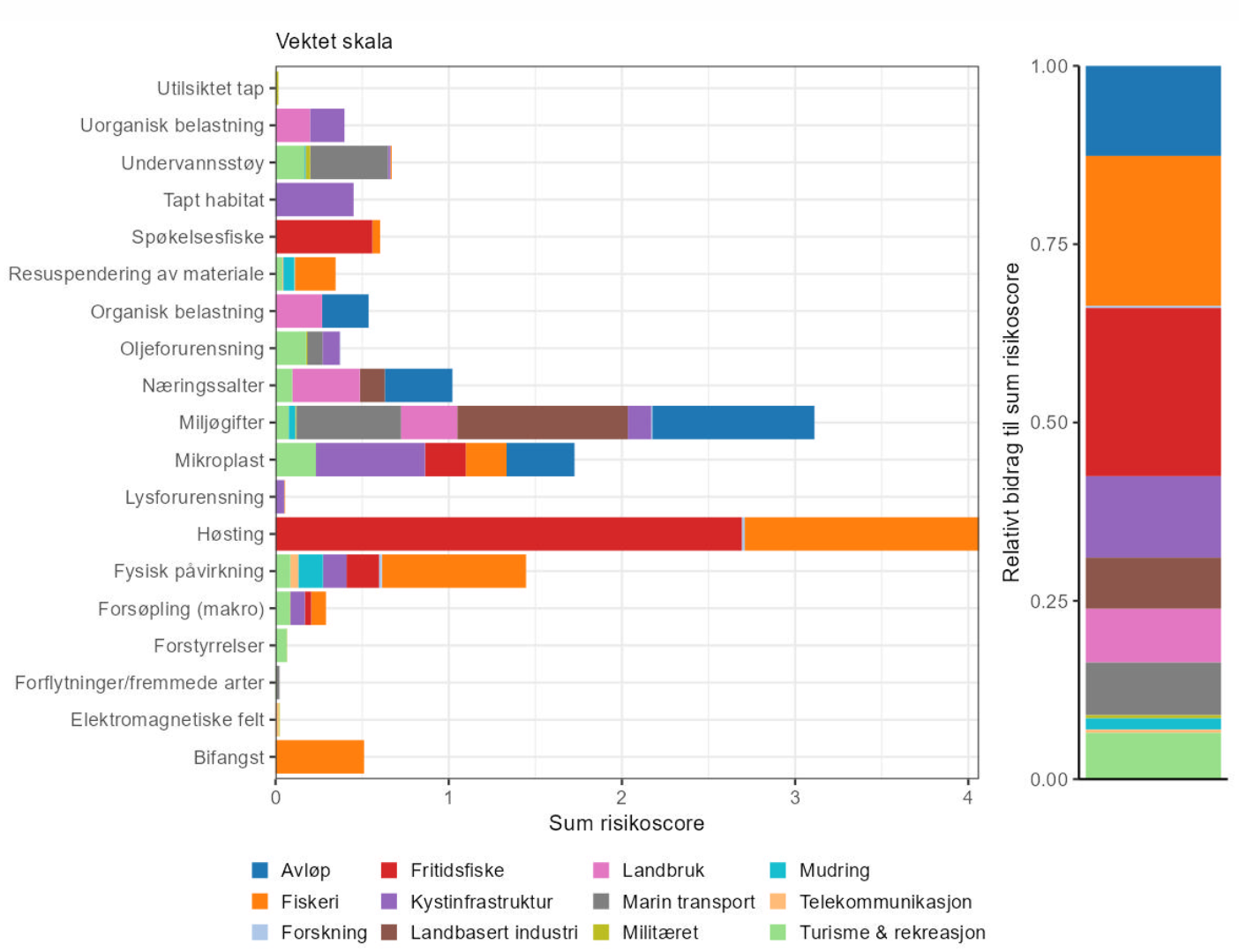
Raet nasjonalpark, som mye av den norske Skagerrakkysten ellers, kjennetegnes med lave bestander av toppredatorer (slik som torsk) og smal alders- og størrelsessammensetning. Viktigheten av en bred alders- og størrelsessammensetning i bestander bør ikke undervurderes. Store, gamle, feite, fruktbare hunnfisk produserer mye mer og ofte større egg som kan utvikle seg til larver som vokser raskere og kan stå imot sult. De har også en trend til å ha tidligere og lengre gytesesonger (Hixon et al., 2014) og bruker flere gyteområder over større geografiske områder i gytetiden (Olsen et al., 2024). Forvaltning som ignorerer verdien av store hunner kan bidra til nedgang i fiskebestander (Barneche et al., 2018). Barneche et al. (2018) viser til at det må 37 torsk på 2 kilo hver for å ha det samme reproduktive utbyttet som en torsk på 30 kilo. Med andre ord, man må ha 74 kilo 2-kilostorsker for å produsere den samme mengden avkom som en torsk på 30 kilo (Figur 34).
Forvaltning fokuserer ofte på enkeltbestander, men arter interagerer med hverandre og hva som skjer med en bestand påvirker, og påvirkes av, hva som skjer med andre bestander. Det kompliserte samspillet gjør at forvaltningen ofte ikke er i stand til å vurdere helheten i økosystemet, men økosystembasert kunnskap er nødvendig for at råd og tiltak skal sikre at økosystemene beholder sine viktige egenskaper og funksjoner.
Trofisk nivå er et nivå i en næringskjede eller næringsnett en art befinner seg på basert på hva den spiser. Nederste trofiske nivå er en alge, plante eller planteplankton (primærprodusenter) som lager sukker gjennom fotosyntese og forsyner trofiske nivåer over seg med næring. Primærprodusentene blir spist av arter på et høyere trofisk nivå, slik som dyreplankton (beitere). Dyreplankton kan bli spist av planktonspisende fisk, slik som sild (rovdyr). Sild er mat for rovdyr høyere opp, blant annet torsk. En art spiser gjerne mange ulike arter på ulike trofiske nivå. Torsk er for eksempel en opportunist med et bredt spekter av fødevalg, slik som sild, reker, strandkrabber og børstemark. For eksempel er pigghåens trofiske nivå 4,5 og for torsk 4,36. Reke derimot spiser lengre nede i næringskjeden og har et trofisk nivå på 3,07 (fishbase.se). En art kan endre trofisk nivå ettersom den vokser seg større, så eksemplene her er beregnet gjennomsnittlig trofisk nivå. Til sammen danner alle næringskjedene næringsnett av alger og dyr som spiser en eller flere på andre trofiske nivå.
Hvis viktige tropp-predatorer blir nedfisket kan dette medføre en kjedereaksjon i næringskjeden, såkalte trofiske kaskader der annethvert nivå i næringsnettet hhv øker og reduseres. Figur 35 fra Eriksson et al. (2023) viser for eksempel at nedgang i torsk (både i antall og størrelse) kan medføre tap av ålegress. En nedgang i torsk fører til en vekst i for eksempel strandkrabber og kutlinger (mesopredatorer). Disse beiter blant annet på små krepsdyr som amfipoder og isopoder. Disse små krepsdyrene beiter igjen på alger som vokser på ålegress, trådformede hurtigvoksende alger, på folkemunne kalt «lurv». Når det blir mer strandkrabber vil det bli økt beitepress på krepsdyrene og høyere overlevelse av lurv. Økt tilførsel av næringssalter (eutrofiering) bidrar til høyere vekstpotensial for hurtigvoksende trådformede alger. Et teppe av trådformede alger medfører igjen økt tilgjengelighet for gjemmeplasser for mesopredatorer, som fører til videre vekst av blant annet krabbebestanden. Med dette kan et overfiske på torsk og andre topp-predatorer påvirke utbredelsen av lurv og tap av ålegress og tang- og tarebeltet nederst i næringsnettet.
Et annet eksempel er kråkebollenes nedbeiting av tareskog som startet på 1970-tallet langs norskekysten og som førte til en vedvarende marin ørken på rundt 2000 km2. Hvordan kunne dette skje? Norderhaug et al. (2021) viste at det var overveiende sannsynlig at overfiske på steinbit, torsk og hyse var hovedårsaken til oppblomstringen av kråkeboller og nedbeiting av tareskogen. Store topp-predatorer hadde holdt kråkebollebestanden i sjakk. Når disse bestandene gikk ned blomstret bestanden av kråkeboller opp og tareskogen ble beitet ned (Figur 36).

Bekymringen rundt tap av kysthabitat som ålegress, tang og tare langs kysten av Skagerrak, samt større utbredelse av «lurv», kan derfor også være knyttet til fraværet av topp-predatorer like mye som overskudd på næringssalter. Et robust og velfungerende økosystem vil derfor være avhengig av funksjonen til alle trofiske nivå i næringskjeden. Samtidig er det et behov for mer kunnskap om vannkvalitet i indre kystområder og vurdere tiltak for å redusere denne risikoen.
På grunnlag av dette er det viktig at Bevar Raet-prosjektet fokuserer på ivaretakelse av alle typer representative habitater og arter, samt alle trofiske nivå i økosystemet. Dette vil innebære en økosystemtilnærming til forvaltningstiltakene, der det ikke er utvalgte arter som blir vektlagt på bekostning av andre.
6 - Marine bevaringsområder
Marine verneområder har en viktig rolle å spille i forvaltningen av havet, både for bevaring og som et verktøy i fiskeriforvaltningen (FAO, 2010). Det er et mål i norsk fiskeriforvaltning å oppnå en økosystembasert fiskeriforvaltning og Havressursloven (implementert i 2009) var et viktig grunnlag for å kunne oppnå dette (Fiskeridirektoratet, 2017). Forvaltningen av de marine høstbare ressursene i Norge er likevel hovedsakelig fortsatt basert på én-bestandsanalyser. Mange marine arter (også arter som blir fisket) er så data-fattige at det ikke foreligger bestandsmodeller, og det er en krevende øvelse å ha oversikt over alle interaksjonene i økosystemet. Marine verneområder kan spille en viktig rolle i tilnærmingen til økosystembasert forvaltning i fiskeriene, fordi de omfatter hele økosystemet såfremt verneområdene er riktig regulert (FAO, 2010). Marint vern er ansett som et viktig verktøy for å ivareta naturmangfoldet og for å opprettholde essensielle økosystemfunksjoner.
Naturmangfold kan også kalles biologisk mangfold eller biodiversitet. Naturmangfold inkluderer ikke bare arter som vi vurderer som sjeldne eller truede, men alle levende organismer og interaksjonene mellom disse. Naturmangfold omfatter også genetisk mangfold innen en art som er viktig for en arts potensiale til å tilpasse seg endringer i miljøet, slik som klimaendringer (Norderhaug et al. 2024) og alders- og størrelsessammensetning fordi nok store individer er viktig for bestanders potensiale til reproduksjon i tid og rom (Olsen et al. 2023).
Havpanelet (https://www.oceanpanel.org/about) ble tidligere ledet av Statsminister Erna Solberg og president Surangel S. Whipps jr. fra Palau. I 2021 overtok Statsminister Jonas Gahr Støre som den norske lederen av Havpanelet. En rekke ekspertrapporter har blitt utarbeidet for Havpanelet, blant annet en rapport som behandlet kritiske habitater og biodiversitet (Rogers et al., 2020). I rapporten blir det anbefalt at 30-40 % av «nøkkelhabitater» (dvs habitater som er viktige for overlevelse, reproduksjon eller generell velferd for en gitt art eller gruppe av organismer) blir fullt beskyttet. Videre står det i rapporten (Rogers et al., 2020, oversatt fra engelsk):
Det er betydelige dokumentasjon på at etablering av sterkt håndhevede, fullt beskyttede marine verneområder som inkluderer 30-40 prosent av marine nøkkelhabitater vil bevare biologisk mangfold, øke biomasse og tetthet av marint liv samtidig som de forsterker motstandsdyktigheten til de marine økosystemene (Roberts et al., 2001; Barrett et al., 2007; Lester and Halpern, 2008; Gaines et al., 2010; Edgar et al., 2014; Mellin et al., 2016; Sala and Giakoumi, 2018). Disse verneområdene kan også være til fordel for fiskeriene (Roberts et al., 2001; Gaines et al., 2010; Di Franco et al., 2016; Ban et al., 2017), bidra til beskyttelse av kysten (Roberts et al., 2017) og bedre motstandsdyktigheten på effekter av klimaendringer (Mellin et al., 2016; Roberts et al., 2017).
Benevnelsen «marine verneområder» brukes gjerne i tilknytning til områdevern gjennom Naturmangfoldsloven. Fredningsområder for hummer derimot, er etablert gjennom Havressursloven med formål om å forvalte hummerbestanden. Dette ligger under «Andre Effektive Arealbaserte Bevaringstiltak» (OECM – Other Effective Area-based Conservation Measures) i Naturavtalen. Som samlebetegnelse for dette bruker vi her «Bevaringsområder».
Den internasjonale kunnskapen om marine bevaringsområder kan i dag karakteriseres som omfattende; det er frembrakt solid kunnskap om bevaringseffekter, men det er fortsatt kunnskapsbehov om blant annet utforming, regionale effekter og optimalisering for å understøtte fiskeriforvaltningen. Det er også videre behov for forskning på effekter i omkringliggende områder.
Det snakkes gjerne om to ulike effekter av marine bevaringsområder. Først og fremst er det bevaringseffekter. Dette er effektene som observeres innenfor bevaringsområdet og kan måles i form av for eksempel artsrikdom, størrelses- og alderssammensetning og biomasse. Videre kan også bevaringsområdene bidra til effekter i omkringliggende områder. Dette kan skje ved at høyere tetthet av arter i et bevaringsområde medfører «lekkasjeeffekt», eller “spillover”, av voksne individer ut i de fiskede områdene og /eller en rekrutteringseffekt der økt produksjon av egg og larver fører til spredning av dette ut i de fiskede områdene (Figur 37).
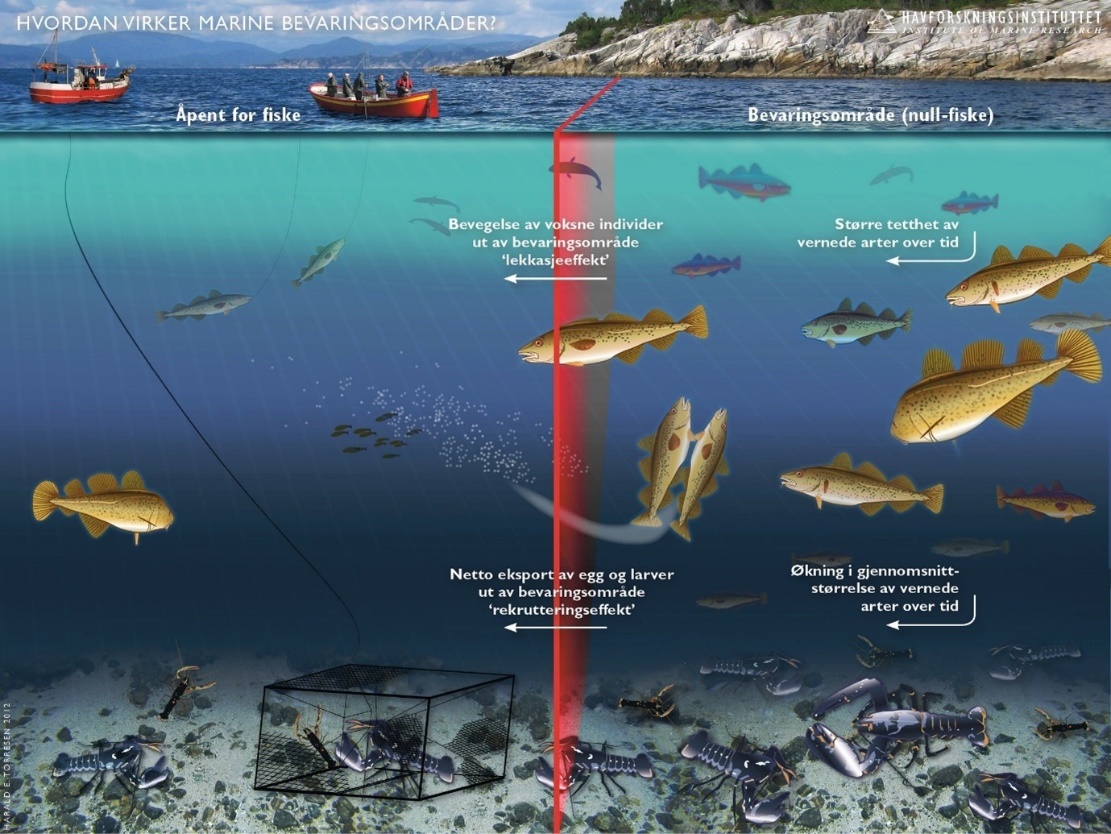
Positive effekter på artsmangfold, alder, størrelse og biomasse innenfor bevaringsområder er godt dokumentert globalt (Lester and Halpern, 2008; Lester et al., 2009; Fenberg et al., 2012; Edgar et al., 2014; Sala and Giakoumi, 2018; Letessier et al., 2024). Det kan være stor variasjon i hvor store effektene er fra område til område (se Fenberg et al. (2012) og Figur 38). Dette kan ofte forklares med blant annet alder på bevaringsområdene, størrelse, håndhevelse og design (Edgar et al., 2014).
Fullt eller høyt beskyttet innebærer blant annet at fiske og annen høsting ikke forekommer i områdene (Day et al., 2019). Viktigheten av at områdene er fullt eller høyt beskyttet kan ikke overdrives. En rekke studier har vist at delvis beskyttede områder har på langt nær så positive effekter på økosystemet som fullt beskyttede områder og i mange tilfeller har det ikke vært sporbare effekter av tiltaket. En meta-analyse av Sala and Giakoumi (2018) viser dette tydelig, der null-fiskeområder har stor effekt sammenlignet med åpne områder og sammenlignet med delvis beskyttede områder.
Delvis beskyttede områder er en samlebetegnelse for marine verneområder som ikke er fullt eller høyt beskyttet. De har et vern som er strengere enn omkringliggende områder, men nivået på beskyttelse kan variere betydelig. En studie fra Australia (Turnbull et al., 2021) viste også at det ikke var noen forskjell mellom åpne områder og delvis beskyttede områder. Men det var derimot tydelige effekter på artsmangfold og fiskebiomasse når disse ble sammenlignet med fullt beskyttede områder. Videre viste denne studien at fullt beskyttede områder var bedre forstått, støttet og verdsatt av befolkningen enn delvis beskyttede områder.
Lyme Bay i England er et delvis beskyttet område som kan vise til positive effekter på naturmangfold når de mest destruktive metodene for fiske (skjellskraping og bunntråling) er fjernet fra et større område (>200 km2, Davies et al., 2021). Samtidig med opprettelsen av delvis vern ble det iverksatt et eget forvaltningssystem for å begrense fisketrykket fra blant annet teiner og garn (Renn et al., 2024). Faste redskaper kan ifølge dette systemet bare benyttes av yrkesfiskere med lisens. Antall lisenser til å drive det teinebaserte fisket er tilpasset ressursene slik at utøverne oppnår lønnsomhet i sine fiskerier. Lyme Bay er et eksempel på hvordan et økosystembasert forvaltningssystem har oppnådd positive effekter for det biologiske mangfoldet og for det lokale fiskeriet.
De fleste studiene på effekter av vern i fiskerisammenheng har fokusert på fisk- og skalldyrbestander utsatt for intensivt fiske. Effektene av vern på andre arter enn målarter og indirekte effekter av vern er i mindre grad dokumentert. Studiene som har inkludert hele økosystemet har demonstrert såkalte “trofiske effekter”, der gjenoppbygging av predatorfunksjon (større og flere hummer, større og flere fisk) har gjort at tang og tare har kommet tilbake til områder som tidligere var dominert av tallrike beitende kråkeboller (Eisaguirre et al., 2020; Peleg et al., 2023).
Marine bevaringsområder er ikke immune mot marine hetebølger som oppstår med økt intensitet og hyppighet som følge av klimaendringene. Et nytt globalt studium som vurderte effektene av marine bevaringsområder på tareskog (som også inkluderte Raet nasjonalpark) viste at bevaringstiltak virker mest effektivt på målarter som fisk og direkte påvirkning som fiske, men var mindre effektivt for andre arter og habitater (indirekte effekter) og mot påvirkning som er relatert til klimaendringer (Filbee-Dexter et al. 2024). Et intakt artssamfunn med størst mulig mangfold av funksjoner vil likevel være naturens beste forsvar mot endringene, og kan gjøre økosystemet mer “resilient” (motstandsdyktig). Gjenoppbygging av slikt mangfold og langsiktig bevaring av funksjoner kan ikke oppnås i et marint bevaringsmråde uten tiltak og forvaltning som sikrer effektivt beskyttelse.
7.1 - Forskning på fredningsområder for hummer i Norge
I dag finnes det ikke fullt eller høyt beskyttede områder i Norge. Bevaringsområder med strengest regulering i Norge er mest sannsynlig hummerfredningsområder som er lokalisert i marine verneområder og nasjonalparker (Horta e Costa et al., 2016; Dunshea et al., 2024). Fredningsområder for hummer kan karakteriseres som et delvis beskyttet område. Det er forbud mot faststående fiskeredskap, slik som teiner, garn og ruser, men det er tillatt å fiske med blant annet stang og snøre, samt snurpenot. Hummer (målt som landet hummer per teinedøgn under hummerfisket) har hatt en nedgang på rundt 90% de siste 90 årene i Norge (Kleiven et al., 2022). I tilknytning til fredningsområdene for hummer i Raet nasjonalpark har det vært omfattende studier de siste 20 årene. I 2006 ble de fire første fredningsområdene for hummer etablert. En av disse er lokalisert i Raet nasjonalpark (Flødevigen). Motivasjonen var for å se på hvordan hummerbestanden svarte på fravær av fiske (Knutsen et al., 2022). Ved å studere dette kan man få bedre grunnlag for å vurdere hvor stor innvirkning fiske har på en bestand sammenlignet med andre faktorer (naturlige variasjoner, klimaendringer, forurensing etc.). Forskningsgruppen gjennomførte et såkalt før-etter-behandling-kontroll studie. Det vil si at man før etablering gjennomførte et forskningsfiske både i det kommende fredningsområdet og i et nærliggende kontrollområde som ikke skulle bli fredet. I kontrollområdet vil det være vanlige reguleringer som gjelder. Etter etablering følger man opp med samme forskningsmetode i både frednings- og kontrollområdet. Forskningsoppfølgingen viste at etter 4 år hadde antall hummer per teine i fredningsområdet økt med 245 %, mens det var en økning på 87 % i kontrollområdene. Videre hadde gjennomsnittsstørrelsen økt med 13% i fredningsområdet, mens det var liten endring i kontrollområdet (Moland et al., 2013b). Ved å beregne utvikling i vekt hummer per teine, kan man kombinere antall hummer og deres størrelse. Etter 15 år med fredning var kilo hummer per teine økt med over 500 % sammenlignet med kontrollområdene (Figur 39). I kontrollområdene har bestanden variert, men vært relativt stabil (Knutsen et al., 2022).
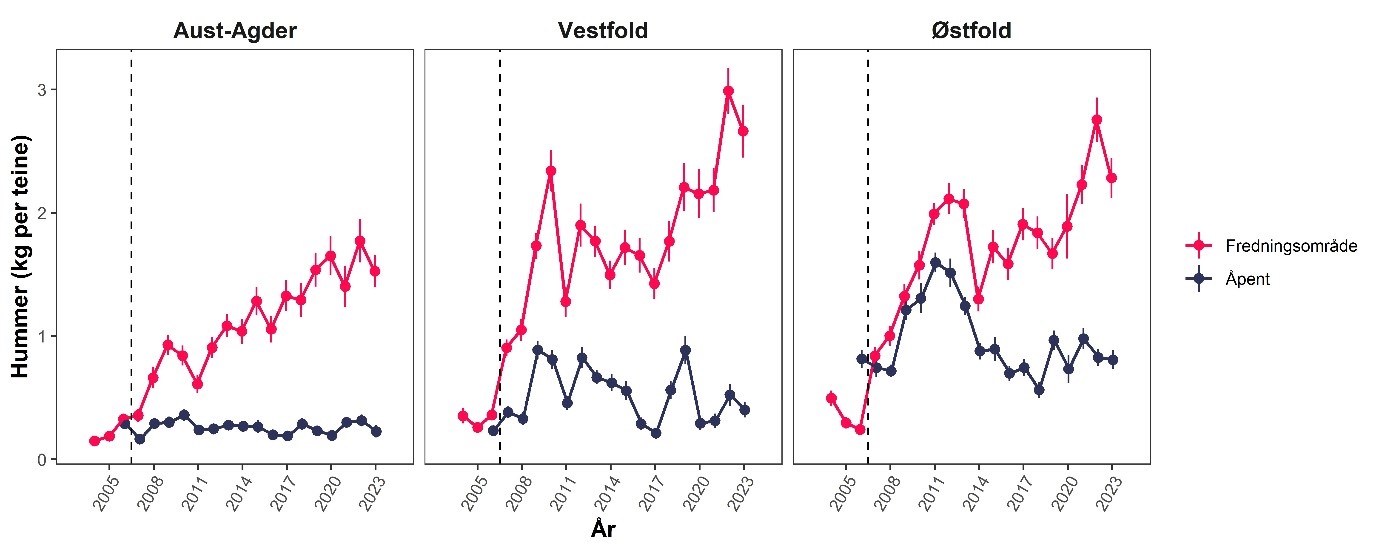
I 2012 ble et nytt fredningsområde for hummer etablert i Raet nasjonalpark (Askerøya). Med sine 4,9 km2 er dette fredningsområdet rundt fem ganger større enn Flødevigen. Siden de første fredningsområdene viste betydelige effekter, har forskningsoppfølgingen av dette området fokusert på å studere samspillet mellom fredningsområdet og de omkringliggende områdene (Kleiven et al., 2019b). Både før og etter etablering ble det fisket etter hummer innenfor fredningsområdet og 2-3 kilometer i begge retninger langs kysten utenfor området. I det samme området ble det også foretatt registrering av teiner (blåser) første uken av hummerfisket (Figur 40).
I fredningsområdet har både fangst per teinedøgn og snittstørrelse økt som i de andre fredningsområdene (Figur 41).
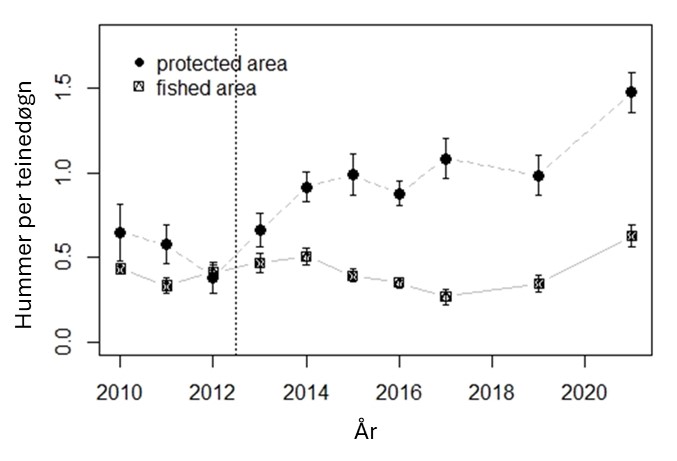
Fire år etter etablering hadde hummerbestanden vokst mest i midten av fredningsområdet og gikk ned når man beveget seg mot grensene (Figur 42). På grensen var fangsten lik som før etablering og noe lavere på utsiden. Ved å kartlegge hummerfisket før og etter etablering ble det vist at antall redskap hadde fordoblet seg i studieområdet etter at fredningsområdene ble etablert og tredoblet seg i området nærmere enn en kilometer fra fredningsområdet (Kleiven et al., 2019b). Ni år etter etablering kommer grenseeffektene tydeligere frem i undersøkelsene. Bestanden i fredningsområdet har fått bygget seg opp til et så høyt nivå at det fører til et overskudd av hummer på utsiden av grensen. Dette kaller man gjerne utvandringseffekt som kan være et positivt bidrag til fiskeriene fra fredningsområdet.
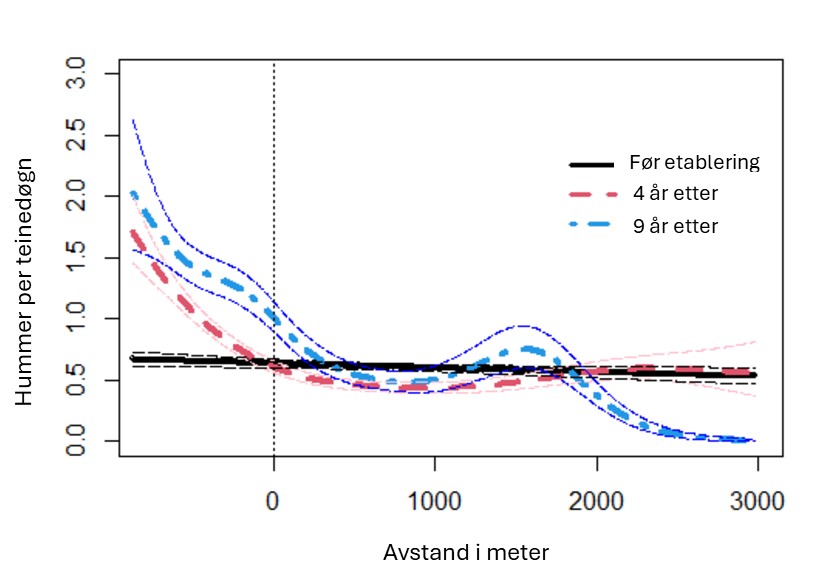
Forskningen på fredningsområder for hummer viser at fiske har betydelig påvirkning på hummerbestanden. Både antall hummer og størrelse øker markant i fredningsområdene. Dette fører til økt tetthet av hummer på utsiden av grensen og kan bidra til høyere fangster i fiskeriet. Flere og større hummer i fredningsområdet medfører også en betydelig økning i produksjonen av egg og larver. Dette er mest sannsynlig den viktigste effekten for omkringliggende områder, der det eksporteres et overskudd av larver fra fredningsområdet til omkringliggende fiskede områder. Dette kan da føre til høyere rekruttering i de fiskede områdene. En masteroppgave ( Calef, 2016) ved DTU-Aqua og Havforskningsinstituttet indikerte at egg- og larveproduksjonen økte med rundt 300% i hummerfredningsområder etter 9 år (2015). Etter dette har bestanden i fredningsområdene økt videre og det er grunn til å forvente at også egg- og larveproduksjonen har økt.
I fredningsområdene for hummer gjennomføres det et årlig forskningsfiske. Da blir hver hummer som fanges merket før de settes ut igjen. Hvert merke har en unik kode slik at vi kan følge hummeren over år når den blir fanget igjen ved en senere anledning. Dette har dannet et stort datagrunnlag for å si noe om hummerens bevegelser og vekst. En studie av Sørdalen et al. (2022) viste at hummeren i fredningsområder vokser raskere enn i fiskede områder. Den har oftere skallskift og vokser 9 % mer per skallskift. Årsaken til dette er mest sannsynlig at fiskeriene har en tendens til å fiske opp de mest produktive dyrene, de lar seg lettere fange enn de mer saktevoksende, og gjerne mindre aktive, dyrene. I fredningsområdene får disse hummerne fred fra fiske og kan bidra til økt vekst og produktivitet.
Fredningsområder har dokumentert effekt på hummerbestanden. Det er derimot fortsatt knyttet usikkerhet til hvilken effekt de har på andre arter og naturmangfoldet. Som nevnt er det lov å fiske med blant annet stang og snøre i hummerfredningsområdene (Hoel et al., 2023).
Det har blitt sporet begrensede positive effekter på torsk (tetthet og størrelse) i hummerfredningsområdet i Flødevigen (Moland et al., 2013b). Basert på merke-gjenfangst av torsk i Flødevigen hummerfredningsområde fant Fernández-Chacón et al. (2015) at andel av torsk som døde på grunn av fiske ble redusert fra 59% før fredning til 32% etter fredning. Årlig overlevelse økte med 167% (fra 9 % til 24%) for små torsk og 83 % (fra 23% til 42%) for stor torsk. Utvandring av torsk fra fredningsområdet økte med tid. En modell beregnet hvilken effekt det ville hatt å innføre fiskeforbud. Da ville årlig overlevelse økt med ytterligere 100% (fra 24% til 48%) for små torsk og 44% (fra 42% til 60% for stor torsk). Det er derfor tegn på at hummerfredningsområder kan ha effekt på torskebestanden, men en betydelig lavere effekt enn i et 0-fiskeområde. Videre er det risiko for at en mulig økning i antall og størrelse på torsk og annen fisk i hummerfredningsområdet kan lokke til seg mer fiskeaktivitet fra stang- og snørefiskere. Dette ble observert i et lignende bevaringsområde i New Zealand (kun sportsfiske med klart definerte regler) der området tiltrakk seg flere sportsfiskere med påfølgende negativ bevaringseffekt ( Ballantine, 2014) . Dette medførte at bevaringsområdet ble regulert slik at også stang- og snørefiske ble forbudt. Med den høye aktiviteten i fritidsfiske i Raet er det grunn til å forvente samme typer effekter.
Det har også blitt observert positive effekter på leppefisk i hummerfredningsområder. Halvorsen et al. (2017) fant at bergnebb over minstemål økte med 33-65 % i hummerfredningsområdet og at det også var positive effekter i 3 av 4 fredningsområder på bestanden av grønngylt. Leppefisk fiskes i hovedsak med faste redskaper (teiner og ruser) av kommersielle fiskere. Hjemmeområdene er også relativt små (Halvorsen et al., 2021). Det er derfor ikke overraskende at det er en vekst i tettheten av leppefisk i hummerfredningsområder.
Taskekrabber har overlappende leveområder med hummer og er også i hovedsak beskyttet fra høsting i hummerfredningsområder. En masteroppgave ved Havforskningsinstituttet og DTU-Aqua fant tegn på at fangstene av krabbe gikk ned samtidig som hummerfangstene gikk opp (Glemarec, 2016). Dette tyde på at en vekst i hummerbestanden kan medføre en nedgang i krabbebestanden. Men det er knyttet usikkerhet til tallene. Krabber har en tendens til å ikke gå inn i teiner der det allerede står en hummer, mens hummer har høyere sannsynlighet for å gå inn i teiner der det allerede er krabber (Skerritt et al., 2020) . Det er derfor knyttet usikkert til om det er adferd eller endring i bestand (eller en kombinasjon) som har medført en nedgang i fangster av taskekrabbe i hummerfredningsområder.
7.2 - Marin bevaring i Norge og Raet
Norske marine verneområder og nasjonalparker har generelt sett få reguleringer på fiske sammenlignet med omkringliggende områder (Horta e Costa et al., 2016; Jørgensen et al., 2021; Roessger et al., 2022), til tross for at det er betydelig forskningsdokumentasjon på at fiskerier har vært og er den største påvirkeren av de marine økosystem (Brondízio et al., 2019) og at marine verneområder der fiske ikke er strengt regulert ofte har begrenset effekt på naturmangfoldet (Edgar et al., 2014; Sala and Giakoumi, 2018; Turnbull et al., 2021).
Generelt kan norske marine verneområder være å betrakte langt nede på denne skalaen av «delvis beskyttet», der det er svært få begrensninger på fiske og sågar foregår tråling i mange av områdene, deriblant Raet nasjonalpark. Det er derfor ingen grunn til å forvente sporbare effekter på marint naturmangfold i mange av de marine verneområdene i Norge (Horta e Costa et al., 2016; Roessger et al., 2022). Men det mangler empirisk forskning på marine verneområder i Norge.
De strengest beskyttede områdene i Norge i dag er nok fredningsområder for hummer som ligger inne i marine verneområder og nasjonalparker. Men selv disse områdene kan ikke betraktes som fullt eller høyt beskyttet, da det er tillatt med fiske med stang og snøre.
Marine verneområder er et vidt begrep der restriksjonsnivåer varierer mellom land og områder. Dette kan henge sammen med formål med vernet, men det kan også være tilfelle at faglig kunnskap om marint vern ikke har vært godt nok integrert i planarbeidet, og restriksjonsnivå dermed ikke samsvarer med vernets formål og ambisjoner. Ofte er også formålet svært generelt beskrevet, noe som gjør det utfordrende å identifisere reguleringsbehov og kvantifisere eventuell måloppnåelse. Hvis verneområder eksisterer i loven, men at eksperter forventer at beskyttelsesnivået ikke er tilstrekkelig til å hindre degradering, kan de defineres som «papirparker» (IUCN, 1999; Relano and Pauly, 2023) .
Norge er medlem av den internasjonale naturvernunionen (IUCN) og rapporterer sine marine verneområder internasjonalt ved å gi en IUCN-kategori. IUCN har utviklet en veileder for kategorisering av marine verneområder (Day et al., 2019), som dekker både strengt og mildt vern. Strengeste vern er kategori «Ia» som er strengt beskyttede områder som er satt av for å beskytte biodiversitet, hvor menneskelig besøk, bruk og påvirkning er strengt kontrollert og begrenset for å sikre beskyttelse av bevaringsverdiene. Fjerning av arter eller modifisering, uttak eller innsamling av ressurser (f.eks. gjennom noen form for fisking eller mudring) er ikke kompatibelt med slike områder. Ankring bør ikke tillates. Marine verneområder i Norge har tidligere blitt meldt inn som kategori Ia. Samtidig har marine nasjonalparker, slik som Raet, blitt rapportert som vernenivå «II» (Jørgensen et al., 2021). Ifølge IUCN sin veileder (Day et al., 2019) er slike områder satt av for å beskytte storskala økologiske prosesser i tillegg til arter og økosystemkarakteristikker for området. I slike områder er ekstraktive aktiviteter (av levende og dødt materiale) ikke konsistent med målene (f.eks. alle typer fiske, inkludert fritidsfiske). Kategori «VI» er det mildeste vernet, men har fortsatt definisjonen som marint verneområde. I slike områder er bevaring og bærekraftig bruk integrert, men industrielt fiske, industri-skala akvakultur, utslipp av ubehandlet avfall og gruvevirksomhet skal ikke tillates. En fullstendig gjennomgåelse av de ulike IUCN-kategoriene, inkludert definisjon, hovedmål, lovlige aktiviteter og forbudte aktiviteter er gitt i Day et al. (2019) . Denne veilederen er allikevel å anse som generell. Det er derfor gjennomført en rekke vitenskapelige arbeider basert på beste tilgjengelig kunnskap om hvordan ulike menneskelige aktiviteter påvirker marine økosystemer og hvordan disse aktivitetene potensielt påvirker marine verneområder.
Det er godt faglig grunnlag til å argumentere for at industrielt fiske ikke er kompatibelt med marin bevaring (Day et al., 2019; Grorud-Colvert et al., 2021; IUCN, 2021). Det er derfor problematisert om verneområder der det forekommer industrielt fiske kan innrapporteres internasjonalt som et marint verneområde. Industrielt fiske defineres slik av IUCN (IUCN, 2021 , oversatt til norsk):
Motoriserte fartøy (>12 m lang x 6 m bred) med kapasitet på >50 kg fangst/tur, som krever substansielle summer for konstruksjon, vedlikehold, og operasjon og for det meste solgt kommersielt, og at alt fiske som bruker trålredskap som blir slept eller tauet over havbunnen eller gjennom vannsøylen, og fiske som bruker snurpenot og store liner, er definert som industrielt fiske.
Generelt har det vært lite forskning på effekter av marint vern i Norge (men se Filbee-Dexter et al. 2024, som inkluderer Raet nasjonalpark). Dette har nok en sammenheng med at Norge har svært begrenset med verneområder som er fullt eller høyt beskyttet. I de fleste marine verneområder i Norge vil det sannsynligvis i liten grad være mulig å spore effekter på biologisk mangfold, tetthet og biomasse som følge av vern (Roessger et al., 2022). Skagerrakkysten har vært det viktigste forskningsområdet på effekter av marin bevaring i Norge gjennom de siste to ti-årene (Moland et al., 2021). Dette har i hovedsak vært knyttet til fredningsområder for hummer, der de første ble etablert i 2006. Også Norges eneste strengt beskyttede område (i form av fiskeriregulering, null-fiske) har vært i Skagerrak og i nær tilknytning til Raet nasjonalpark, nærmere bestemt Tvedestrandsfjorden. Omfattende forskning har blitt gjennomført i disse områdene og en gjennomgang av mange av studiene ble nylig publisert av Moland et al. (2021) .
7.3 - Vurdering av effektiv vernestatus for Raet nasjonalpark
Det er begrenset med empirisk forskning på marine verneområder i Norge. Generelt sett er det sammenheng mellom hvor strenge restriksjoner et verneområde har og hva man kan forvente av effekter på naturmangfoldet (Horta e Costa et al., 2016; Grorud-Colvert et al., 2021). Horta e Costa et al. (2016) har utarbeidet et reguleringsbasert klassifiseringssystem for å vurdere verneområders beskyttelsesgrad og sannsynlig måloppnåelse for ivaretakelse av naturmangfold. Klassifiseringen er basert på forskning på effekter av marine bevaringsområder globalt. De har listet en rekke ulike typer fiskemetoder og gitt de en verdi ut fra hvor stor effekt de har på enkeltarter og økosystem basert på forskningslitteratur. Videre er det gitt en verdi på regulering av oppdrett og bunnutnyttelse (e.g skjellsanduttak og mudring), samt båtbruk og ankring. Klassifiseringssystemet fanger ikke opp for eksempel jakt på sjøfugl og sjøpattedyr. Dette kan nok skyldes at det er uvanlig at dette forekommer i marine verneområder internasjonalt og det er begrenset med forskning på effekten av dette. Basert på dette verktøyet analyserte Roessger et al. (2022) alle OSPAR-verneområder i Europa, der Norges marine verneområder og marine nasjonalparker var inkludert. I hovedsak ble det konkludert med at marine verneområder i Norge kan defineres som «ubeskyttet». Denne analysen var ikke fin-skala med tanke på at Raet nasjonalpark har soner med ulike restriksjonsnivåer. Men klassifiseringsverktøyet er utarbeidet slik at evaluering kan ta hensyn til ulike soner med ulike restriksjoner i et verneområde.
Grorud-Colvert et al. (2021) har utviklet en forskningsbasert guide til marin bevaring «the MPA science guide». I tillegg til å vurdere nivået av beskyttelse (reguleringer), legger denne også opp til en evaluering av hvilket stadium etableringsprosessen er på. Til forskjell fra det reguleringsbaserte klassifiseringsverktøyet (Horta e Costa et al., 2016) er ikke sonering direkte inkludert i evalueringsverktøyet. Det er nå etablert et samarbeid mellom disse to evalueringsverktøyene, slik at begge metoder kan integreres i samme evaluering i fremtiden.
Begge metoder støtter seg på forskningslitteratur for å evaluere hva slags beskyttelsesgrad et gitt område har basert på de gitte reguleringer (og hvilke reguleringer man bør ha for å oppnå et visst mål og verneverdi). Graden av reguleringer henger tett sammen med hva man kan forvente av effekter på naturmangfoldet.
Raet nasjonalpark er vurdert basert på begge disse forskningsarbeidene for å se om de slår ut forskjellig. I evalueringen har vi tatt hensyn til at nasjonalparken har flere soner (Figur 43):
1. Tre områder der det er forbud mot fiskeredskap som slepes langs bunnen (i hovedsak tråling).
2. To hummerfredningsområder
3. Resten av nasjonalparken med generelle fiskerireguleringer tilsvarende som i områdene utenfor nasjonalparken.
Verneområder for sjøfugl er ikke tatt med i vurderingen. Det er nødvendig med mer kunnskap for å forstå hvilken rolle verneområder for sjøfugl spiller i marin bevaring og også hvordan effekter på sjøfugl kan integreres i planlegging av marine bevaringsområder. I tillegg kan sjøfuglenes atferd og bruk av marine områder bidra til å kartlegge viktige økologiske funksjonsområder og dermed designe mer effektive bevaringsområder (Ronconi et al., 2012).
I forskrift om vern av Raet nasjonalpark er følgende formål satt (https://lovdata.no/dokument/LF/forskrift/2016-12-16-1632):
Formålet med nasjonalparken er å bevare et større naturområde uten tyngre inngrep med egenartede og representative økosystemer, mange godt bevarte kvartærgeologiske forekomster etter siste istid, og med særlig vekt på plantelivet, dyrelivet, naturtyper, kystlandskapet med sjøoverflaten og kulturminner knyttet til Aust-Agders kystområde både på land og i sjø. For de marine delene er formålet særlig å ta vare på det undersjøiske landskapet med tilhørende marine arter og marine naturtyper som israndsavsetninger, skjellsandforekomster, bløtbunnsområder, ålegras- og undervannsenger, tareskog og gyteområder for fisk.
I sone A er formålet å ta vare på fuglelivet, spesielt med hensyn til sjøfuglene og deres hekkeplasser, jf. kart.
I sone B er formålet å ta vare på sårbare naturtyper og arter, jf. kart.
I sone C er formålet å ta vare på områder med særskilt vitenskapelig betydning som referanseområder i sjø, jf. kart.
Det er tillatt å høste viltlevende marine ressurser i samsvar med havressursloven, men likevel forbudt i sone C å høste med redskaper som slepes under fiske og som kan berøre bunnen.
Allmennheten skal gis anledning til opplevelse av naturen gjennom utøvelse av naturvennlig og enkelt friluftsliv med liten grad av teknisk tilrettelegging.
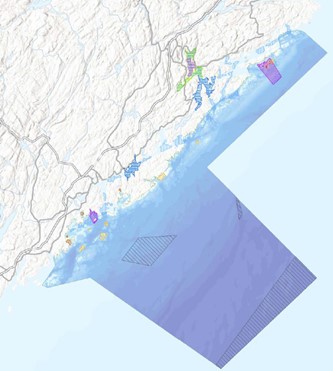
Formålene i lovteksten er svært brede og lite kvantifiserbare. Det vil derfor være krevende å evaluere om vernet har oppnådd formålene.
Det er derimot viktig å merke at det i formålet er nevnt «bevare»… «egenartede og representative økosystemer»… «med særlig vekt på plantelivet, dyrelivet, naturtyper». I de marine delene blir det uttrykt at «formålet særlig å ta vare på det undersjøiske landskapet med tilhørende marine arter og marine naturtyper» inkludert «ålegras- og undervannsenger, tareskog og gyteområder for fisk».
Det er grunn til å forvente at en nasjonalpark eller marint verneområde har en bedre naturtilstand enn omkringliggende områder som ikke har vern og at ikke naturmangfoldet forringes over tid. Bevaringseffektene kan komme til uttrykk gjennom blant annet bestandstetthet, alders- og størrelsesstruktur, biomasse, artsrikdom, forekomst av sjeldne eller truede arter, genetisk diversitet og økosystemfunksjoner (Grorud-Colvert et al., 2021). Videre kan effekten på høstede arter vurderes opp mot utvandring (spillover), larveeksport, forsikring mot feil i fiskeriforvaltning og beskyttelse av sårbare livsstadier (Grorud-Colvert et al., 2021). Man vil forvente større respons på disse indikatorene jo mer restriktivt vernet er.
Klassifisering av bevaringsstatus for Raet nasjonalpark
Tabell 1. Evaluering av Raet nasjonalpark basert på «the MPA Guide» (Grorud-Colvert et al., 2021).
| Aktivitet | Vurdering |
| Er gruvedrift eller olje og gass leting og utvinning lovlig? | Ikke tillatt |
| Er mudring og dumping lovlig? | Søknadspliktig, Ja, men moderat påvirkning, medium skala og moderat varighet |
| Foregår det ankring? | Ja, men moderat påvirkning, medium skala og moderat varighet |
| Er infrastruktur lovlig? | Ja, men lav påvirkning og småskala |
| Er oppdrett lovlig? | Kun for restaurering, ikke for høsting. Så lenge du har stedegne arter som ikke har effekter på miljø. |
| Er fiske lovlig? | |
| Generelle områder | Industrielt fiske (fra fartøy over 12 m i lengde som tauer/sleper fiskeutstyr og/eller en kombinasjon av redskapstyper) er tillatt som er inkompatibelt med bevaring av natur. |
| Områder med forbud mot slepende bunnredskaper | Høyt antall (mer enn 10) fiskeredskapstyper som har stor effekt, men ikke industrielt |
| Hummerfredningsområder | Ja, men moderat antall fiskeredskap (10 eller færre) med moderat påvirkning |
| Er ikke-ekstraktive aktiviteter tillatt? | Ja, moderat til høy tetthet med moderat påvirkning |
| Resultat | Grad av beskyttelse |
| Generelle områder | Inkompatibelt med bevaring av natur |
| Områder med forbud mot slepende bunnredskaper | Minimalt beskyttet |
| Hummerfredningsområder | Lett beskyttet |
I evalueringen kommer det frem at miljøreguleringer med tanke på mineralutvinning, mudring/dumping, ankring, infrastruktur og oppdrett i nasjonalparken er regulert. Men fiskerier har begrenset med regulering, noe som medfører lav forventing av effekter på det biologiske mangfoldet og derfor inkompatibelt med marin bevaring. Siden generelle områder tillater industrielt fiske, blir disse områdene klassifisert som inkompatibelt med marint vern.
Områdene med forbud for bunnslepende redskaper blir vurdert til minimalt beskyttet (minimally protected), hvilket innebærer en forventning om svært begrensede økosystemeffekter:
Minimally protected areas are unlikely to deliver significant outcomes for species, habitats, or human communities.
Hummerfredningsområdene kommer best ut av evalueringen som lett beskyttet:
Some protection of biodiversity exists, but moderate to substantial extraction and other impacts are allowed. These MPAs can achieve some protection of biodiversity for certain species or habitats, but the number and impacts of activities allowed are greater than for highly protected areas
Evalueringsverktøyet er ikke satt opp slik at man kan vurdere hele nasjonalparken under ett, men sone for sone.
Som tidligere nevnt, har Horta e Costa et al. (2016) har utviklet et reguleringsbasert klassifiseringsverktøy for marine bevaringsområder. Dette verktøyet gir også mulighet til å totalevaluere bevaringsområder med ulike soner med ulik grad av beskyttelse, slik som er tilfelle i Raet nasjonalpark (hummerfredningsområder, områder med forbud mot redskap som slepes langs bunnen under fiske og generelle områder). Dette verktøyet legger betydelig vekt på hvordan fiskerier er regulert i området. Dette er det god dekning for å legge hovedvekt på, da fiskerier har vært og er den største påvirkeren på marine økosystemer (Brondízio et al., 2019) og omfanget av effekter i bevaringsområder er tett knyttet til reguleringer av fiskerier (Lester and Halpern, 2008; Giakoumi et al., 2017; Sala and Giakoumi, 2018; Turnbull et al., 2021). Raet nasjonalpark har en rekke reguleringer knyttet til miljølovgivningen, mens det er få begrensninger på fisket sammenlignet med omkringliggende områder. En veileder for evaluering er gitt i appendix 1.
En viktig faktor er hvor mange typer fiskeredskap/metoder som er tillatt i de ulike sonene. Hvis samme redskap er tillatt for både fritids- og yrkesfiskere skal dette regnes som to redskap. Norge har generelt liberale reguleringer på fritidsfiske. Det er verdt å merke at det kan være forskjell på hva som er tillatt og hva som faktisk brukes i et område. For eksempel er det ikke forbud mot kommersiell sanking/undervannsjakt i nasjonalparken, men det forekommer sannsynligvis ikke per i dag. Såfremt en høstingsmetode er tillatt, så kan det potensielt bli benyttet i fremtiden. Det er også liten sannsynlighet for at håndplukking i tidevannssonen forekommer i områder som har forbud mot slepende redskaper i ytre deler av nasjonalparken, da de ikke grenser til land. Det er forbudt å tråle grunnere enn 60 meter i nasjonalparken, så på mange måter har områder grunnere enn 60 meter lignende regulering som sonene det er forbud mot bruk av bunnslepende fiskeredskap. Områder grunnere enn 60 meter er ikke tatt med som en egen sone i evalueringen, men ved å se på hvilke redskaper som er tillatt i sonene med forbud mot slepende redskaper, kan man også få en indikasjon på hva slags beskyttelsesnivå områder grunnere enn 60 meter har per i dag. Samtidig er det fiskemetoder som kan være tillatt i Raet nasjonalpark som ikke er på listen til Horta e Costa et al. (2016) .
I de generelle sonene i Raet nasjonalpark er det tillatt med 27 fiskeredskaper (sone 1, tabell 1). Fiskeredskapet med høyest belastning på det marine økosystemet i denne sonen er trål, og dette redskapet får høyeste verdi i klassifiseringssystemet «9». I sonene der det er forbud med bunnslepende redskaper er det tillatt med 25 fiskeredskaper, der trollgarn og strandnot er redskapene med høyest belastning «8» (sone 2, tabell 1). Hummerfredningsområder (sone 3, tabell 1) har 5 tillatte fiskeredskaper der fiskeredskapet med høyest belastning er pelagisk snurpenot «5». Videre er båtbruk og ankring i hovedsak uregulert, men i småskala og i hovedsak fritidsfartøy og får verdien «1». Raet nasjonalpark ender da opp med klassifisering «uregulert» og «ubeskyttet område». Det er ikke tatt med i evalueringen at det også er lov å jakte sjøpattedyr (sel) og sjøfugl i Raet nasjonalpark. I evalueringen ser vi også bort fra at det er lovlig med industriell tråling (basert på definisjonen til IUCN (2021)). Hvis dette skulle vært hensyntatt, ville nasjonalparken automatisk vært klassifisert som «ikke kompatibel med marint vern».
Tabell 2. Evaluering av Raet nasjonalpark gjennom reguleringsbasert klassifiseringsverktøy basert på Horta e Costa et al. (2016). Sone 1; Generell sone, sone 2; soner med forbud mot bunnslepende fiskeredskaper og sone 3; hummerfredningsområder. Tall indikerer at en type fiskeredskap/metode er lovlig og 0 at det ikke er lovlig. Grå kolonner med hvite tall indikerer fiskeredskap som er lovlig men som i praksis ikke brukes i Raet nasjonalpark per i dag. Påvirkning er hvor stor påvirkning det gitte fiskeredskapet har på økosystemet, der 9 er høyest påvirkning. Forenklet forklaring av ulike fiskeredskaper er gitt i appendix 3.
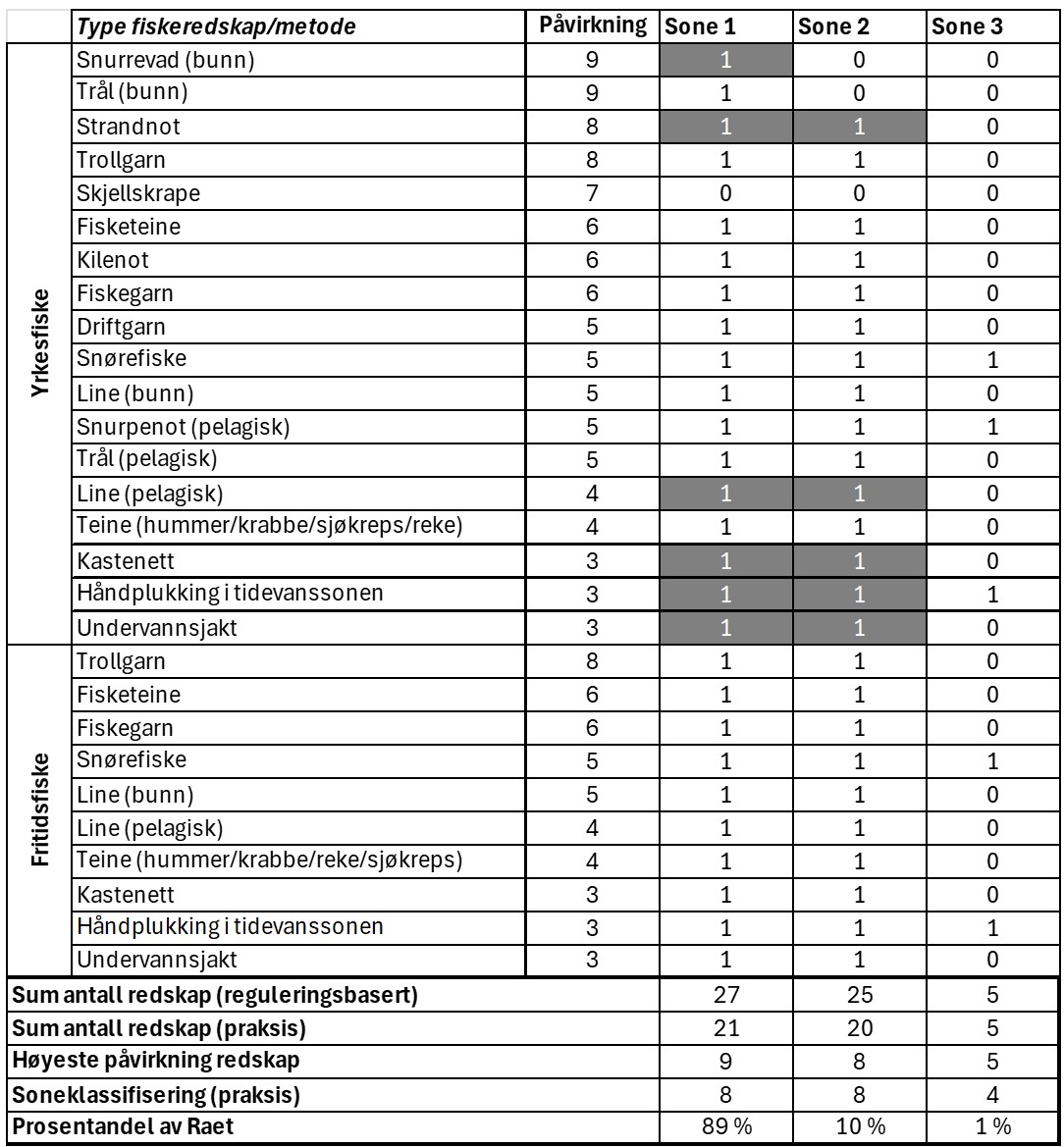
Som vist i tabell 2 er det en rekke fiskeredskap tillatt i Raet nasjonalpark. En gjennomgang med fiskere i arbeidsutvalget i «Bevar Raet»-prosjektet bidro til å identifisere 6 redskaper i yrkesfisket som i praksis ikke brukes (snurrevad, strandnot, pelagisk line, kastenett, håndplukking i tidevannssonen og undervannsjakt). De er derimot tillatt og det er dermed ikke utelukket at en fiskemetode vil bli brukt i fremtiden. Et eksempel er kommersiell håndplukking i tidevannssonen der det har tidligere vært initiativer for kommersiell høsting av strandsnegl i Norge. Det ble gjort en evaluering basert på denne informasjonen og er benevnt «praksis» i tabell 2. Fiskeredskapene utelatt i analysene er merket lyse grått.
Ved å utelukke fiskeredskaper som i praksis ikke benyttes i Raet nasjonalpark, er det tillatt med 21 fiskeredskaper i generelle soner (sone 1). Trål er fortsatt tillatt og høyeste verdi for belastning på økosystemet (9). Sonen får en klassifisering på «8» hvilket tilsvarer «uregulert uttak / unregulated extraction». Sone 1 utgjør rundt 90 % av Raet nasjonalpark. Områdene med forbud mot bunnslepende redskaper (sone 2) utgjør rundt 10 % av nasjonalparken. I denne sonen er det tillatt med 20 fiskeredskaper der trollgarn utgjør den største potensielle belastningen på økosystemet (8). Sonen får en klassifisering på «7» hvilket tilsvarer «veldig svakt regulert uttak / Very weakly regulated estraction». I fredningsområder for hummer (sone 3) er det tillatt med 5 fiskeredskaper, der pelagisk snurpenot utgjør den største potensielle belastningen på økosystemet (5). Sonen får en klassifisering på «4» hvilket tilsvarer «høyt regulert uttak / Highly regulated extraction» Hummerfredningsområder utgjør rundt 1 % av Raet nasjonalpark. Basert på de ulike sonenes klassifisering og areal får Raet nasjonalpark en bevaringsklassifisering (MPA classification) på 7,9 (Ubeskyttet område / Unprotected area).
7.3.1 - Oppsummering av evaluering av Raet nasjonalpark
Evaluering både basert på MPA Guide (Grorud-Colvert et al., 2021) og reguleringsbasert klassifiseringsverktøy (Horta e Costa et al., 2016) viser at vernenivået i Raet nasjonalpark per i dag kan klassifiseres som «ubeskyttet», og det bør ikke forventes positive effekter på alders- og størrelsessammensetning, biomasse, biologisk mangfold samt robusthet mot klimaendringer. Raet nasjonalpark er derfor mest sannsynlig ikke regulert slik at det kan fungere etter hensikten med å bevare plantelivet, dyrelivet og naturtyper.
7.4 - Tilnærming til effektiv bevaring av naturmangfoldet i Raet nasjonalpark
Ved å benytte klassifiseringsverktøyet fra (Horta e Costa et al., 2016) er det mulig å eksperimentere med ulike soneringsalternativer for å oppnå ulike grader av beskyttelse. Det er behov for at det settes et ambisjonsnivå for Raet Nasjonalpark, der alternativene er (se utfyllende definisjoner i MPA guide):
1. Fullt beskyttet (fully protected)
I fullt beskyttede områder er ingen ekstraktive eller destruktive aktiviteter tillatt. Ikke-ekstraktiv turisme og kulturell aktivitet med lav påvirkning kan være tillatt. Aktiviteter slik som akvakultur er kun tillatt for restaurering og ikke høsting.
2. Høyt beskyttet (highly protected)
I høyt beskyttede områder er det kun lettere høstingsaktviteter med lav påvirkning som kan tillates. Noen områder har tillatt selvbergings- eller små-skala fiske med minimal påvirkning (opptil fem fiskeredskaper med lav påvirkning, slik som snøre og sanking). Tillatte aktiviteter kan være turisme med lav påvirkning og lav tetthet, samt. akvakultur uten mating/foring.
3. Lett beskyttet (lightly protected) / moderat beskyttet (moderately protected)
I lett beskyttede områder er det noe beskyttelse av naturmangfoldet, men moderat til betydelig uttak og andre påvirkninger er lov. Et større antall fiskeredskaper (10 eller færre) eller fiske foregår med mindre selektive redskaper (for eksempel garn).
4. Minimalt beskyttet (minimally protected) / svakt beskyttet (weakly protected)
Omfattende uttak og andre påvirkninger er lov, men området bidrar med noe bevaring av naturmangfold. For eksempel, området kan ikke tillate industrielt fiske. Det er verdt å merke at minimalt beskyttede områder har liten sannsynlighet for å levere betydelig bevaring av naturmangfold for natur og mennesker.
Raet nasjonalpark er i dag utenfor disse kategoriene. Hovedårsaken til dette er at det foregår industrielt fiske med bunnslepende redskaper (trål) og at det er tillatt med mange ulike fiskeredskaper. Trål er det fiskeredskapet som har størst påvirkning på økosystemet. Områdene i Raet nasjonalpark der det er forbud mot bunnslepende redskaper kan karakteriseres som «svakt beskyttet» (Horta e Costa et al., 2016). Områder som er svakt beskyttet har liten grad av sannsynlighet for å bidra til ivaretakelse av arter, habitater eller samfunnet. Det er sannsynlig at aktivitetene i disse områdene vil resultere i fortsatt nedgang av arter og habitater, endrede funksjoner og lavere motstandsdyktighet i økosystemet.
Fredningsområdene for hummer i Raet nasjonalpark kan defineres som «høyt beskyttet». Her er det noe beskyttelse av naturmangfoldet, men ekstraktive og destruktive aktiviteter foregår og kan ha moderat til signifikant effekt.
I flere større marine verneområder globalt opereres det med soneinndeling. Dette innebærer at det marine verneområdet deles opp i ulike soner med ulike grader av beskyttelse/reguleringer, som kan strekke seg fra svakt beskyttet til fullt beskyttet. Raet nasjonalpark har allerede flere ulike soner (hummerfredningsområder, områder med forbud mot bunnslepende redskaper og områder uten spesifikke fiskerireguleringer). Det er nærliggende at en utvidet sonering kan være en god løsning for Raet nasjonalpark for å balansere bevaring og bruk. Men dette kan innebære at man vurderer ulike soneringskategorier utenom de som også eksiterer i dag, slik som null-fiskeområder. Summen av soneringen kan evalueres for å se om hele Raet nasjonalpark oppnår den beskyttelsesgraden man har satt som ambisjonsmål.
7.4.1 - Ulike scenarier for sonering i Raet nasjonalpark
Basert på ulike ambisjonsnivå og innspill fra styringsgruppen og arbeidsgruppen i «Bevar Raet»-prosjektet blir det her lagt frem ulike alternative soner som potensielt kan benyttes i Raet nasjonalpark. Vi har her laget noen hypotetiske soner og klassifisert de innenfor ulike soneringsklasser (fra 1 til 8). Det er verdt å merke at av praktiske årsaker bør det være et mål å ha færrest mulig ulike typer soner i Raet nasjonalpark. Det er derfor urealistisk at alle sonene nevnt nedenfor vil kunne være representert i en fremtidig sonering av nasjonalparken.
Sone 1: Null-fiskeområde Ingen fiskeredskap tillatt. Ingen akvakultur eller havbunnsressursutnyttelse. Noe ankring og båtbruk (hovedsak fritid). Soneringklasse: 2 (no-take/regulated access)
Sone 2: Hummerfredningsområde Tilnærmet samme regulering som dagens fredningsområder for hummer. Forbud mot snurpenot og undervannsjakt (høsting med dykkerutstyr samt fridykking). Redskap tillatt: - Kommersielt: Snørefiske, håndplukking i tidevannssonen - Fritidsfiske: Snørefiske, håndplukking i tidevannssonen Totalt antall redskap: 4 Maks redskapspoeng: 5 (snørefiske) Soneringklasse: 4 (highly regulated/høyt regulert)
Sone 3: Yrkesfiskersone Område satt av for å hindre brukskonflikt mellom yrkesfiske og fritidsfiske. Formål å tilrettelegge for et lokalt økonomisk kystfiske. Egen arbeidsgruppe for yrkesfiskere i samarbeid med forskning og forvaltning for å finne bruksløsninger og sikre bærekraft (etter modell av Lyme Bay). Mest skadelige redskap utelatt (for eksempel trål). Maks 10 redskapstyper. Totalt antall redskap: 8 Maks redskapspoeng : 6 (fiskegarn) Soneringsklasse: 5 (Moderately regulated extraction / moderat regulert uttak)
Sone 4: Generell sone. Redusere til 15 redskap eller mindre med redskapspåvirkning på 6 eller lavere. Kan brukes for de generelle «åpne» sonene i Raet nasjonalpark. Totalt antall redskap: 13 Maks redskapspoeng: 6 Soneringsklasse: 6 (Weakly regulated extraction / Svakt regulert uttak)
Sone 5: Hensynssone. Redusere redskap til 10 eller færre redskap med redskapspoeng på 6 eller lavere. Totalt antall redskap: 9 Maks redskapspoeng: 6 (garn) Soneringsklasse: 5 (Moderately regulated extraction / moderat regulert uttak)
Sone 6: Trålsone. Områder som er satt av til reketråling. Dette må grundig diskuteres og evalueres om dette kan inkluderes. Dette kan innebefatte elementer som maksstørrelse på båter og trål, nattestengning, skillerist, tiltak for å redusere påvirkning på bunn og total belastning (totalt antall tråltimer). I disse områdene (som vil være dypere enn 60 meter), bør det i hovedsak være forbud mot faststående redskap for å hindre brukskonflikter. Men også disse områdene bør inkluderes i en arbeidsgruppe som kan evaluere underveis. Det kan for eksempel være et mål å gå fra trål til mer bærekraftige redskaper over tid (e.g. reketrål til reketeiner). Dette må også vurderes opp mot definisjonen på industriell tråling som ikke er kompatibelt med marin bevaring. Totalt antall redskaper: 5 Maks redskapspoeng: 9 (trål) Soneringsklasse: 6 (Weakly regulated extraction / Svakt regulert uttak)
Sone 1-6 er eksempler på hvordan man kan designe soner. Det er derimot ikke formålstjenlig å ha så mange ulike soner i et såpass lite verneområde som Raet nasjonalpark. Derfor bør ulike soner diskuteres og de mest hensiktsmessige velges ut. Disse sonene kan så utgjøre en gitt andel hver. Hvilke fiskeredskap som bør tillates innenfor en gitt sone kan vurderes gjennom samråd med brukerinteresser og evaluering.
For å illustrere hvilke soneringstiltak som må til for å oppnå et gitt ambisjonsnivå på beskyttelsesgrad i Raet nasjonalpark, blir det her presentert ulike scenarier med ulike kombinasjoner av soner:
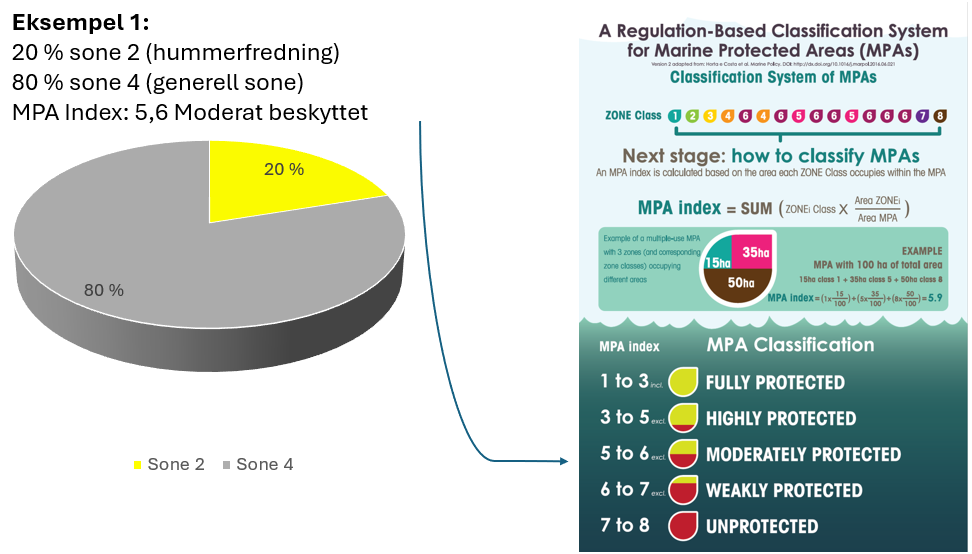
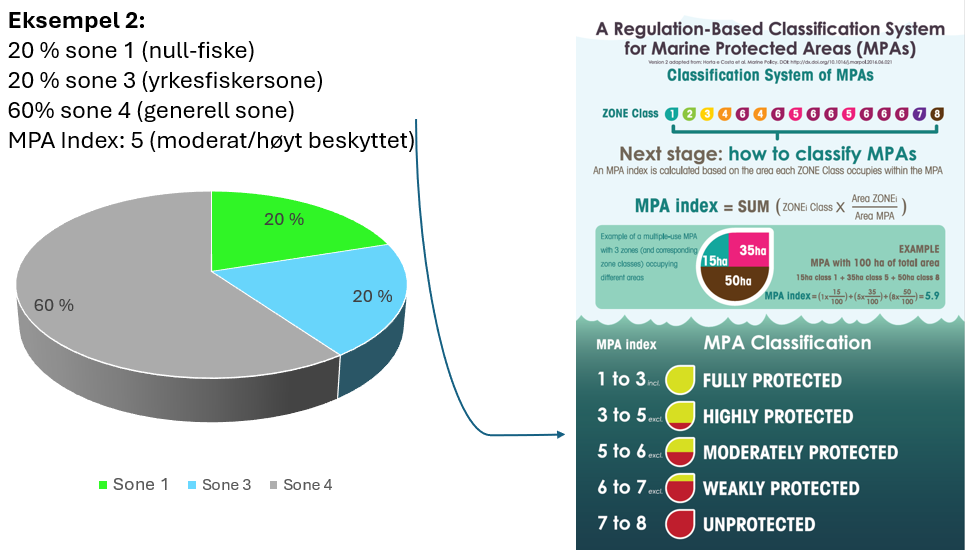
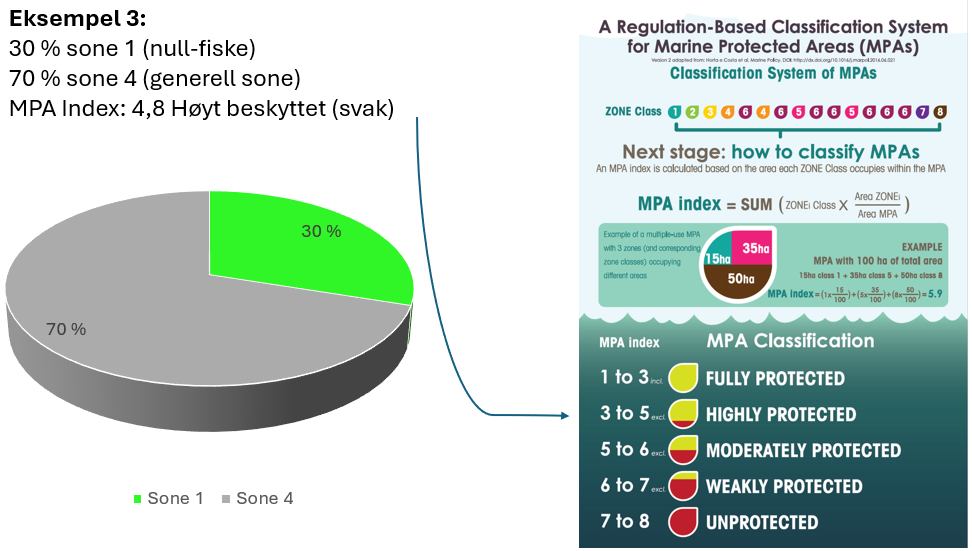
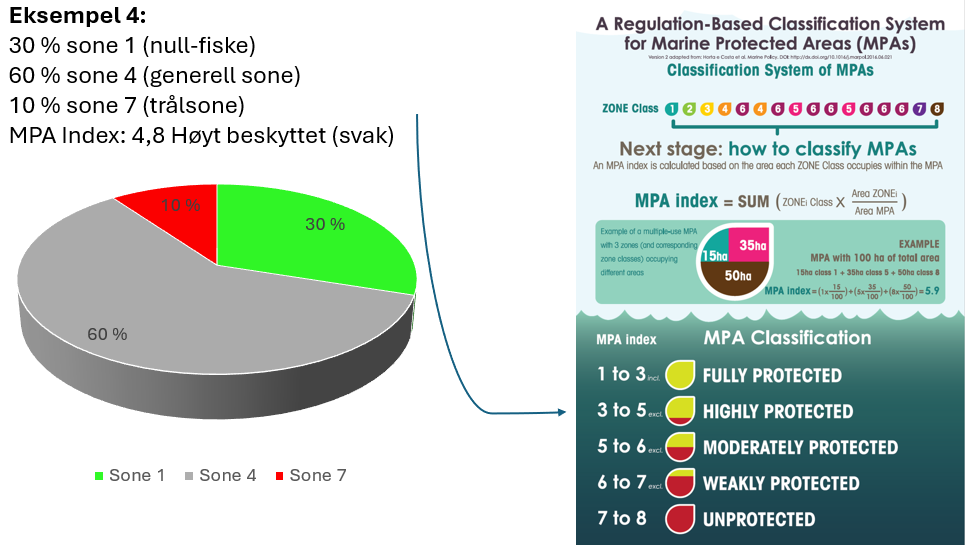
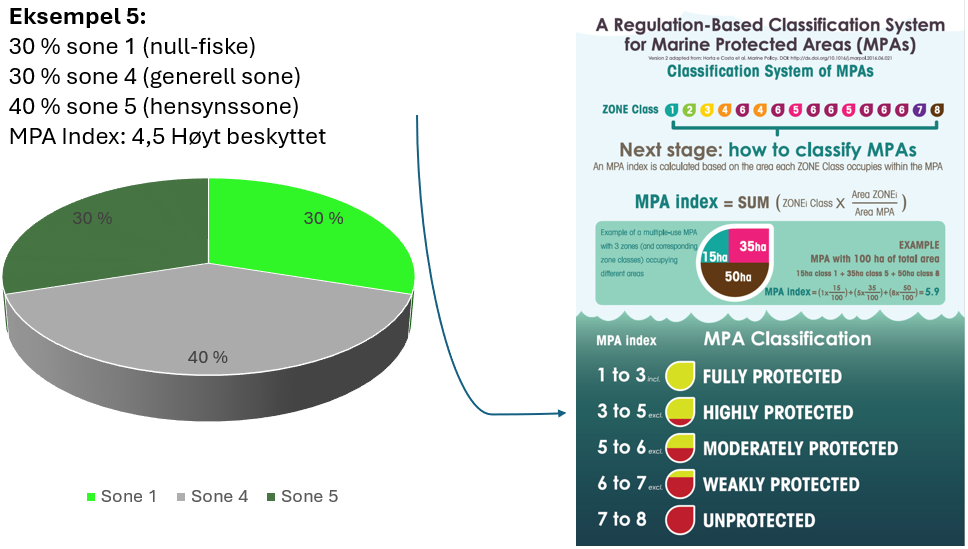
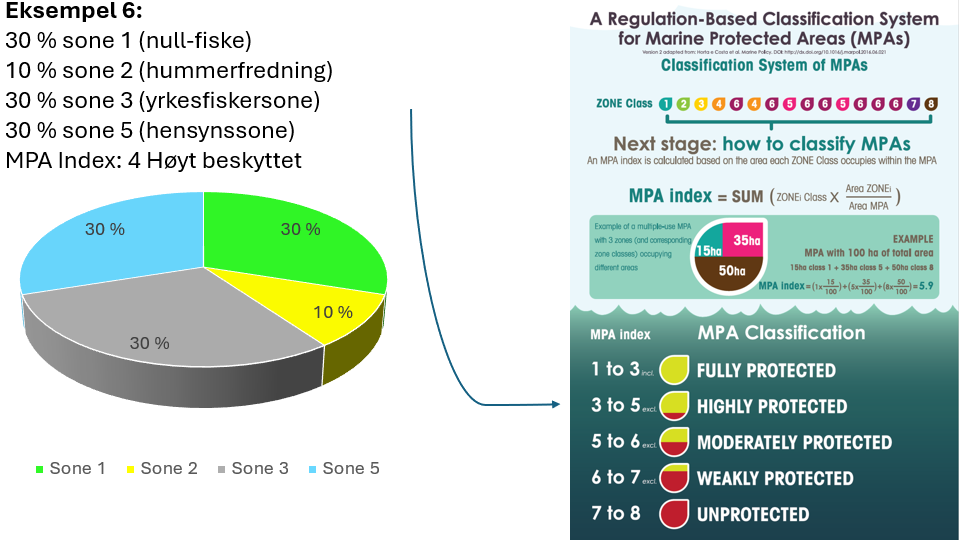
7.5 - Anbefalinger om videre prosess
Eksisterende reguleringer i Raet nasjonalpark er ikke tilstrekkelig for å kunne ivareta naturmangfold, økosystem og enkeltarter. Det bør derfor vurderes å dele Raet nasjonalpark i ulike soner og restriksjonsnivåer, inkludert null-fiskeområder. Det er viktig at sonene lokaliseres i områder som har bevaringseffekt og at representativitet hensyntas. For eksempel vil en større sone på dypet ytterst i Raet nasjonalpark/Transekt Skagerrak ikke kunne sikre bevaring av habitater som ålegressenger, tareskog, gyte- og oppvekstområder i grunnere områder i nasjonalparken.
Det er viktig å avklare hvilket ambisjonsnivå for bevaring prosjektet skal sikte mot. Når dette er gjort kan det jobbes videre med hvilke ulike typer soner som er hensiktsmessig for Raet nasjonalpark. Det vil da også kunne beregnes hvor stor andel hver sone bør utgjøre i areal for å oppnå ambisjonsnivået. Klassifiseringen gjennomgått over kan betraktes som en veileder. Det er også viktig å vurdere størrelsen på de enkelte sonene og hvordan de bør designes for best mulig økologisk effekt og konnektivitet.
Havforskningsinstituttet kan bidra med videre faglige råd om design. Dette bør vurderes som en egen rapport. Her vil artenes livhistoriestrategier og representativitet (habitat, dyp, etc.) bli vurdert. Videre vil det bli gitt råd om de ulike sonenes størrelse for å oppnå bevaringseffekter. En lignende rapport er blitt utarbeidet for Hitra og Frøya (Kleiven et al., 2021). I dette arbeidet var det utpekt fire målarter. I Bevar Raet-prosjektet er oppdraget å vurdere hele økosystemet. Men det er formålstjenlig å benytte tilgjengelige data og støtte seg på et utvalg arter og habitater det er god kunnskap om. Kunnskapshull kan blant annet hensyntas med å sikre representativitet både horisontalt (indre og ytre områder) og vertikalt (ulike dyp). I et slikt arbeid er det også naturlig at det utarbeides en forskningsplan for å evaluere effekter av fremtidige forvaltningstiltak.
Det anbefales at SeaSketch (https://www.seasketch.org/) benyttes for å identifisere potensielle soner i Raet nasjonalpark. Dette er et digitalt verktøy der ulike brukerinteresser kan delta aktivt med å tegne inn forslag til lokalisering av soner. SeaSketch er allerede benyttet i prosjektet for å kartlegge brukerinteresser i og rundt Raet nasjonalpark. Kart med ulike naturverdier og brukerinteresser integreres og kan gjøres klart for soneringsarbeid. Faglig råd kan integreres i kartverktøyet slik at soner direkte kan analyseres for å evaluere hvor godt de treffer på målene i prosjektet. Integrering av faglige råd i SeaSketch krever finansiering, men vil bidra til at soneringsprosessen legger til rette for høy grad av brukerinvolvering og åpne beslutningsprosesser.
7 - Pågående prosjekter ved Havforskningsinstituttet med tilknytning til Raet nasjonalpark
Det er pågående en rekke forskningsprosjekter i og rundt Raet nasjonalpark der Havforskningsinstituttet er involvert. Disse prosjektene kan både bidra til faglige råd for sonering og også som datagrunnlag for å evaluere effekter av fremtidig forvaltningstiltak.
MOVE – store rovfisk i Raet nasjonalpark
Finansiering: Biodiversa, prosjektleder: Esben Moland Olsen (HI)
Store rovfisk, slik som torsk og lyr, kan spille en viktig rolle i økosystemene langs kysten og har også en stor samfunnsverdi. Ved at de befinner seg nær toppen av næringsnettet kan de ha en kontrollerende effekt på mange andre arter, og på den måten påvirke hvordan hele økosystemet fungerer. Rovfiskene kan også bidra til å knytte sammen ulike komponenter av økosystemet ved at de beveger seg over større avstander og bringer med seg næringsstoffer. De kan da også påvirke karbonkretsløpet i havet, og potensielt bidra til at mer karbon bindes på havbunnen. Ofte kan det være store individuelle forskjeller knyttet til adferd og beitestrategier. Slike spesialiseringer er en del av det naturlige mangfoldet som danner grunnlaget for evolusjonære prosesser, og dermed hvordan bestandene kan tilpasse seg endringer i miljø over lengre tid. Å kartlegge slik storskala adferd, og hvordan den varierer mellom individer i en bestand, er krevende men mulig med dagens teknologi for merking og sporing av fisk. Dette er viktig, fordi etablerte forvaltningsregimer, og da spesielt marine bevaringsområder, trolig ikke er i stand til å beskytte slike arter og strategier på en effektiv måte. Per i dag er de fleste marine bevaringsområder i Europa små og ikke knyttet sammen i nettverk, spesielt hvis man fokuserer på de områdene som har fått et effektivt vern mot fiskerier (marine reservater). I prosjektet MOVE vil forskere og studenter jobbe sammen med forvaltere og brukere (inkludert fiskere) for å forstå hvordan store rovfisk bruker kystøkosystemene, og hva som skal til for å gi disse artene en effektiv beskyttelse slik at deres funksjon bevares. Vi sporer fiskens bevegelser ved hjelp av sendere og mottakere (telemetri) innenfor marine nasjonalparker i Norge, Spania og Portugal, deriblant Raet nasjonalpark. I Norge vil vi i første omgang merke torsk, lyr og havabbor. Et kart over hvor mottakerne er utplassert finnes her: https://www.lifewatch.be/etn/
Mer informasjon: https://www.biodiversa.eu/2023/04/19/move/
MARHAB - Topp-predatorers rolle i økosystemet/marine verneområder
Finansiering: EU Horizon, prosjektleder: Even Moland (HI)
Tapet av store rovfisk, og dermed også deres viktige rolle i å regulere økosystemet ovenfra, fører til det vi kaller en «trofisk kaskadeeffekt»; når rovfisken blir borte, forstyrres balansen i økosystemet og fører til en svekkelse av habitatet. Studier viser at tapet av store rovfisk har samme negative effekt som overgjødsling.
Effektene av overgjødsling og oksygenmangel i vannet har fått mye oppmerksomhet – og vært et fokusområde for forvaltningen i mange tiår. Fraværet av store rovfisk har ikke fått det samme fokuset.
Marine bevaringsområder (MPA-er) er effektive verktøy for bevaring av biologisk mangfold – de tilbyr både beskyttelse av habitatet, dyrene som lever der, og interaksjonene mellom dem. Fiskeriforvaltningen har verktøy for å sikre at et fiskeri er bærekraftig, men i fremtidens fiskeriforvaltning må fiskeriene ses i sammenheng med habitatene og interaksjonene dyrene imellom.
For å oppnå friske økosystemer må vi sikre en bred alders- og størrelsessammensetning hos artene vi høster – store og gamle individer må også beskyttes. Arter som er viktige for økosystemets funksjon må få plass til å trives og til å fylle sine viktige roller i økosystemet, uavhengig av hva som er gjeldende fiskeriforvaltning for de enkelte arter.
Mer informasjon: https://www.hi.no/hi/forskning/prosjekter/marhab-marine-habitater
Seabird-MPA: Interaksjoner mellom marint vern og sjøfugl i Raet nasjonalpark.
Finansiering: Equinor. Prosjektleder: Norith Eckbo (Universitetet i Sørøst-Norge)
Prosjektet studerer hvordan sjøfuglene bruker arealet i Raet nasjonalpark og omkringliggende områder, med hovedfokus på bevaringssonene i Tvedestrand. Sjøfugl blir merket med sendere for å få fin-skala bevegelse, det tas vevsprøver av sjøfugler og avkom og effekter av fiskesamfunn på ulik grad av vern blir analysert.
EuRockFish – Metoder for kartlegging av fiskesamfunn på hardbunnshabitater
Finansiering: Biodiversa+ pilot, Miljødirektoratet. Prosjektleder (nasjonalt): Alf Ring Kleiven (HI)
Prosjektet tester ut ulike metoder for å kartlegge fiskesamfunn på hardbunnshabitater med mål om å få standardiserte metoder i Europa. I Raet nasjonalpark skal det i løpet av 2024 samles inn data ved hjelp av miljø-DNA og agnede stereo-video rigger. Hovedfokus vil være kontraster opp mot ulike grad av bevaring der hummerfredningsområder blir undersøkt.
Aktiv forvaltning av marine ressurser – Tvedestrand
Finansiering: Havforskningsinstituttet (tidligere også Aust-Agder fylkeskommune og Tvedestrand kommune), prosjektleder: Alf Ring Kleiven (HI)
Prosjektet har foregått i Tvedestrand siden 2010. I 2012 ble rundt 15 % av sjøområdene i Tvedestrand sonert som bevaringsområder, inkludert 0-fiskeområde i Tvedestrandsfjorden, hummerfredningsområder og østersbevaring i Kvastadkilen. Prosjektet har hatt fokus på å følge opp effekter i disse sonene. Det har vært gjennomført et årlig fiske med ruser i Tvedestrandsfjorden og forskningsfiske etter hummer i Askerøya hummerfredningsområde (og noe i Tvedestrandsfjorden). Midlene i dette prosjektet er nå videreført inn i «Bevar Raet»-prosjektet.
Bevaringssonene i Tvedestrand har også generert en rekke andre forskningsaktiviteter, blant annet på akustisk telemetri i Tvedestrandsfjorden. Det er derfor en lengre tidsserie på bevegelse av fisk (blant annet torsk og sjøørret) i Tvedestrandsfjorden.
Plankton- og vannovervåkning
Systematiske og lange tidsserier med høy datakvalitet er en av våre viktigste kilder til kunnskap om variasjon, og et viktig verktøy for å kunne lage tilstandsvurderinger og dokumentere endringer over tid. Plankton og vannovervåkning innenfor området «Raet nasjonalpark» dekkes av tre ulike prosjekter:
ØKOKYST delprogram Skagerrak; Finansiering: Miljødirektoratet;
Langtidsovervåkning og forskning på kystmiljø og plankton ; Finansiering: NFD (Kystprogrammet)
Prosjektleder: Tone Falkenhaug Prosjektene overvåker økosystemer i kyst og fjordområder og skal avdekke hvordan disse påvirkes av tilførsler av næringssalter og organisk materiale, og langsiktige klimaendringer. Overvåkningen inkluderer månedlig prøvetaking av fysiske og kjemiske parametere, planteplankton og dyreplankton. Overvåkningen har pågått siden 1990-tallet har bidratt til lange tidsserier på plankton og miljøtilstand i de frie vannmasser ( Moy et al. 2002; Naustvoll et al. 2021; Lundsør et al. 2023).
Programmet Økokyst er sentralt i den nasjonale oppfølgningen av EU’s vannrammedirektiv og omfatter dessuten undersøkelser av biologiske forhold på hardbunn og bløtbunn.
Overvåkning av klima og plankton i Nordsjøen; Finansiering: NFD (Nordsjøprogrammet; Prosjektleder: Gayantonia Franze
Prosjektet overvåker fysiske og kjemiske parametere, planteplankton og dyreplankton i havområdet Nordsjøen – Skagerrak. Dette inkluderer månedlig prøvetaking langs snittet Torungen-Hirtshals, som krysser de dypeste området av Norskerenna, med seks faste stasjoner innenfor området «Transekt Skagerrak»:
En mer omfattende overvåkning av det pelagiske økosystemet i Norskerenna gjennomføres ved det årlige Økosystemtoktet i Nordsjøen, med prøvetaking av plankton og mikronekton (krill, reker etc).i hele vannsøylen ned til 600 m dyp , (Franzè et al., n.d.).
NORSE - Biodiversitet i nordeuropeiske ålegressenger – drivkrefter, respons og resiliens
NORSE (NFR 343517) er et prosjekt som skal kartlegge hvordan biodiversitet i ålegressenger påvirkes av menneskelig aktivitet og miljøfaktorer som temperatur og næringstilførsel, og hvordan ålegressamfunn med høy biodiversitet kan bidra til å styrke engenes motstandsdyktighet (resiliens).
Ålegressenger er kystnære økosystemer som bidrar med mange økosystemtjenester, og kjennetegnes gjerne av en stor artsrikhet. I Norge er den vanligste ålegressarten ålegras (Zostera marina). Ålegras finnes langs hele kysten, og vokser på grunne, beskyttede områder med sandbunn. Ålegresset, og alle artene som hører hjemme der, er truet av menneskelig aktivitet, hvor overfiske, eutrofiering og klimaendringer er noen av de største truslene. I dette prosjektet vil vi gjennom innsamling av data i felt undersøke hvordan biodiversiteten i de nordeuropeiske ålegressengene har forandret seg over tid, og i hvilken grad menneskelige påvirkninger og endringer i miljøet har bidratt til disse forandringene. Gjennom eksperimenter på tvers av fire ulike land (Norge, Sverige, Tyskland og Finland), vil prosjektet også undersøke hvordan ålegras responderer på ulike stressfaktorer (eksempelvis høyere temperatur, økt tilførsel av næringssalter og lavere saltholdighet). Ytterligere eksperimenter i Norge og Finland vil videre gi innsikt i hvordan høyere biodiversitet i ålegressenger kan styrke engenes motstandskraft mot fremtidige negative påvirkninger, så som økte temperaturer som følge av klimaendringene. Resultatene fra dette prosjektet vil hjelpe oss å bedre ivareta, beskytte og forstå ålegressenger og deres artsrike samfunn.
GecoKelp - Menneskelig påvirkning på tareskog: effekter av oppvarming og marine hetebølger fra gener til økosystem
Økende temperatur og marine hetebølger har blitt de mest utbredte og ødeleggende uttrykkene for klimaendringer i havene våre. Klimaendringer, sammen med forurensning, kystutvikling, tarehøsting og akvakultur, har ødelagt tareskoger rundt om i verden. GEcoKelp (NFR 335371) har som mål å forstå hvordan oppvarming og marine hetebølger, i kombinasjon med annen påvirkning forårsaket av mennesker, påvirker tareskoger i Norge, på skalaer fra gener til økosystemer. Prosjektet vil kombinere genetiske analyser av sukkertare og stortare fra hele norskekysten, med eksperimenter i felt og laboratorium, der tare vil bli utsatt for ulike typer klimarelatert påvirkning. Vi vil bruke resultater fra studiene i matematiske modeller for å forutsi hvordan tareskoger vil reagere på klimaendringer og menneskelige aktiviteter i fremtiden. Spesielt skal vi studere i hvilken grad tareskogene i Norge kan tilpasse seg forventede endringer i klima. Dette vil gi viktig informasjon om fremtidig risiko for disse artene og fremtiden for de fordelene de gir samfunnet. Denne informasjonen er kan gjøre det mulig å beskytte sårbare tareskoger, øke produksjonen av tarefarmer og gjenopprette tareskoger som allerede er gått tapt. Resultatene av dette prosjektet kan dermed bli kritiske for bevaring av tareskog og den raskt voksende taredykningsindustrien, i tillegg til å kunne bane vei for sunne produktive havøkosystemer. Prosjektet vil også bidra til viktig kunnskap for Norges internasjonale forpliktelser mot en bærekraftig havøkonomi og vitenskapsbaserte svar på klimaendringer.
Blå skog
Blå skog yter mange økosystemtjenester for livet langs kysten. Blant annet er de oppvekstområder for viktige kommersielle fiskearter, og høstes for å utvinne alginat. Samtidig er den blå skogen utsatt for press fra klimaendringer og stor menneskelig aktivitet i kystsonen. Havforskningsinstituttet skal i prosjekt 14914 gjennomføre forskning og overvåkning som grunnlag for vår rådgivning. Gjennom forskning skal vi finne årsakene til tap av blå skog for å sikre bærekraftig utnytting av ressursene, og utvikle metoder for å restaurere tapt blå skog
For å svare opp formålene i prosjektet skal vi fokusere på:
-
Overvåke utnyttelse av den blå skogens ressurser gjennom høsting og endringer som skjer på grunn av klimaendringer (og annen menneskeskapt påvirkning)
-
Forskning for å kvantifisere den blå skogens økosystemtjenester/ressurser og finne årsakene til endringer i utbredelse av blå skog (på grunn av menneskeskapt påvirkning)
-
Utvikle metoder for å restaurere blå skog i stor skala
I Blå skog-prosjektet har Havforskningsinstituttet blant annet drevet forskning på tap av sukkertareskog i Skagerrak i forbindelse med hetebølger (Filbee-Dexter et al. 2020), hvordan overfiske kan føre til kollaps i tareskogens økosystem (Norderhaug et al. 2020) og utviklet Grønn grus (Green gravel, Fredriksen et al. 2019), en innovativ metode for restaurering av tare på stor skala. Metoden har vakt internasjonal oppmerksomhet og testes per i dag av 20 forskningsgrupper på fire kontinenter gjennom Green gravel action group (Kelp Restoration | Green Gravel). Prosjektet er finansiert av Nærings- og fiskeridepartementet.
8 - Referanser
Aarefjord, H., Bjørge, A., Kinze, C. C., and Lindstedt, I. 1995. Diet of the harbour porpoise (Phocoena phocoena) in Scandinavian waters. Reports of the International Whaling Commission: 211–222.
Aarflot, J. H., Moy, F., Norderhaug, K. M., Berg, F., Kvamme, C., Søvik, G., Kleiven, A. R., Albretsen, J., & Freitas, C. B. , F. T. 2024. Pilotprosjekt for vurdering av samlet påvirkning i Oslofjorden – ytre del. Rapport fra Havforskningen 2024-15. Havforskningsinstituttet. https://www.hi.no/hi/nettrapporter/rapport-fra-havforskningen-2024-15.
Aksnes, D., Dupont, N., Staby, A., Fiksen, Ø., Kaartvedt, S., and Aure, J. 2009. Coastal water darkening and implications for mesopelagic regime shifts in Norwegian fjords. Marine Ecology Progress Series, 387: 39–49.
Alberdi, J. M. 2024. Passive acoustic monitoring of cetaceans in the Norwegian Skagerrak. Masteroppgave, Universitetet i Agder, pp. 60. https://uia.brage.unit.no/uia-xmlui/bitstream/handle/11250/3142561/no.uia:inspera:229862278:122821985.pdf?sequence=1
Aure, J., Danielssen, D. S., & Naustvoll, L. J. (2014). Miljøundersøkelser i norske fjorder: Ytre Oslofjord 1937-2011. Fisken og Havet, nr. 5/2014. Havforskningsinstituttet.
Aure, J., Magnusson, J. 2008. Mindre tilførsel av næringssalter til Skagerrak. Kyst og havbruk 2008. Havforskningsinstituttet. s 28-30.
Bakketeig, I. E., Hauge, M., and Kvamme, C. 2017. Havforskningsrapporten 2017. Fisken og Havet, særnummer 1-2017. Bergen.
Ballantine, B. 2014. Fifty years on: Lessons from marine reserves in New Zealand and principles for a worldwide network. Biological Conservation, 176: 297–307. Elsevier Ltd.
Ban, N. C., Davies, T. E., Aguilera, S. E., Brooks, C., Cox, M., Epstein, G., Evans, L. S., et al. 2017. Social and ecological effectiveness of large marine protected areas. Global Environmental Change, 43: 82–91. Elsevier Ltd.
Barceló, C., Ciannelli, L., Olsen, E. M., Johannessen, T., and Knutsen, H. 2016. Eight decades of sampling reveal a contemporary novel fish assemblage in coastal nursery habitats. Global Change Biology, 22: 1155–1167.
Barneche, D. R., White, C. R., and Marshall, D. J. 2018. Fish reproductive-energy output increases disproportionately with body size. Science, 645: 642–645.
Barrett, N., Edgar, G., Buxton, C., and Haddon, M. 2007. Changes in fish assemblages following 10 years of protection in Tasmanian marine protected areas. Journal of Experimental Marine Biology and Ecology, 345: 141–157.
Bellefleur, D., Lee, P., & Ronconi, R. A. 2009. The impact of recreational boat traffic on Marbled Murrelets ( Brachyramphus marmoratus ). Journal of Environmental Management, 90(1), 531-538.
Bergstad, O. A. 1990. Ecology of the fishes of the Norwegian deep: Distribution and species assemblages. Netherlands Journal of Sea Research, 25: 237–266.
Bergstad, O. A. 1991a. Distribution and trophic ecology of some gadoid fish of the Norwegian deep. 2. Food-Web linkages and comparisons of diets and distributions. SARSIA, 75: 315–325.
Bergstad, O. A. 1991b. Distribution and trophic ecology of some gadoid fish in the Norwegian deep. 1. Accounts of individual species. SARSIA, 75: 269–313.
Bergstad, O. A., Hansen, H. O., and Jorgensen, T. 2014. Intermittent recruitment and exploitation pulse underlying temporal variability in a demersal deep-water fish population. ICES Journal of Marine Science, 71: 2088–2100.
Bodvin, T., Rinde, E., og Mortensen, S. 2014. Faggrunnlag Stillehavsøsters (Crassostrea gigas). Rapport fra Havforskningen, Nr. 32-2014. Havforskningsinstituttet, Bergen. https://www.hi.no/resources/publikasjoner/rapport-fra-havforskningen/2014/nr_32-2014_sluttrapport_faggrunnlag_stillehavsosters.pdf
Botterell, Z. L. R., Lindeque, P. K., Thompson, R. C., and Beaumont, N. J. 2023. Intermittent recruitment and exploitation pulse underlying temporal variability in a demersal deep-water fish population. Ecosystem Services, 63.
Brondízio, E. S., Settele, J., Díaz, S., and Ngo, H. T. (eds). 2019. IPBES (2019), Global assessment report of the Intergovernmental Science-Policy Platform on Biodiversity and Ecosystem Services. 1–56 pp.
Buhl-Mortensen, L., Thangstad, T. H., Søvik, G., and Wehde, H. 2023. Sea pens and bamboo corals in Skagerrak and the Norwegian trench. Marine Biology Research, 19: 191–206.
Cardinale, M., Zimmermann, F., Søvik, G., Griffiths, C. A., Bergenius Nord, M., and Winker, H. 2023. Spatially explicit stock assessment uncovers sequential depletion of northern shrimp stock components in the North Sea. ICES Journal of Marine Science: 1868–1880.
Dahl, E., Bagøien, E., Edvardsen, B., og Stenseth, N. C. 2005. The dynamics of Chrysochromulina species in the Skagerrak in relation to environmental conditions. Journal of Sea Research, 54(1 SPEC. ISS.), 15–24. https://doi.org/10.1016/j.seares.2005.02.004
Dahl, E., Moy, F., Albretsen, J., Bodvin, T., Heiberg, S. E., Jelmert, A., Kleiven, A. R., et al. 2014. Marine naturforhold og naturverdier i Raet. Rapport fra havforskningen 8-2014. Havforskningsinstituttet. Pp. 49.
Davies, B.F.R., Holmes, L., Rees, A., Attrill, M. J., Cartwright, A. Y., & Sheehan, E. V. (2021). Ecosystem Approach to Fisheries Management works—How switching from mobile to static fishing gear improves populations of fished and non-fished species inside a marine-protected area. Journal of Applied Ecology , 58, 2463–2478. https://doi.org/10.1111/1365-2664.13986
Day, J., Dudley, N., Hockings, M., Holmes, G., Laffoley, D., Stolton, S., Wells, S., et al. 2019. Guidelines for applying the IUCN protected area management categories to marine protected areas. IUCN. Best practice protected area guidelines NO. 19. pp. 36 https://iucn.org/content/guidelines-applying-iucn-protected-area-management-categories-marine-protected-areas
Di Franco, A., Thiriet, P., Di Carlo, G., Dimitriadis, C., Francour, P., Gutiérrez, N. L., Jeudy De Grissac, A., et al. 2016. Five key attributes can increase marine protected areas performance for small-scale fisheries management. Scientific Reports, 6: 1–9.
Dias, M. P., Martin, R., Pearmain, E. J., Burfield, I. J., Small, C., Phillips, R. A., ... & Croxall, J. P. 2019. Threats to seabirds: a global assessment. Biological Conservation, 237, 525-537.
Dinasquet, J., Titelman, J., Møller, L. F., Setälä, O., Granhag, L., Andersen, T., Bamstedt, U., et al. 2012. Cascading effects of the ctenophore Mnemiopsis leidyi on the planktonic food web in a nutrient-limited estuarine system. Marine Ecology Progress Series, 460: 49–61.
Edgar, G. J., Stuart-Smith, R. D., Willis, T. J., Kininmonth, S., Baker, S. C., Banks, S., Barrett, N. S., et al. 2014. Global conservation outcomes depend on marine protected areas with five key features. Nature, 506: 216–220.
Eger, A. M., Marzinelli, E. M., Beas-Luna, R., Blain, C. O., Blamey, L. K., Byrnes, J. E. K., Carnell, P. E., et al. 2023. The value of ecosystem services in global marine kelp forests. Nature Communications, 14;1894.
Eigaard, O. R., Bastardie, F., Hintzen, N. T., Buhl-Mortensen, L., Buhl-Mortensen., P., Catarino, R., Dinesen, G. E. et al. 2017. The footprint of bottom trawling in European waters: distribution, intensity, and seabed integrity. ICES Journal of Marine Science, doi:10.1093/icesjms/fsw194
Eisaguirre, J.H., J.M. Eisaguirre, K. Davis, P.M. Carlson, S.D. Gaines, and J.E. Caselle. 2020. Trophic redundancy and predator size class structure drive differences in kelp forest ecosystem dynamics. Ecology 101:e02993. https://doi.org/10.1002/ecy.2993
Eldegard K, Holand Ø, Rolandsen CM og van der Kooij J. 2023. Mammalia: Vurdering av mink Neovison vison for Fastlands-Norge med havområder. Fremmedartslista 2023. Artsdatabanken. http://www.artsdatabanken.no/lister/fremmedartslista/2023/589
Elnes, J. O., Moan, A., Nilssen, K. T., Vøllestad, L. A., and Bjørge, A. 2023. Temporal and spatial distribution of harbor seal (Phoca vitulina) risk of entanglement in gillnets along the Norwegian coast. Aquatic Mammals, 49: 508–518.
Eriksen, E., van der Meeren, G., Nilsen, B. M., von Quillfeldt, C. H., Johnsen, H., and M.fl. 2023. Særlig verdifulle og sårbare områder ( SVO ) i norske havområder - Miljøverdi. Rapport fra havforskningen 26-2021. Havforskningsinstituttet. Pp. 308.
Eriksson, B. K., Bergström, U., Govers, L. L., and Eklöf, J. S. 2023. Trophic Cascades in Coastal Ecosystems. In: Treatise on Estaurine and Coastal Science (Second edition), eds. Baird, D and Elliott, M. p. 5-49.
Falkenhaug, T., Broms, C., Bagøien, E., and Nikolioudakis, N. 2022. Temporal Variability of Co-Occurring Calanus finmarchicus and C. helgolandicus in Skagerrak. Frontiers in Marine Science, 9: 1–17.
FAO. 2010. The state of world fisheries and aquaculture. 218 pp.
Fauchald, P., Anker-Nilssen, T., Barrett, R. T., Ove Bust-nes, J., Bårdsen, B.-J., Christensen-Dalsgaard, S., Descamps, S., et al. 2015. The status and trends of seabirds breeding in Norway and Svalbard. 84 pp.
Fenberg, P. B., Caselle, J. E., Claudet, J., Clemence, M., Gaines, S. D., Antonio García-Charton, J., Gonçalves, E. J., et al. 2012. The science of European marine reserves: Status, efficacy, and future needs. Marine Policy, 36: 1012–1021.
Fernandez, A., Edwards, J. F., Rodriguez, F., de los Monteros, A. E. Herraez, P., Castro, P., Jaber, J. R., Martin, V., et al. 2005. Gas and fat embolic syndrome” involving a mass stranding of beaked whales (family Ziphiidae) exposed to anthropogenic sonar signals. Veterinary Pathology, 42: 446–457.
Fernández-Chacón, A., Moland, E., Espeland, S. H., and Olsen, E. M. 2015. Demographic effects of full vs. partial protection from harvesting: Inference from an empirical before-after control-impact study on Atlantic cod. Journal of Applied Ecology, 52: 1206–1215.
Fernández-Chacón, A., Moland, E., Espeland, S. H., Kleiven, A. R., and Olsen, E. M. 2016. Causes of mortality in depleted populations of atlantic cod estimated from multi-event modelling of mark–recapture and recovery data. Canadian Journal of Fisheries and Aquatic Sciences, 74(1): 116-126.
Ferter, K., Otterå, H., Kleiven, A. R., and Vølstad, J. H. 2023. Integrating complementary survey methods to estimate catches in Norway’s complex marine recreational rod-and-line fishery. ICES Journal of Marine Science, 80(1): 107-121.
Filbee-Dexter K, Starko S, Pessarrodona A, Wood G, Norderhaug KM, Piñeiro-Corbeira C, Wernberg T. 2024. MPAs can be useful but are not a silver bullet for kelp conservation. Journal of Phycology. 60: 203–213 https://doi.org/10.1111/jpy.13446
Filbee-Dexter, K., Wernberg, T., Grace, S. P., Thormar, J., Fredriksen, S., Narvaez, C. N., Feehan, C. J., et al. 2020. Marine heatwaves and the collapse of marginal North Atlantic kelp forests. Scientific Reports, 10: 1–11. Nature Publishing Group UK.
Fiskeridirektoratet. 2017. Økosystembasert fiskeriforvaltning. https://www.fiskeridir.no/Yrkesfiske/Tema/OEkosystembasert-forvaltning.
Franzè, G., Falkenhaug, T., Hoffle, H., Lerch, S., Albretsen, J., Ershova, E., Heldal, H. E., et al. (2023). Cruise report from the North Sea Ecosystem Cruise 2023.
Fredriksen, S.K Filbee-Dexter, K. M. Norderhaug , H. Steen, T. Bodvin, M. A. Coleman, F. Moy, T. Wernberg. 2020. Green gravel: a novel restoration tool to combat kelp forests decline. Scientific Reports 10 doi10.1038/s41598-020-60553-x
Frigstad, H., Andersen, G. S., Trannum, H. C., McGovern, M., Naustvoll, L. J., Kaste, Ø., Deininger, A., et al. 2023. Three decades of change in the Skagerrak coastal ecosystem, shaped by eutrophication and coastal darkening. Estuarine, Coastal and Shelf Science, 283.
Gaines, S. D., White, C., Carr, M. H., and Palumbi, S. R. 2010. Designing marine reserve networks for both conservation and fisheries management. Proceedings of the National Academy of Sciences of the United States of America, 107: 18286–18293.
Gao, S., Hjøllo, S. S., Falkenhaug, T., Strand, E., Edwards, M., and Skogen, M. D. 2021. Overwintering distribution, inflow patterns and sustainability of Calanus finmarchicus in the North Sea. Progress in Oceanography, 194.
Giakoumi, S., Scianna, C., Plass-Johnson, J., Micheli, F., Grorud-Colvert, K., Thiriet, P., Claudet, J., et al. 2017. Ecological effects of full and partial protection in the crowded Mediterranean Sea: A regional meta-analysis. Scientific Reports, 7: 1–12.
Glemarec, G. 2016. Unintended Effects of No-Take Marine Protected Areas in Southern Norway on Populations of Edible Crab Cancer pagurus. DTU-Aqua. 68 pp.
Grorud-Colvert, K., Sullivan-Stack, J., Roberts, C., Constant, V., Horta E Costa, B., Pike, E. P., Kingston, N., et al. 2021. The MPA Guide: A framework to achieve global goals for the ocean. Science, 373.
Halvorsen, K. T., Larsen, T., Sørdalen, T. K., Vøllestad, L. A., Knutsen, H., and Olsen, E. M. 2017. Impact of harvesting cleaner fish for salmonid aquaculture assessed from replicated coastal marine protected areas. Marine Biology Research, 13: 359–369. Taylor & Francis.
Hammond, P. S., Lacey, C., Gilles, A., Viquerat, S., Börjesson, P., Herr, H., Macleod, K., et al. 2021. Estimates of cetacean abundance in European Atlantic waters in summer 2016 from the SCANS-III aerial and shipboard surveys.
Haugland, K., Søvik, G., Zimmermann, F., and Strand, H. S. 2023. Teinefiske err dypvannsreke (Pandalus borealis) i Norge. Kommersielle landinger og sammenligning av teinefiske i tre områder langs kysten. Rapport fra Havforskningen 2023-9. Havforskningsinstituttet. 81 pp. https://www.hi.no/hi/nettrapporter/rapport-fra-havforskningen-2023-9.
Heath, M. R., Boyle, P. R., Gislason, A., Gurney, W. S. C., Hay, S. J., Head, E. J. H., Holmes, S., et al. 2004. Comparative ecology of over-wintering Calanus finmarchicus in the northern North Atlantic, and implications for life-cycle patterns. ICES Journal of Marine Science, 61: 698–708.
Hixon, M. a, Johnson, D. W., and Sogard, S. M. 2014. Structure in Fishery Populations. ICES Journal of Marine Science, 71: 2171–2185.
Hjort, J., and Ruud, J. 1938. Rekefisket som naturhistorie og samfundssak. Fiskeridirektoratets skrifter. 1–158 pp. https://imr.brage.unit.no/imr-xmlui/handle/11250/114492
Hoel, A. H., Bakke, G., Jonassen, R. G., Kleiven, A. R., Løkkeborg, S., van der Meeren, G., and Nedreaas, K. 2023. Other Effective Area-Based Conservation Measures - OECMs: Andre effektive arealbaserte bevaringstiltak. Rapport fra Havforskningen 2023-45. Havforskningsinstituttet. 121 pp. https://www.hi.no/hi/nettrapporter/rapport-fra-havforskningen-2023-45
Homme, G.A., & Pfaff, A. (2021). Sjøfuglovervåking i Aust-Agder. Resultater fra perioden 2017-2019. Rapport nr. 1. Statsforvalteren i Agder og Statens naturoppsyn.
Horta e Costa, B., Claudet, J., Franco, G., Erzini, K., Caro, A., and Gonçalves, E. J. 2016a. A regulation-based classification system for Marine Protected Areas (MPAs). Marine Policy, 72: 192–198. Elsevier.
Horta e Costa, B., Claudet, J., Franco, G., Erzini, K., Caro, A., and Gonçalves, E. J. 2016b. A regulation-based classification system for Marine Protected Areas (MPAs). Marine Policy, 72: 192–198. Elsevier. http://dx.doi.org/10.1016/j.marpol.2016.06.021.
Hosia, A., and Falkenhaug, T. 2015. Invasive ctenophore Mnemiopsis leidyi in Norway. Marine Biodiversity Records, 8: 1–9.
Huserbråten, M. B. O., Moland, E., and Albretsen, J. 2018. Cod at drift in the North Sea. Progress in Oceanography, 167: 116–124. Elsevier.
Hyder, K., Weltersbach, M. S., Armstrong, M., Ferter, K., Townhill, B., Ahvonen, A., Arlinghaus, R., et al. 2018. Recreational sea fishing in Europe in a global context—Participation rates, fishing effort, expenditure, and implications for monitoring and assessment. Fish and Fisheries, 19: 225–243.
IPCC. 2023. Climate Change 2023: Synthesis Report. Contribution of Working Groups I, II and III to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change. Geneva, Switzerland. 184 pp.
IUCN. 1999. Threats to forest protected areas. Summary of a survey of 10 countries carried out in association with the World Commission on Protected Areas. 46 pp.
IUCN. 2021. Motion 066–Guidance to identify industrial fishing incompatible with protected areas. https://www.iucncongress2020.org/motion/066.
Johannessen, T., Dahl, E., Falkenhaug, T., and Naustvoll, L. J. 2012. After 2002, 69: 795–801.
Jørgensen, L. L., Moland, E., Husa, V., Kutti, T., Kleiven, A. R., and van der Meeren, G. 2021. Havforskningsinstituttets ekspertvurdering av utfordringer og status for arbeid med marint vern i Norge. 29 pp.
Kerlefsen, K. V. 2022. The life-saving effect of biodegradable cotton thread in lost fishing traps. University of Agder. 59 pp.
Kjøstvedt, J. H., & Fjærbu, R. J. 2014. Rapport om fuglelivet i Raet nasjonalpark, Grimstad, Arendal og Tvedestrand kommuner, Aust-Agder. NOF avd. Aust-Agder og Fylkesmannen i Aust-Agder
KLD. 2022. Vil innføre tiltak for å sikre bærekraftige hav. Dato: 27.06.2022. https://www.regjeringen.no/no/aktuelt/vil-innfore-tiltak-for-a-sikre-barekraftige-hav/id2921151/.
Kleiven, A. R., Olsen, E. M., and Vølstad, J. H. 2012. Total catch of a red-listed marine species is an order of magnitude higher than official data. PloS one, 7: e31216.
Kleiven, A. R., Fernandez-Chacon, A., Nordahl, J. H., Moland, E., Espeland, S. H., Knutsen, H., and Olsen, E. M. 2016. Harvest pressure on coastal atlantic cod (Gadus morhua) from recreational fishing relative to commercial fishing assessed from tag-recovery data. PLoS ONE, 11.
Kleiven, A. R., Lyle, J., Ferter, K., Espeland, S. H., Kleiven, P. N. K., Christensen, L., and Vølstad, J. H. 2019a. Hummerfisket 2017 og 2018: Innsats og fangst.
Kleiven, A. R., Thorbjørnsen, S. H., and Aslaksen, T. 2021. Tiltak mot spøkelsesfiske i Raet nasjonalpark. Bergen. 31 pp.
Kleiven, A. R., Espeland, S. H., Stiansen, S., Ono, K., Zimmermann, F., and Olsen, E. M. 2022. Technological creep masks continued decline in a lobster (Homarus gammarus) fishery over a century. Scientific Reports, 12: 1–10. Nature Publishing Group UK.
Kleiven, P. J. N., Espeland, S. H., Olsen, E. M., Abesamis, R. A., Moland, E., and Kleiven, A. R. 2019b. Fishing pressure impacts the abundance gradient of European lobsters across the borders of a newly established marine protected area. Proceedings of the Royal Society B: Biological Sciences, 286.
Klima- og Miljødepartementet. 2021. Helhetlig tiltaksplan for en ren og rik Oslofjord med et aktivt friluftsliv. 58 pp. https://www.regjeringen.no/no/dokumenter/helhetlig-tiltaksplan-for-en-ren-og-rik-oslofjord-med-et-aktivt-friluftsliv/id2842258/
Klima og Miljøverndepartementet. 2023. Det globale Kunming-Montreal-rammeverket for naturmangfold1. Norway.
Knutsen, H., Jorde, P. E., Gonzalez, E. B., Robalo, J., Albretsen, J., and Almada, V. 2013. Climate Change and Genetic Structure of Leading Edge and Rear End Populations in a Northwards Shifting Marine Fish Species, the Corkwing Wrasse (Symphodus melops). PLoS ONE, 8.
Knutsen, J. A., Kleiven, A. R., Olsen, E. M., Knutsen, H., Espeland, S. H., Sørdalen, T. K., Thorbjørnsen, S. H., et al. 2022. Lobster reserves as a management tool in coastal waters: Two decades of experience in Norway. Marine Policy, 136: 104908.
Krause-Jensen, D., and Duarte, C. M. 2016. Substantial role of macroalgae in marine carbon sequestration. Nature Geoscience, 9: 737–742.
Krumhansl, K. A., Okamoto, D. K., Rassweiler, A., Novak, M., Bolton, J. J., Cavanaugh, K. C., Connell, S. D., et al. 2016. Global patterns of kelp forest change over the past half-century. Proceedings of the National Academy of Sciences of the United States of America, 113: 13785–13790.
Kutke, A., and Strømø, E. 2022. Plastforurensning fra spøkelsesfiskeredskaper i Raet nasjonalpark. Universitetet i Agder.
Lester, S., and Halpern, B. 2008. Biological responses in marine no-take reserves versus partially protected areas. Marine Ecology Progress Series, 367: 49–56.
Lester, S., Halpern, B., Grorud-Colvert, K., Lubchenco, J., Ruttenberg, B., Gaines, S., Airamé, S., et al. 2009. Biological effects within no-take marine reserves: a global synthesis. Marine Ecology Progress Series, 384: 33–46.
Letessier, T. B., Mouillot, D., Mannocci, L., Jabour Christ, H., Elamin, E. M., Elamin, S. M., Friedlander, A. M., et al. 2024. Divergent responses of pelagic and benthic fish body-size structure to remoteness and protection from humans. Science (New York, N.Y.), 383: 976–982.
Loga, S. R. 2022. Impacts of ghost fishing on European lobster (Homarus gammarus) and brown crab (Cancer pagurus) in Raet national park, Norway. University of Agder. 60 pp.
Lundsør, E., Falkenhaug, T., Thormar, J., Moy, F., and Naustvoll, J. 2023. Økokyst-DP Skagerrak, Årsrapport 2023. Miljødirektoratet.
Løkkeborg, S., Bakkeplass, K., Diesing, M., Gjøsæter, H., Gonzalez-Mirelis, G., Hvingel, C., Jørgensen, L. L., Moland, E., Norderhaug, K. M., Rastrick, S. 2023. Effekter av bunntråling - Sammenstilling av kunnskap om bunnpåvirkning fra trål og snurrevad relevant for norske farvann. Rapport fra havforskningen 2023-01. Havforskningsinstituttet. https://www.hi.no/hi/nettrapporter/rapport-fra-havforskningen-2023-1
Melaa, K. W., Zimmermann, F., Søvik, G., and Thangstad, T. H. 2022. Historic landings of northern shrimp (Pandalus borealis) in Norway - Data per county for 1908-2021. Rapport fra havforskningen, 24.
Meld. St. 21. 2023-2024. Helhetlige forvaltningsplaner for de norske havområdene— Barentshavet og havområdene utenfor Lofoten, Norskehavet, og Nordsjøen og Skagerrak. Oslo. 176 pp. https://www.regjeringen.no/no/dokumenter/meld.-st.-21-20232024/id3032474/
Meld. St. 29. 2020-2021. Heilskapleg nasjonal plan for bevaring av viktige område for marin natur. Oslo. 63 pp. https://www.regjeringen.no/no/dokumenter/meld.-st.-29-20202021/id2843433/.
Melle, W., Runge, J., Head, E., Plourde, S., Castellani, C., Licandro, P., Pierson, J., et al. 2014. The North Atlantic Ocean as habitat for Calanus finmarchicus: Environmental factors and life history traits. Progress in Oceanography, 129: 244–284.
Mellin, C., Aaron Macneil, M., Cheal, A. J., Emslie, M. J., and Julian Caley, M. 2016. Marine protected areas increase resilience among coral reef communities. Ecology Letters, 19: 629–637.
Moan, A., Skern-Mauritzen, M., Vølstad, J. H., and Bjørge, A. 2020. Assessing the impact of fisheries-related mortality of harbour porpoise (Phocoena phocoena) caused by incidental bycatch in the dynamic Norwegian gillnet fisheries. ICES Journal of Marine Science, 77: 3039–3049.
Moland, E., Olsen, E. M., Knutsen, H., Garrigou, P., Espeland, S. H., Kleiven, A. R., André, C., et al. 2013a. Lobster and cod benefit from small-scale northern marine protected areas: Inference from an empirical before-after control-impact study. Proceedings of the Royal Society B: Biological Sciences, 280. https://doi.org/10.1098/rspb.2012.2679
Moland, E., Fernandez-Chacon, A., Sørdalen, T. K., Villegas-Rios, D., Thorbjørnsen, S. H., Halvorsen, K. T., Huserbråten, M., et al. 2021. Restoration of abundance and dynamics of coastal fish and lobster within northern marine protected areas across two decades. Frontiers in Marine Science, 8. https://doi.org/10.3389/fmars.2021.674756
Mortensen, S., Timenes, A., Åsa, L., Naustvoll, L.-J., Jelmert, A., Albretsen, J., Broström, G., Gustafsson, M., Durkin, A., Khogyane, S. E., og Partoft, H. (2022). Stillehavsøsters i Norden. Bestandsutvikling, overvåking og forvaltning. https://norden.diva-portal.org/smash/get/diva2:1642511/FULLTEXT01.pdf
Moy, F. E., and Christie, H. 2012. Large-scale shift from sugar kelp (Saccharina latissima) to ephemeral algae along the south and west coast of Norway. Marine Biology Research, 8: 309–321.
NAFO/ICES. 2022. Joint NAFO\ICES Pandalus Assesment Working Group (NIPAG). 1–25 pp.
Nilssen, J. T., Henden, J. A., and Biuw, M. 2023. Status for kystsel og anbefaling av jaktkvoter for 2024. Møte i sjøpattedyrutvalget, Tromsø, 7. november 2023.
Nilssen, K. T., and Bjørge, A. 2019. Status for Kystsel Anbefaling Av Jaktkvoter 2020. 12 pp.Møte i Sjøpattedyrutvalget, Tromsø, 24-25. Oktober 2019.
Norderhaug, K. M., Knutsen, H., Filbee-Dexter, K., Sodeland, M., Jorde, P. E., Wernberg, T., Oomen, R., & Moland, E. (2024). The International Union for Conservation of Nature Red List does not account for intraspecific diversity. ICES Journal of Marine Science , 81 (5), 815–822. https://doi.org/10.1093/icesjms/fsae039
Norderhaug, K. M., Nedreaas, K., Huserbråten, M., and Moland, E. 2021. Depletion of coastal predatory fish sub-stocks coincided with the largest sea urchin grazing event observed in the NE Atlantic. Ambio, 50: 163–173.
Numme, S. S. 2022. Ghost fishing in Raet National Park : estimating the impact on Atlantic cod and three species of wrasse. University of Agder. 53 pp.
Olin, A. B., Dück, L., Berglund, P. A., Karlsson, E., Bohm, M., Olsson, O., & Hentati-Sundberg, J. 2023. Breeding failures and reduced nest attendance in response to heat stress in a high-latitude seabird. Marine Ecology Progress Series.
Piatt, J. F., Sydeman, W. J., Sydeman, W. J., Piatt, J. F., & Browman, H. I. 2007. Seabirds as indicators of marine ecosystems. Marine Ecology Progress Series, Vol. 352, 199-204.
Olsen, E. M., Karlsen, Ø., & Skjaeraasen, J. E. (2023). Large females connect Atlantic cod spawning sites . https://www.science.org
Olsen, M. T., Galatius, A., and Härkönen, T. 2018. The history and effects of seal-fishery conflicts in Denmark. Marine Ecology Progress Series, 595: 233–243.
Paulsen, A. 2023. In deep water: Long-term trends in demersal fish diversity in Skagerrak and the Norwegian trench. University of Agder. 95 pp.
Peleg, O., C. Blain, and N.T. Shears. 2023. Long‐term marine protection enhances kelp forest ecosystem stability. Ecological Applications e2895. https://doi.org/10.1002/eap.2895
Rajpar, M. N., Ozdemir, I., Zakaria, M., Sheryar, S., & Rab, A. 2018. Seabirds as bioindicators of marine ecosystems. Seabirds, Pages 47-65. In: Seabirds, Ed: Mikkola, H. InTech. doi: 10.5772/intechopen.71804 Renn, C., Rees, S., Rees, A., Davies, B. F. R., Cartwright, A. Y., Fansha, S., Attrill, M. J., et al. 2024. Lessons from Lyme Bay (UK) to inform policy, management, and monitoring of Marine Protected Areas, ICES Journal of Marine Science, Volume 81, Issue 2, March 2024, Pages 276–292, https://doi.org/10.1093/icesjms/fsad204
Roberts, C. M., Bohnsack, J. A., Gell, F., Hawkins, J. P., and Goodridge, R. 2001. Effects of marine reserves on adjacent fisheries. Science, 294: 1920–1923.
Roberts, C. M., O’Leary, B. C., Mccauley, D. J., Cury, P. M., Duarte, C. M., Lubchenco, J., Pauly, D., et al. 2017. Marine reserves canmitigate and promote adaptation to climate change. Proceedings of the National Academy of Sciences of the United States of America, 114: 6167–6175.
Roessger, J., Claudet, J., and Horta, B. 2022. Turning the tide on protection illusions : The underprotected MPAs of the ‘ OSPAR Regional Sea Convention ’. Marine Policy, 142: 105109. Elsevier Ltd.
Rogers, A. D., Aburto-Oropeza, O., Appeltans, W., Assis, J., Ballance, L. T., Cury, P., Duarte, C., et al. 2020. Critical Habitats and Biodiversity: Inventory, Thresholds and Governance: Summary for Decision-makers. https://www.oceanpanel.org/blue-papers.
Ronconi, R. A., Lascelles, B. G., Langham, G. M., Reid, J. B., & Oro, D. 2012. The role of seabirds in Marine Protected Area identification, delineation, and monitoring: Introduction and synthesis. Biological Conservation, 156, 1-4.
Sala, E., and Giakoumi, S. 2018a. No-take marine reserves are the most effective protected areas in the ocean. ICES Journal of Marine Science, 75: 1166–1168.
Sala, E., and Giakoumi, S. 2018b. No-take marine reserves are the most effective protected areas in the ocean. ICES Journal of Marine Science, 75: 1166–1168.
Schwemmer, P., Mendel, B., Sonntag, N., Dierschke, V., & Garthe, S. 2011. Effects of ship traffic on seabirds in offshore waters: implications for marine conservation and spatial planning. Ecological Applications, 21(5), 1851-1860.
Skjoldal. 2004. Råd til utforming av marin verneplan for marine beskyttede områder i Norge. Endelig tilråding med forslag til referanseområder. 39 pp.
Skjoldal, H. R. 2003. Råd til utforming av marin verneplan for marine beskyttede områder i Norge. Foreløpig tilråding fra Rådgivende utvalg for marin verneplan.
Sodeland, M., Jentoft, S., Jorde, P. E., Mattingsdal, M., Albretsen, J., Kleiven, A. R., Synnes, A. E. W., et al. 2022. Stabilizing selection on Atlantic cod supergenes through a millennium of extensive exploitation. Proceedings of the National Academy of Sciences of the United States of America, 119.
Solberg, E. 2020. World view: Science can boost ocean health and human prosperity. Nature, 588.
Stavenow, J., Roos, A. M., Ågren, E. O., Kinze, C., Englund, W. F., og Neimanis, A. 2022. Sowerby’s Beaked Whales (Mesoplodon bidens) in the Skagerrak and Adjacent Waters: Historical Records and Recent Post-Mortem Findings. Oceans , 3 (3), 250–267. https://doi.org/10.3390/oceans3030018
Sørdalen, T. K., Halvorsen, K. T., and Olsen, E. M. 2022. Protection from fishing improves body growth of an exploited species. Proceedings of the Royal Society B: Biological Sciences, 289.
Sørlie, M., Nilssen, K. T., Bjørge, A., and Freitas, C. 2020. Diet composition and biomass consumption of harbour seals in Telemark and Aust-Agder, Norwegian Skagerrak. Marine Biology Research, 16: 299–310. Taylor & Francis.
Søvik, G., and Thangstad, T. H. 2021. Results of the Norwegian Bottom Trawl Survey for Northern Shrimp (Pandalus borealis) in Skagerrak and the Norwegian Deep (ICES Divisions 3.a and 4.a east) in 2021. 1–16 pp.
Steinberg, D. K., and Landry, M. R. 2017. Zooplankton and the Ocean Carbon Cycle. Annu. Rev. Mar. Sci., 9: 413–444.
Tandberg A.H.S, and Mortensen, P. 2021. Koralldyr: Vurdering av Isidella lofotensis for Norge. https://www.artsdatabanken.no/lister/rodlisteforarter/2021/6050.
Tandberg A.H.S, Djursvoll, P., Falkenhaug, T., Glenner, H., Meland, K., and Walseng, B. 2021. Krepsdyr: Vurdering av hummer Homarus gammarus for Norge. Rødlista for arter 2021.
Thorbjørnsen, S. H., Kleiven, A. R., Aslaksen, T., Jørgensen, T., Kerlefsen, K. V., Loga, S. R., and Numme, S. S. 2023. Tiltak mot spøkelsesfiske i marine nasjonalparker - Arbeidsrapport. 40 pp.
Turnbull, J. W., Johnston, E. L., and Clark, G. F. 2021. Evaluating the social and ecological effectiveness of partially protected marine areas. Conservation Biology, 35: 921–932.
Tveit, M. B. 2023. Fishing for Answers : A Historical Analysis of 150 Years of Fisheries landings in Skagerrak.
UNEP. 2023. Into the blue. Securing a sustainable future for kelp forests. Nairobi. 272 pp. https://www.unep.org/resources/report/blue-securing-sustainable-future-kelp-forests
van Meurs, E., Moland, E., Bjørge, A., and Freitas, C. 2024. Haulout Patterns of Harbour Seal Colonies in the Norwegian Skagerrak, as Monitored through Time-Lapse Camera Surveys. Diversity, 16 (1), 38. https://doi.org/10.3390/d16010038
Vannportalen. 2024. Agder vannregion. https://www.vannportalen.no/vannregioner/agder/.
Waycott, M., Duarte, C. M., Carruthers, T. J. B., Orth, R. J., Dennison, W. C., Olyarnik, S., Calladine, A., et al. 2009. Accelerating loss of seagrasses across the globe threatens coastal ecosystems. Proceedings of the National Academy of Sciences of the United States of America, 106: 12377–12381.
Weber, M. J. (2014). Effects of Boating Disturbance on Seabird Abundance and Flushing Behaviour in the San Juan Islands.
Zervoudaki, S., Nielsen, T. G., and Carstensen, J. 2009. Seasonal succession and composition of the zooplankton community along an eutrophication and salinity gradient exemplified by Danish waters. Journal of Plankton Research, 31: 1475–1492.
Yorio, P., Frere, E., Gandini, P., & Schiavini, A. 2001. Tourism and recreation at seabird breeding sites in Patagonia, Argentina: current concerns and future prospects. Bird Conservation International, 11(4), 231-245.
Zimmermann, F., Kleiven, A. R., Ottesen, M. V., and Søvik, G. 2022. Inclusion of recreational fishing in data-limited stocks: a case study on Norway lobster ( Nephrops norvegicus ) in Norway . Canadian Journal of Fisheries and Aquatic Sciences, 79: 969–978.
Appendix
Appendix 1. Kart over bunntråling i og rundt Raet nasjonalpark
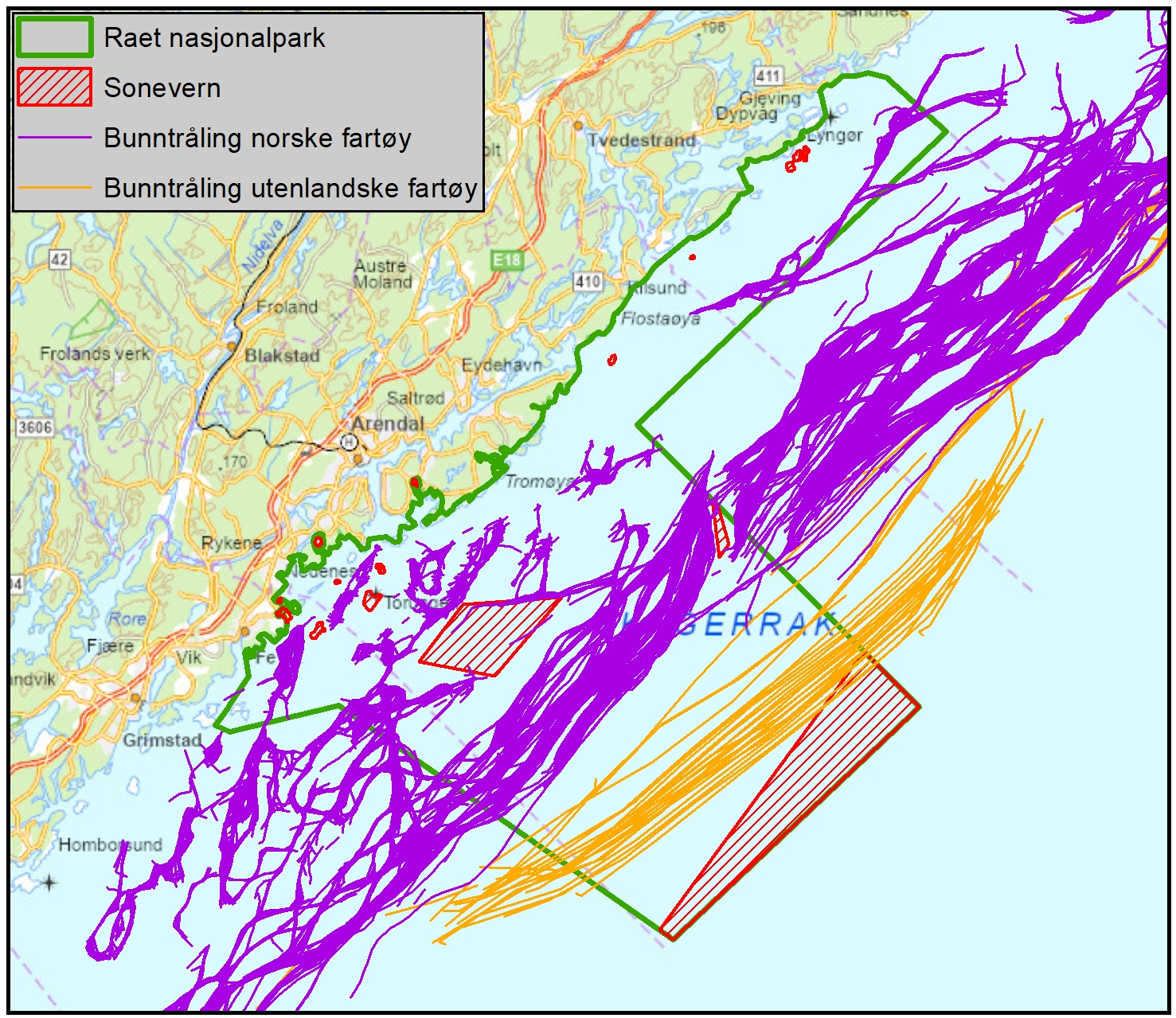
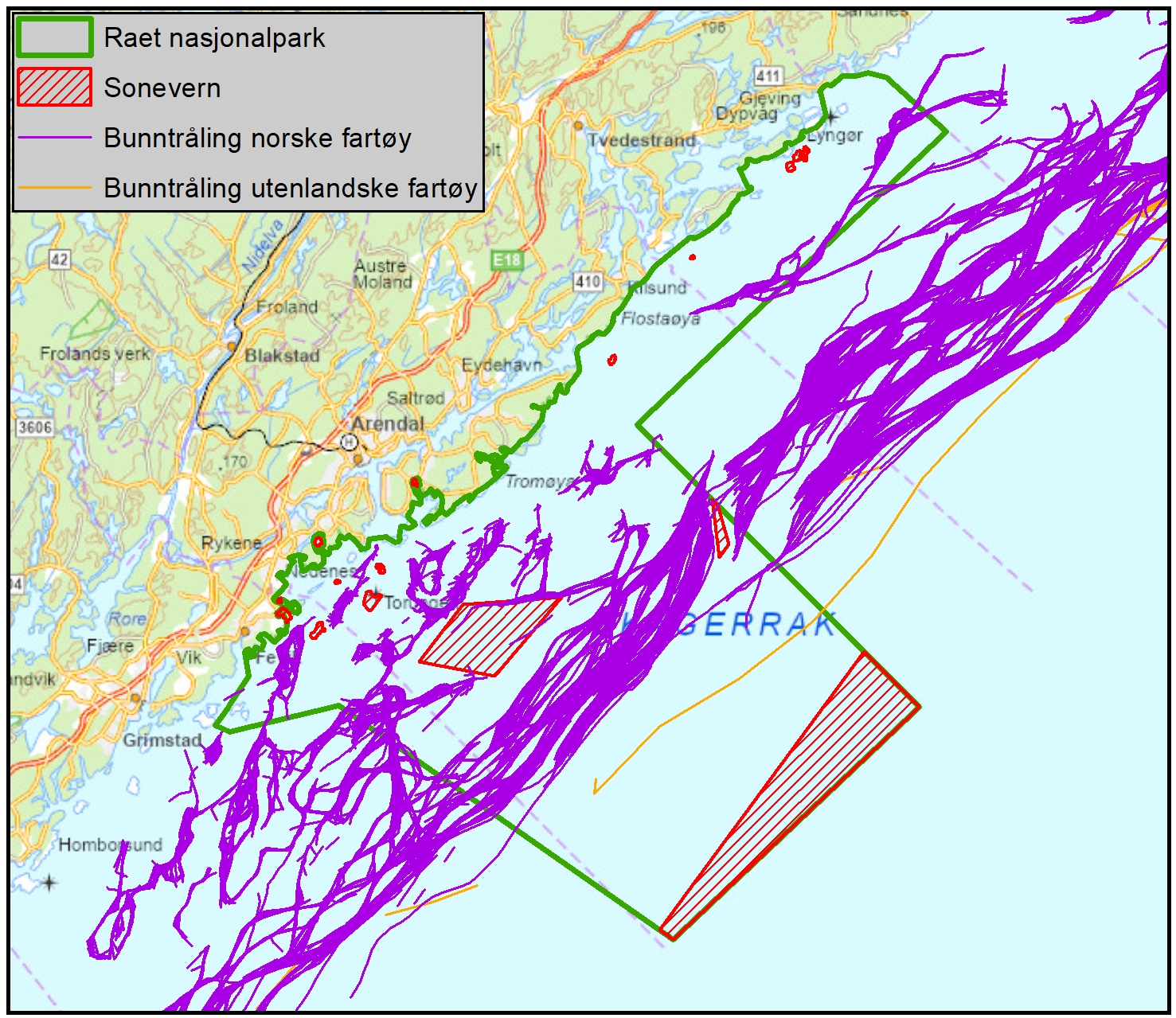
Appendix 2. Reguleringsbasert klassifiseringsverktøy basert på Horta de Costa et al. 2016.

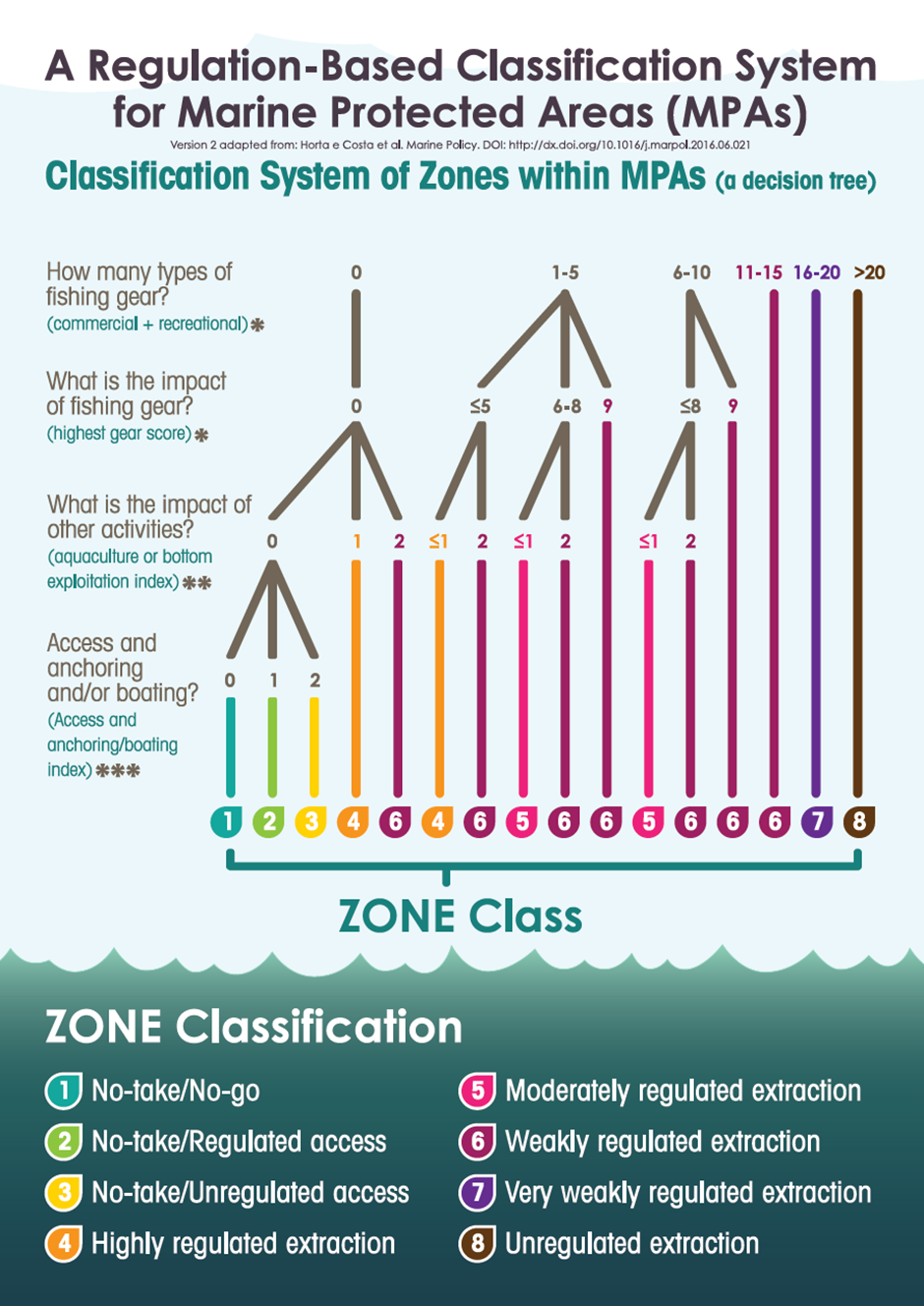

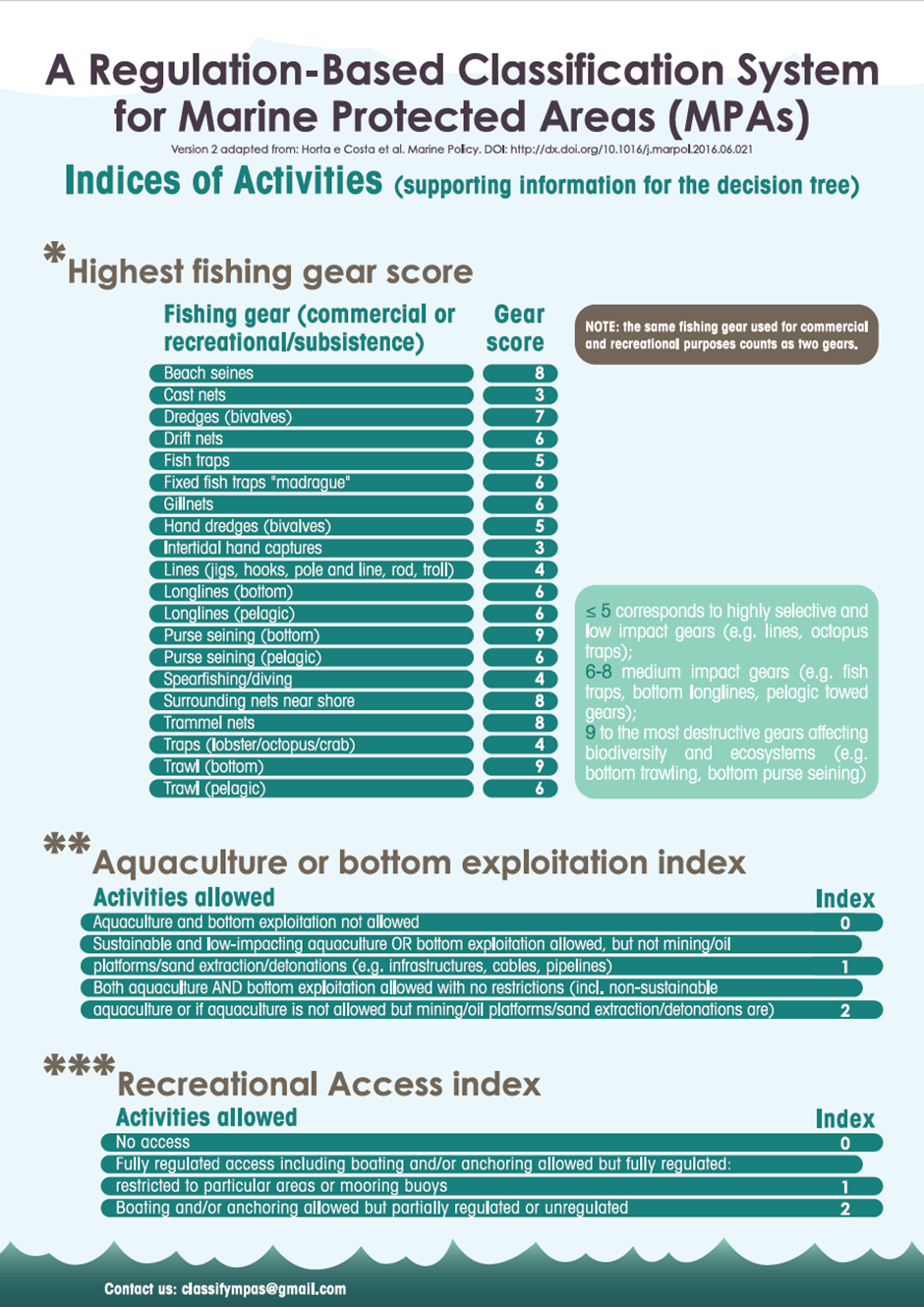
Appendix 3. Forklaringer fiskeredskap
Det brukes et mangfold av ulike fiskeredskaper langs norskekysten. Her presenteres en forenklet oversikt over fiskeredskaper nevnt i reguleringsbasert klassifisering av marine bevaringsområder. For mer detaljer om fiskeredskapet er det lagt inn lenker. Store Norske Leksikon har en samleside som forklarer ulike fiskeredskaper og prinsippene bak: https://snl.no/fiskeredskaper
Snurrevad: Bunnfiskende redskap som består av bunnslepenot med to vinger og pose i midten: https://snl.no/snurrevad
Trål (bunn): Fiskeredskap som slepes langs/over havbunnen. Fangsten ledes inn i en trålpose: https://snl.no/trål
Trål (pelagisk)/flytetrål: Trål som holdes på en bestemt dybde og ikke er i kontakt med bunnen: https://snl.no/flytetrål
Strandnot/landnot: Stort nett som bruker innsperringsprinsippet. Settes i en halvsirkel med endene på land og trekkes så inn mot land: https://no.wikipedia.org/wiki/Not_(fiskeredskap)
Trollgarn: Består av to forskjellige maskevidder i det samme garnet (finmaske i midten og grovere garn på hver side). Fanger dermed fisk i ulike størrelser. Står langs bunnen. https://snl.no/trollgarn
Teine: Består av en rekke forskjellige teinetyper, men har til felles at de har en inngang der fisk og skalldyr lokkes inn, gjerne med agn. https://snl.no/teine
Fisketeine/havteine: Teine (agnet) designet for å fange bunnfisk. Kan være designet på ulike måter.
Hummerteine: Agnet teine designet for å fange hummer. I Norge er det krav om at en hummerteine har 60 mm fluktåpning for at hummer under minstemål kan slippe ut.
Krabbeteine: Agnet teine designet for å fange taskekrabber. I Norge er det krav om at en krabbeteine for fritidsfiskere skal ha 80 mm fluktåpning
Krepseteine: Agnet teine designet for å fange sjøkreps.
Leppefiskteine: Agnet teine designet for å fange leppefisk.
Reketeine: Agnet teine designet for å fange reker.
Kilenot: Stor fastmontert not som er designet for å fange laks, der fisken blir ledet inn i en not. https://snl.no/kilenot
Fiskegarn: Finnes mange ulike typer garn, som baserer seg på at fisken setter seg fast i garnmaskene. https://snl.no/fiskegarn
Driftgarn: Garn som holdes flytende i overflaten eller varierende dybder. Holdes oppe av flytemidler på overflaten. Brukes til å fiske pelagiske arter: https://snl.no/drivgarn
Snørefiske: Fiske med fiskesnøre med krok i enden. Snøret kan holdes med fiskestang, sveiv (jukse) eller direkte i hånden. En eller flere kroker i enden som enten gjerne har agn, sluk eller flue.
Line: Består av et langt snøre der det er festet en rekke kroker. Kan variere betydelig i lengde og antall kroker. Krokene er gjerne agnet. Linen står ut med overflateblåse en gitt tid før den trekkes. Bunnline ligger langs bunnen og fiske bunnfisk, mens pelagisk line/fløyteline har oppdrift til å holde seg på et visst dyp: https://snl.no/line
Snurpenot: Stort nett som settes rundt fiskestim og snurpes sammen slik at fisken blir fanget. Brukes i hovedsak på pelagisk fisk: https://snl.no/snurpenot
Kastenett: Mindre, rundt nett som kastes for hånd og snurpes sammen. Kan brukes til å fange mindre stimfisk fra land.
Håndplukking i tidevannssonen: Sanking og fangst for hånd i grunne områder slik som snegler, skjell og makroalger.
Undervannsjakt: Jakt med hender, hawaiislynge, harpun, kniv og lignende under vann. Gjerne ved bruk av snorkleutstyr eller SCUBA/apparatdykking.