The extensive global transfer of rainbow trout ( Onchorhynchus mykiss) has listed it among the 100 worst invading species in the World by the IUCN. It is also listed on the Norwegian Blacklist for introduced species where it is considered as a high-risk species. On this background, the Norwegian Directorate for Fisheries and the Norwegian Environmental Agency requested an updated knowledge assessment. The annual Norwegian production of rainbow trout has varied between 50 000 and almost 90 000 tons over the past 10 years, while the smolt production has varied between 17 and 22 million individuals. The main production occurs in Vestland and Møre and Romsdalen counties. The annual reported number of escapees varies from less than 10 000 to over 300 000 individuals. Research shows that rainbow trout escaping from fish farms can compete with local anadromous species for food resources in fresh water and in the sea and dig up the spawning redds of Atlantic salmon ( Salmo salar ) and brown trout ( Salmo trutta ). It can also be a source for transfer of pathogens and parasites as for example Gyrodactylus salaris, which is a treat to Atlantic salmon. Experimental studies indicate that in competition with rainbow trout, juvenile Atlantic salmon are left with marginal habitats, resulting in reduced growth rate.Until 1996, 6 localities with self-recruiting populations were known in Norway, while 2-3 more have been identified in more recent years. New research using e-DNA will probably give a more complete picture of the distribution of rainbow trout in Norwegian rivers in the near future. The reason why rainbow trout apparently fail to establish self-recruiting populations in Norway and the rest of Europa, is not known. If reduced fitness because of a long domestication process can explain the low ability to establish new populations, import of new genetic material from either farms strains or wild populations, may cause higher risk for self-recruiting populations. If natural pathogens or parasites in native species prohibit establishment of new rainbow trout populations, it is imperative to maintain healthy populations of native species. There are some indications that rainbow trout has a higher tolerance than Atlantic salmon for environmental stress and changes through anthropogenic mechanisms. In that case, changes in water regime, temperature or other natural and anthropogenic factors may change competitive relations between native species and rainbow trout, thus imposing a higher risk for successful establishment of self-recruiting populations of rainbow trout.
Regnbueørret (Onchorhynchus mykiss); produksjon og interaksjoner med stedegne arter
Rapportserie:
Rapport fra havforskningen 2020-21
ISSN: 1893-4536
Publisert: 30.06.2020
Oppdatert: 23.11.2025
Oppdragsgiver(e): Fiskeridirektoratet, Miljødirektoratet
Forskningsgruppe(r):
Populasjonsgenetikk
Tema:
Rømt oppdrettslaks og genetisk påvirkning
Program:
Miljøeffekter av akvakultur
Godkjent av:
Forskningsdirektør(er):
Geir Lasse Taranger
Programleder(e):
Terje Svåsand
English summary
Sammendrag
Den globale spredningen av regnbueørret (Onchorhynchus mykiss) har ført den inn på listen over de 100 verste invaderende arter i verden, utarbeidet av den internasjonale naturvernorganisasjonen IUCN. Den er også oppført på Fremmedartslista i Artsdatabanken, hvor den kategoriseres som en høyrisiko art. På denne bakgrunnen har Fiskeridirektoratet og Miljødirektoratet bestilt en oppdatert gjennomgang av kunnskapsstatus. Den norske produksjonen har de siste ti årene variert mellom vel 50 000 og nesten 90 000 tonn, mens smoltproduksjonen i samme periode har variert mellom 17 og 22 millioner individ. Hovedmengden produseres i Hordaland, Sogn og Fjordane, Møre og Romsdal og Nordland. Årlig antall rapporterte rømte regnbueørret har variert fra under 10 000 til over 300 000 individ. Rømt regnbueørret kan konkurrere med stedegne arter om næringstilbud i ferskvann, og dessuten grave opp og skade gytegroper for laks (Salmo salar) og ørret (Salmo trutta). Regnbueørret kan også være kilde til overføring av patogener og parasitter som for eksempel Gyrodactylus salaris som er en trussel for Atlantisk laks. Undersøkelser viser at regnbueørret som rømmer fra oppdrettsanlegg kan overleve og tilpasse seg tilgjengelige byttedyr i elv og sjø som andre anadrome fisk beiter på. Eksperimentelle studier har vist at i konkurranse med regnbueørret kan laksen bli fortrengt til marginale habitat og derved få redusert tilvekst. Frem til 1996 var det kjent 6 lokaliteter med selvrekrutterende bestander av regnbueørret i Norge, senere er det registrert 2-3 lokaliteter til med sannsynlig reproduksjon. Nye undersøkelser blant annet med miljø-DNA vil kunne gi et mer fullstendig bilde av forekomster av regnbueørret i norske vassdrag. Årsakene til at regnbueørret i liten grad etablerer naturlig reproduserende bestander i Norge og Europa ellers er ikke kjent. Dersom redusert fitness gjennom lang domestisering er årsak til manglende evne til etablering, vil import av nytt genmateriale fra andre avlslinjer evt også fra villfisk, kunne medføre større risiko for etablering. Dersom naturlig forekommende sykdomsorganismer hos stedegne laks og ørret er årsak, vil det være viktig å opprettholde bestander av de stedegne artene. Det er indikasjoner på at regnbueørret har høyere toleranse enn Atlantisk laks med hensyn på fluktuasjoner og forandringer i miljøet. I såfall vil endret flomregime, temperatur eller andre naturlige eller menneskeskapte forhold kunne forandre konkurranseforholdene mellom lokale arter og regnbueørret, og dermed medføre endret risiko for etablering.
1 - Bakgrunn
Den globale spredningen av regnbueørret har ført den inn på listen over de 100 verste invaderende arter i verden, utarbeidet av den internasjonale naturvernorganisasjonen IUCN (World’s Worst Invasive Alien Species, http://www.issg.org/database/species/ecology.asp). Den er også oppført på Fremmedartslista i Artsdatabanken (2018), og tidligere norsk svarteliste for innførte arter, hvor den kategoriseres som en høyrisiko art (Gederaas 2007). Grunnlaget for denne kategoriseringen er at regnbueørreten som invaderende art er vurdert å kunne ha negative effekter på naturlig biologisk mangfold (Gederaas 2007). En er bekymret for at rømt regnbueaure kan spre parasitter, bakterier og virus og at den kan begynne å reprodusere og dermed fortrenge stedegne arter.
På denne bakgrunnen har Fiskeridirektoratet og Miljødirektoratet bestilt en oppdatert gjennomgang av kunnskapsstatus. Rapporten bygger i stor grad på følgende rapporter: Anon 2011, Borgstrøm & Skaala 2008, Jensen m fl. 2013 og innspill fra forfatterpanelet.
Regnbueørret (Oncorhynchus mykiss) har vært oppdrettet i Europa siden 1890 tallet (Laird & Needham 1988), og den globale produksjonen har økt fra 4000 tonn i 1950 til 814000 tonn i 2013 (Singh mfl 2016). Den første kjente importen av regnbueørret til Norge skjedde i 1902 med egg fra Danmark (Huitfeldt-Kaas 1918). Noen år senere, i 1908, ble også en større mengde egg importert fra Danmark. Det har også senere vært importert regnbueørret fra Danmark, foruten levende fisk fra USA (MacCrimmon 1971; Bevanger 2005).
Formålet med importen har vært både matfiskoppdrett i jorddammer og utsettinger med formål sportsfiske. En større spørreundersøkelse gjennomført av Hindar mfl. (1996) illustrerer omfanget av forekomsten av regnbueørret, der 195 av 344 forespurte kommuner bekrefter forekomst av regnbueørret.
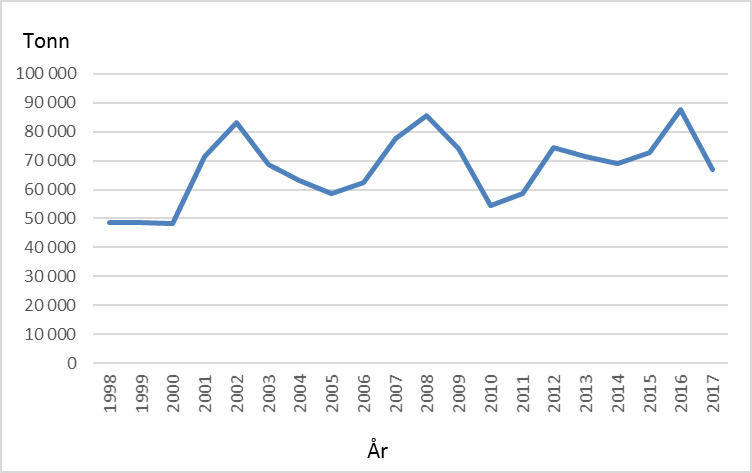
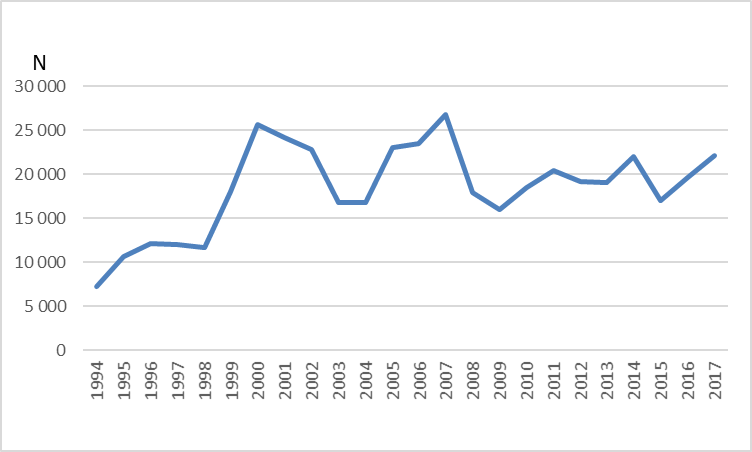
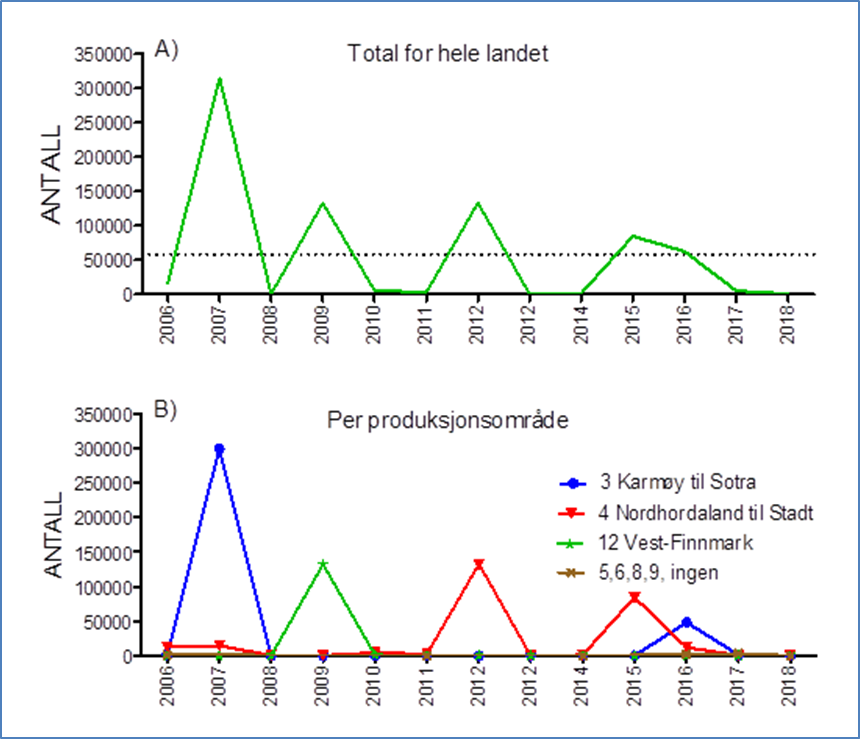
Selv om matfiskproduksjonen av regnbueørret i Norge kom i gang relativt tidlig, er det først fram mot midten av 1990 tallet at den samlete produksjonen passerte 10 000 tonn (Fig 1). Deretter økte produksjonen hurtig, hovedsakelig i sjøbaserte anlegg, til over 80 000 tonn rundt 2003, men har de siste ti årene variert mellom vel 50 000 og nesten 90 000 tonn (Fig. 1). Smoltproduksjonen har i samme perioden variert mellom 17 og 22 millioner individ (Fig 2). Hovedmengden produseres i Hordaland, Sogn og Fjordane, Møre og Romsdal og Nordland. Årlig antall rapporterte rømte regnbueørret har variert fra under10 000 til over 300 000 individ (Fig 3). Som for rømt oppdrettslaks, kan også rømt regnbueørret spores til utslippskilde ved hjelp av DNA-Beredskapsmetoden, med de begrensninger som ligger i metoden (Glover 2010). Nye søknader om importtillatelse av regnbueørret fra Danmark til ulike fiskeoppdrettere på Vestlandet og Trøndelag aktualiserer spørsmål knyttet til potensielle miljøkonflikter ved oppdrett av regnbueørret.
2 - Regnbueørretens biologi og livshistorievariasjon
Regnbueørret er en stillehavslaks med naturlig utbredelse langs kysten av Nord-Amerika og nordøstlige deler av Russland (Quinn 2005), hvor de danner både ferskvannsstasjonære (rainbow trout) og sjøvandrende bestander (steelhead) (Behnke 1992; Quinn 2005). Arten skiller seg fra Atlantisk laks ved at den hovedsakelig gyter om våren, men har ellers flere likheter med Atlantisk laks som at de sjøvandrende bestandene lever 1-3 år i ferskvann og 1-3 år på første sjøvandring. De har slik sett også en livshistorie som har mange fellestrekk med ørret ( Salmo trutta ) som lever i våre vassdrag som ferskvannstasjonære bestander eller som sjøvandrende (anadrome) bestander. Bestander av sjøvandrende regnbueørret kan ha ulik livshistorie ved at noen bestander vandrer opp i elven om sommer og høst («sommer» form) og andre som vandrer opp om vinteren («vinter» form). Sommervarianten vandrer gjerne lengre oppover i vassdraget, mens vintervarianten i større grad benytter nedre deler av vassdraget (Quinn 2005). Vandringsatferden i sjø kan variere mye, der noen bestander gjennomfører lange vandringer også ut i åpent hav som den Atlantiske laksen, mens andre bestander foretar korte sjøvandringer mer lik typiske vandringer i fjordområder hos vår egen sjøørret.
3 - Regnbueørret i naturen
Generelt er unger av regnbueørret, laks og ørret territoriehevdende i rennende vann, og lever av bunnlevende insekt og dyr fra land som driver med strømmen (Stolz & Schnell 1991; Hansen 2000), mens voksne regnbueørreter har en svært variert diett som kan omfatte alt fra større insekter, krepsdyr, mollusker, amfibier og fisk (Scott & Crossman 1973; Walker 2004). Regnbueørret er en tilpasningsdyktig generalist og konkurransesterk art som kan beite effektivt på en rekke byttedyr og slik sett potensielt kan ha negativ innvirkning på stedegne arters næringstilgang og habitatbruk (Elliot 1973; Tilzey 1976; Crowl mfl. 1992; Scade & Bonar 2005; Hasegawa & Mawkawa 2006; Baxter 2007). En introdusert predator vil ofte medføre forandret adferd hos byttefisk (Gilliam & Fraser 1987), og dermed forandret tilvekst og overlevelse hos byttefiskbestandene. Det finnes flere eksempler på at predasjon fra regnbueørret har desimert eller ført til fortrengning av stedegne fiskearter (Tilzey 1976; Crowl mfl. 1992; Behnke 2002; Fausch 2008).
Det finnes få studier av bytteseleksjon og diettvalg hos regnbueørret som har rømt fra oppdrettsanlegg. En undersøkelse i Norge viste at smolt utsatt ved alder 1+ og 2+ hadde god vekst (Jonsson mfl.1993 a, b). Enkelte individ returnerte også etter 3 år i sjøen, noe som tyder på at rømt regnbueørret kan overleve og tilpasse seg tilgjengelige marine byttedyr (Jonsson mfl. 1993 a, b). Regnbueørretens evne til å tilpasse seg naturlig føde i sjøen synes imidlertid å være avhengig av sjøalder ved rømming (Rikardsen & Sandring 2006). Fisk som rømte etter å ha stått mer enn ett år i merd i sjøen, forsøkte å beite på gjenstander som lignet pellets (tangblærer, småstein, kvistbiter) og tapte vekt og kondisjon gjennom undersøkelsesforløpet på 15 måneder. Regnbueørret som rømte som postsmolt tilpasset seg derimot raskt til naturlig føde. Etter bare en måned i sjøen, spiste de byttedyr som annen anadrom fisk i området beiter på, og økte da raskt i vekt.
Et forsøk med akustisk merket regnbueørret satt ut fra oppdrettsanlegg i Osterfjordbassenget i Nordhordland viste at fisken var relativt stasjonær og oppholdt seg lenge i fjorden, da 18 % av 50 individ utsatt i august 2008 fremdeles var i fjorden i januar 2009, mens en tredjedel hadde forlatt fjorden og en tredjedel var tatt i fisket (Skilbrei 2005; Skilbrei & Wennevik 2006). Under stormen Nina 10-11 januar 2015 rømte det om lag 69 000 regnbueaure i Sørfjorden rett nord for Bergen. Et storstilt gjenfangstfiske med garn utført av hobbyfiskere, yrkesfiskere og oppdrettere førte til at om lag 62 000 (ca 90 %) var gjenfanget i løpet av de ca to første månedene etter rømmingen (Barlaup m.fl. 2015;). Basert på gjenfangster hadde den rømte fisken en gjennomsnittlig størrelse på 2,6 kg (sd = 0,65, n=657), og 10,6 % av hannene og 1,6 % av hunnen var kjønnsmodne. Gjenfangstene var klart størst i nærområdet rundt anlegget hvor rømmingen fant sted. Dette gjenspeiler regnbueaurens tendens til å være lite vandringsvillig og relativt stedbunden etter rømming som beskrevet ovenfor. At rømmingen i dette tilfelle fant sted i januar med lav vanntemperatur og i brakkvann bidro trolig til at den rømte fisken i mindre grad spredte seg ut i de utenforliggende fjordene som hadde høyere salinitet. Mageinnholdet ble undersøkt en til to måneder etter rømmingen og det ble funnet at ca 25 % av den rømte fisken da hadde tatt til seg næring (pellets, krepsdyr, og en fisk hadde spist blåskjell) mens resterende fisk hadde mageinnhold som besto av strå, barnåler, rester av kvist mm. (Barlaup m.fl. 2015).
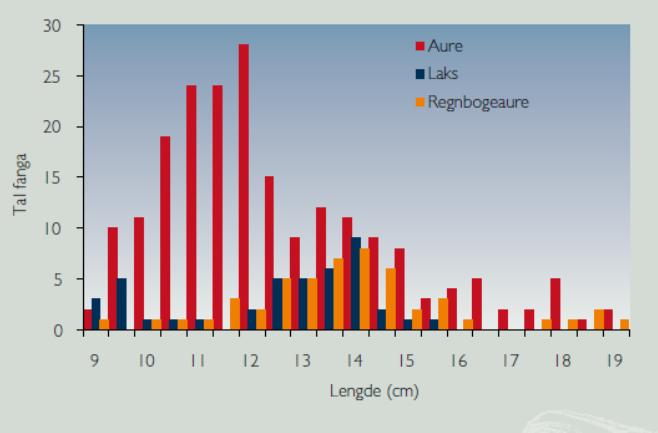
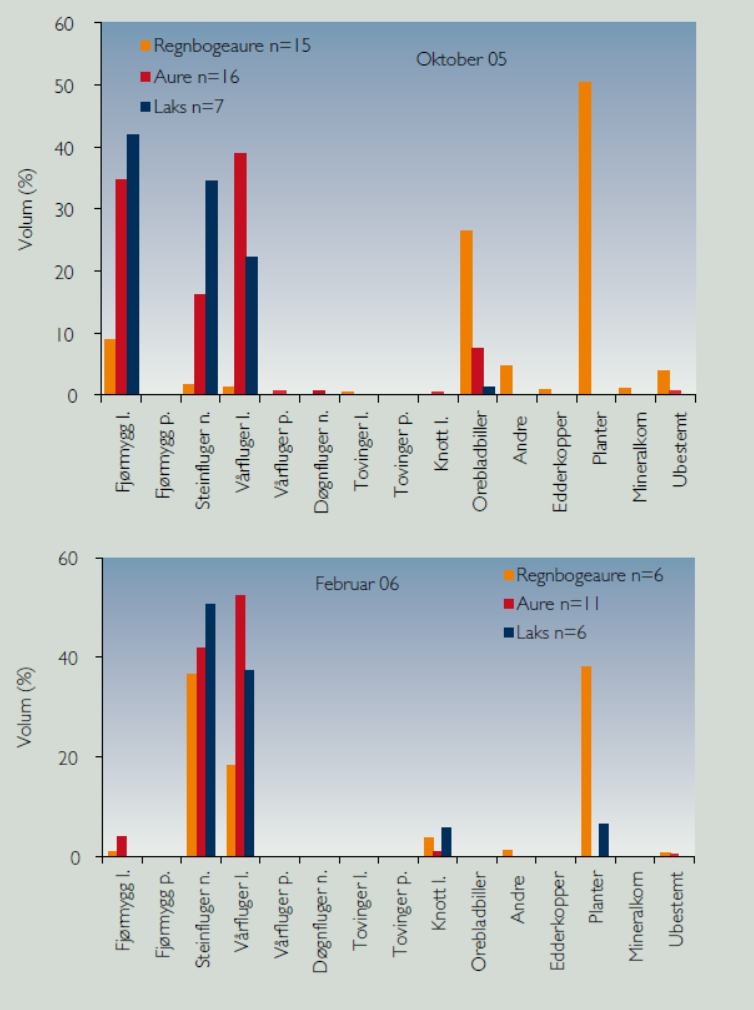
En opportunistisk studie med sammenligning av diettvalg hos regnbueørret, laks og sjøørret (Figur 4) ble gjennomført i Øyreselva i Hardangerfjorden høsten 2005 og vinteren 2006 (Borgstrøm & Skaala 2008). I forbindelse med høstflommen i elver i Hardangerfjordområdet og overløp i oppdrettskar, rømte et større antall regnbueørret. Under en årlig bestandsundersøkelse for juvenil laks og ørret kort tid etter ble det registrert 51 juvenile regnbueørret i Øyreselva.

Beregningene viste at i det undersøkte arealet var det 162 regnbueørret, 769 lakseunger og 196 sjøørrettunger (1+ og eldre), slik at regnbueørreten utgjorde en betydelig andel juvenil fisk i lengdeintervallet 9-19 cm (Figur 5). I oktober var mageinnholdet hos laks og ørret sterkt dominert av fjørmygglarver, steinfluenymfer og vårfluelarver, og svært lite landinsekt. Regnbueørreten spiste derimot mose og landlevende insekt, i første rekke stripet orebladbille ( Galerucella lineola ). I februar 2006 tok regnbueørreten fremdeles en del plantemateriale, men nå var dietten preget av steinfluenymfer og vårfluelarver (Figur 6), byttedyr som er sentrale i dietten til juvenil laks og sjøørret.
At det er større overlapp i dietten hos regnbueørret og laks og ørret i februar 2006 enn i oktober 2005, tyder på at regnbueørret som rømmer fra oppdrettsanlegg gradvis kan tilpasse seg næringstilbudet og konkurrere med laks og ørret, noe som vil kunne medføre redusert produksjon av disse to artene. Det fins flere eksempler på at regnbueørret kan være en konkurransesterk art. I en undersøkelse av regnbueørret og Dolly Varden røye ( Salvelinus malma ), tok regnbueørreten fullstendig over tilgangen på landlevende insekt som var dominerende i røyas diett, noe som førte til at røya gikk over på vannlevende insekt. Dette medførte en reduksjon på 30 % i tilvekst og en reduksjon på 75 % i biomasse for røya (Baxter m fl. 2004), og i tillegg ble det en kraftig forandring i det akvatiske insektsamfunnet. Dette medførte en redusert klekking av vannlevende insekt og deretter forandringer i skogsbunnen for edderkopper som inngikk i det terrestre økosystemet hvor også livsstadier hos de akvatiske insektene inngikk. Resultatene kan ikke generaliseres til å omfatte konkurranse mellom regnbueørret og laks, fordi røyeartene ofte ser ut til å være konkurransesvake sammen med regnbueørret i rennende vann (Grande 1964). Huitfeldt-Kaas (1918) opplyste at utsatt regnbueørret greidde seg godt i innsjøer og at den i noen tilfelle hadde reprodusert, men da alltid i fisketomme innsjøer.
Houde mfl. (2016) som undersøkte habitatbruk og fitnessegenskaper hos juvenil Atlantisk laks i konkurranse med regnbueørret, både i naturlig og eksperimentelle miljø, fant at i konkurranse med regnbueørret ble laksen tvunget til å benytte marginale habitater, noe som medførte redusert tilvekst og kondisjon gjennom undersøkelsen som gikk over 11 måneder.
4 - Konkurranse om gytehabitat og oppgraving av gytegroper for laks og ørret
Regnbueørret, laks og ørret gyter normalt i rennende vann og har overlappende preferanse med hensyn til substrat, vannhastighet og vanndyp (Tautz & Groot 1975; Crisp & Carling 1989; Fleming mfl. 1996). Mens laks og ørret gyter om høsten, gyter regnbueørret om våren, og det vil derfor være risiko for at egg som er gytt foregående høst av stedegne arter vil bli gravd opp. Hayes (1987) som undersøkte konkurranse om gytehabitat og oppveksthabitat hos ørret og regnbueørret i Scotts creek, fant at overlevelsen fra egg til «swim-up» ble redusert for begge arter, og at gytetidspunkt favoriserte regnbueørreten I et eksperimentelt feltforsøk ble ørretens gytesukssess redusert med 94%. Oppgraving er beskrevet som en årsak til at regnbueørret delvis (Hayes 1987) eller helt (Scott & Irvine 2000) har fortrengt ørretbestander, og til negativ bestandsutvikling hos to stedegne røyearter ( Salvelinus malma og S. leucomaenis ) i Japan (Taniguchi mfl. 2000). At regnbueørret kan grave opp gytegroper av laks og ørret er dokumentert i filmopptak fra Arnaelven i Hordaland (Tore Wiers, NORCE pers. medd.) På Gotland er regnbueørretens oppgraving av gytegroper vurdert som en mulig trussel mot bestandene av sjøørret (Landgren 1999).
Det er vist i krysningsforsøk at regnbueørret kan hybridisere og få levedyktig avkom med ørret (Blanc & Maunas 2005) og laks (Waknitz mfl. 2003), men det vurderes som lite sannsynlig at hybridisering skjer i naturen. Med tanke på variasjonen i gytetidspunkt hos regnbueørret i oppdrett, kan dette fremstå annerledes i fremtiden.
Etter rømmingen i Sørfjorden i januar 2015 ble det gjort undersøkelser for å bestemme om den rømte fisken søkte opp i nærliggende vassdrag. Totalt ble 48 elv- og bekkeoser overvåket ved hjelp av 136 inspeksjoner i løpet av perioden januar-juni. Dette resulterte i observasjoner av totalt 83 rømte regnbueaurer fortrinnsvis i elveosene eller i nederste del av vassdragene. Det ble ikke registrert tegn på gyteaktivitet. I et oppfølgende prøvefiske ca et år etter rømmingen ble det fanget inn seks fisk som trolig stammet fra rømmingen. Disse var kjennetegnet ved å ha regenererte finner og lite bukfett sammenliknet med mer nyrømt fisk. To av de seks fiskene, begge hunner, var kjønnsmodne og klare til å gyte førstkommende vår (Birkeland & Barlaup, 2016).
5 - Vektor for infektive organismer
Det er gjort registreringer som viser at regnbueørret i naturen kan ha relativt høye nivå av lakselus (Holst 2004, J.C. Holst pers. medd. i Skilbrei & Wennevik 2006). Det blir derfor antatt at rømt regnbueørret i enkelte år kan bidra vesentlig til produksjonen av lakselus i et område (Skilbrei 2005; Skilbrei & Wennevik 2006).
Det foreligger få publiserte undersøkelser av infeksjoner hos regnbueørret i norsk oppdrett, og praktisk talt ingenting om infeksjoner i naturen. Internasjonalt har det vært rettet mest oppmerksomhet på virussykdommene VHS (viral hemoragisk septikemi) og IHN (infeksiøs hematopoetisk nekrose) og dreiesyke forårsaket av parasitten Myxobulus cerebralis . Dreiesykeparasitten har naturlig utbredelse blant laksefisk i land rundt Atlanterhavet, og alt på 1800-tallet forårsaket parasitten høy dødelighet hos regnbueørret introdusert i Europa. Flytting av fisk fra Atlanterhavsområdet til Stillehavssiden av USA har bidratt til spredning av parasitten til stedegne bestander av regnbueørret. Med høy dødelighet som følge. Parasitten regnes derfor som den største trusselen mot vill regnbueørret i USA (Hedrick mfl. 1998). Det er beskrevet en populasjonsspesifikk mottakelighet for parasitten M. cerebralis (Hedrick mfl. 2003).
I Norge har det vært mye oppmerksomhet på spredning av en variant av parasitten Gyrodactylus salaris som er dødelig for laksunger. Denne ble først påvist i 1986 på regnbueørret i et oppdrettsanlegg i Tyrifjorden i Drammensvassdraget og senere også på flere andre oppdrettsanlegg med regnbueørret høyere oppe i samme vassdrag. Senere ble parasitten også påvist på laksunger i Drammenselva og Lierelva like ved (Mo 1991).
6 - Naturlig reproduksjon og etablering av selvreproduserende bestander
Fram til 1996 var det kun kjent seks lokaliteter med naturlig reproduksjon av regnbueørret i Norge, på tross av en langvarig utsettingsaktivitet fra tidlig på 1900 tallet og fram til slutten av 1980 tallet (Hindar 1996; Hesthagen & Sandlund 2007). Blant disse er to tilfeller i anadrome vassdrag, det ene i Imsa, Rogaland i 1978 (Jonsson mfl. 1993 a), det andre i Oselva Hordaland i 1994 (Sægrov mfl. 1996). I innlandsvassdrag var det beskrevet reproduksjon i fem kommuner (Hindar mfl. 1996), og naturlig reproduksjon over lengre tidsrom er dokumentert i Setervatna i Romsdalen, innsjøen Potta på Dovre og Brennfjellvatna i Troms (Gammelsæter & Dønnum 1994; Hindar mfl. 1996). Senere er det beskrevet et tilfelle i Kråkstadelva i Ås kommune (Aalerud mfl. 2003), og i Smalelva i Spydeberg kommune (R. Borgstrøm, pers. medd.). Det er sansynlig at det også forekommer regnbueørret i en sidebekk til Årosvassdraget i Røyken kommune (Tor Atle Mo, NINA, pers. medd.). Nye undersøkelser blant annet med miljø-DNA vil kunne gi et mer fullstendig bilde av forekomster av regnbueørret i norske vassdrag (Fossøy mfl. 2018). Også i resten av Europa er det relativt uvanlig at regnbueørret reproduserer naturlig (MacCrimmon 1971; Fausch mfl 2001; Fausch 2008; Walker 2004). Det er liten kunnskap om årsaker til at utsatt regnbueørret sjelden etablerer naturlig rekrutterende bestander, men følgende mekanismer blir nevnt:
Lang domestisering gjør at regnbueørret fra oppdrett er lite egnet i naturen
Naturlig forekommende sykdomsfremkallende organismer
Flomregimer som er ugunstig for vårgytende bestander av regnbueørret
Konkurranse eller predasjon fra stedegne arter
Gatz mfl (1987) som undersøkte konkurranse mellom regnbueørret og ørret i en multivariat analyse, fant at vannhastighet og tilhørende substratstørrelse og overflateturbulens, samt grad av skygge og planteoverheng som gav skjul, var av stor betydning for regnbueørretens konkurranseevne. I en omfattende undersøkelse av konkurranse mellom regnbueørret og atlantisk laks i et større antall vassdrag på Prince Edward Island i Canada, og faktorer som bidrog til at regnbueørret etablerer bestander, påviste Roloson mfl. (2018) en økning i antall kjente bestander av regnbueørret. Man fant at stigningsvinkel i vassdraget var en viktig forklaringsfaktor og at grad av antropogene forstyrrelser som landbrukspåvirkning i vassdraget var viktige, da regnbueørreten syntes å ha større toleranse for slike forstyrrelser enn de lokale artene. Nye etableringer hadde ofte utspring i tidligere etablerte populasjoner.
Det kan antas at risiko for etablering av naturlig reproduserende bestander vil kunne øke med økende antall rømminger og at avkom som stammer fra naturlig reproduksjon vil ha større evne til etablering. En slik etablering vil potensielt fungere som en kilde til videre spredning og etablering. Som eksempel nevnes utsettingene av regnbueørret i «The Great Lakes» i Canada som pågikk i ca 100 år før arten etablerte seg på 1970 tallet (Dueck 1996). Tilsvarende nevnes den innførte karpefisken Pseudorasbora parva som hadde lav forekomst på starten av 1970 tallet før den viste en eksplosiv spredning i en rekke europeiske land (Gozlan mfl. 2010).
7 - Konklusjoner
Fram til nå er det registrert svært få tilfeller av naturlig rekruttering og etablering av bestander av regnbueørret i Norge på tross av utsettinger gjennom mange tiår og rømminger fra akvakulturanlegg. Årsakene til at regnbueørret i liten grad etablerer naturlig reproduserende bestander i Norge og Europa ellers er ikke kjent. Regnbueørret har imidlertid mange biologiske likhetstrekk fenotypisk (Fig 4), i livshistorie og miljøkrav med våre naturlig forekommende arter av laksefisk, og det er dokumentert flere mekanismer for påvirkning på stedegne arter ved etablering av selvrekrutterende bestander eller vedvarende rømming.
Rømt regnbueørret kan konkurrere med stedegne arter om næringstilbud i ferskvann, og dessuten grave opp og skade gytegroper for laks og ørret. Regnbueørret kan også være kilde til overføring av patogener og parasitter som for eksempel Gyrodactylus salaris som er en trussel for Atlantisk laks. Dersom redusert fitness gjennom lang domestisering er årsak til manglende evne til etablering, vil import av nytt genmateriale fra andre avlslinjer evt også fra villfisk, kunne medføre større risiko for etablering. Dersom naturlig forekommende sykdomsorganismer hos stedegne laks og ørret er årsak, vil det være viktig å opprettholde bestander av de stedegne artene. Er det slik at regnbueørret har høyere toleranse for fluktuasjoner og forandringer i miljøet, vil endret flomregime, temperatur eller andre naturlige eller menneskeskapte forhold kunne forandre konkurranseforholdene mellom lokale arter og regnbueørret, og dermed medføre endret risiko for etablering.
8 - Referanser
Aalerud, C., Fløgstad J. & Borgstrøm R. 2003. Etablert bestand av regnbueørret Onchorhynchus mykiss i Kråkstadelva. Fauna 56: 162-167.
Anon. 2011. Prognoser for lakseinnsig, regnbueørret og klimaendringer: utfordringer for forvaltningen. Temarapport fra Vitenskapelig råd for lakseforvaltning nr 2, 45 s.
Artsdatabanken. 2018. Fremmedartslista 2018.Henta 23.06.2020. https://www.artsdatabanken.no/fremmedartslista2018
Barlaup, B.T., G.B. Lehmann,I.B. Birkeland, J. Løyland, B. Skår , S.E. Gabrielsen, G.Velle, E.O.Espedal, E. S. Normann., H. Skoglund, S. Stranzl & T. Wiers. 2015. Rømmingen av regnbueaure fra Angelskår i Sørfjorden januar 2015. Uni Research Miljø. LFI-rapport nr. 250.
Baxter, C.V., Fausch, K.D., Murakami, M., Chapman, P.L. 2004. Fish invasion restructures stream and forest foodwebs by interrupting reciprocal prey subsidies. Ecology 85: 2656-2663.
Baxter, C.V., Fausch, K.D., Murakami, M. & Chapman, P.L. 2007. Invading rainbow trout usurp a terrestrial prey subsidy from native charr and reduce their growth and abundance. Oecologia 153: 461-470.
Behnke, R.J. 1992. Native trout of western North America. American Fisheries Society Monograph 6.
Behnke, R.J. 2002. Trout and salmon of North America. The Free Press, Simon and Schuster, Inc., New York.
Bevanger, K. 2005. Nye dyrearter i Norsk natur. Landbruksforlaget, Norge, Oslo.
Blanc, J.M. & Maunas, P. 2005. Farming evaluation of the ‘brownbow’ triploid hybrid (Oncorhynchus mykiss · Salmo trutta ). Aquaculture International 13: 271-281.
Borgstrøm, R. & Skaala, Ø. 2008. Rømt regnbogeaure - økologiske interaksjoner med vill laks og sjøaure. Havforskningstema 2008-1.
Barlaup, B.T., G.B. Lehmann,I.B. Birkeland, J. Løyland, B. Skår , S.E. Gabrielsen, G.Velle, E.O.Espedal, E. S. Normann., H. Skoglund, S. Stranzl & T. Wiers. 2015. Rømmingen av regnbueaure fra Angelskår i Sørfjorden januar 2015. Uni Research Miljø. LFI-rapport nr. 250.
Birkeland, I. & B.T. Barlaup. 2016. Prøvefiske etter regnbueaure i Herdlefjorden ett år etter rømmingen ved Angelskår. Uni Research Miljø. LFI-rapport nr. 277.
Crowl, T.A., Townsend, C.R. & Mcintosh, A.R. 1992. The impact of introduced brown and rainbow trout on native fish: the case of Australasia. Reviews in Fish Biology and Fisheries 2: 217-241.
Crisp, D.T & Carling, P.A. 1989. Observation on siting, dimensions and structure of salmonid redds. Journal of Fish Biology 34: 119-134.
Dueck, L.A. & Danzmann, R.G. 1996. Matriarchal population structure of introduced rainbow trout ( Oncorhynchus mykiss ) in the Lake Ontario watershed. Canadian Journal of Fisheries and Aquatic Sciences 53: 2100-2114.
Elliott, J.M. 1973. The food of brown trout and rainbow trout ( Salmo trutta and S. gairdneri ) in relation to the abundance of drifting invertebrates in a mountain stream. Oecologia 12:329-347.
Fausch, K.D. 2007. Introduction, establishment and effects of non-native salmonids: considering the risk of rainbow trout invasion in the United Kingdom. Journal of Fish Biology 71 (Supplement D): 1-32.
Fausch, K.D. 2008. A paradox of trout invasions in North America. Biological Invasions 10: 685-701.
Fausch, K.D., Taniguchi, Y., Nakano, S., Grossman, G.D. & Townsend, C.R. 2001. Flood disturbance regimes influence rainbow trout invasion success among five Holarctic regions. Ecological Applications 11: 1438-1455.
Fleming, I.A. 1996. Reproductive strategies of Atlantic salmon: ecology and evolution. Reviews in Fish Biology and Fisheries 6: 379-416.
Fossøy, F., Thaulow, J., Anglès d'Auriac, M., Brandsegg, H., Sivertsgård, R., Mo, T.A., Sandlund, O.T. & Hesthagen T. 2018. Bruk av miljø-DNA som supplerende verktøy for overvåkning og kartlegging av fremmed ferskvannsfisk. NINA Rapport 1586. Norsk institutt for naturforskning.
Gammelsæter, M., Dønnum, B. O. 1994. Varig bestand av regnbueørret påvist i Setervatna ved Åndalsnes. Fauna 47: 290-298.
Gatz A J Jr, M.J. Sale, and J.M. Loar. 1987. Habitat shifts in rainbow trout: competitive influences of brown trout. Oecologia: 74:~19
Gederaas, L., Salvesen, I. & Viken, Å. (red.) 2007. Norsk svarteliste 2007 - Økologiske risikovurderinger av fremmede arter. Artsdatabanken.
Gilliam, J.F. & Fraser, D.F. 1987. Habitat selection under predation hazard: test of a model with foraging minnows. Ecology 68: 1856-1862.
Glover, K.A. 2010. Forensic identification of fish farm escapees: the Norwegian experience. Aquaculture Environment Interactions 1: 1-10.
Gozlan, R.E., Britton, J.R., Cowx, I. & Copp, G.H. 2010. Current knowledge on non-native freshwater fish introductions. Journal of Fish Biology 76: 751-786.
Grande, M. 1964. En undersøkelse av bekkerøya i Øyfjell i Telemark. Fauna 17: 17-33.
Hansen, L.P. 2000. Atlantisk laks. S 38-49 i: Borgstrøm, R., Hansen, L.P. (red.). Fisk i ferskvann. Et samspill mellom bestander, miljø og forvaltning. Oslo, Landbruksforlaget. ISBN 82-529-1986-3.
Hasegawa, K. & Maekawa, K. 2006. The effects of introduced salmonids on two native streamdwelling salmonids through interspecific competition.Journal of Fish Biology 68: 1123-1132.
Hayes, J.W. 1987. Competition for spawning space between brown trout ( Salmo trutta ) and rainbow trout ( S. gairdneri ) in a lake inlet tributary, New Zealand. Canadian Journal of Fisheries and Aquatic Sciences 44: 40-47.
Hedrick, R.P., El-Matbouli, M., Adkison, M.A. & MacConnell, E. 1998. Whirling disease: reemergence among wild trout. Immunological Reviews 162: 365-376.
Hedrick, R.P., McDowll T.S., Marty G.D., Fosgate G.T., Mukkatira K, Myklebust K & El-Matbouli M. 2003. Susceptibility of two strains of rainbow trout (one with suspected resistance to whirling disease) to Myxobolus cerebralis infection. Diseases of Aquatic Organisms 55: 37-44.
Hesthagen, T. & Sandlund, O.T. 2007. Non-native freshwater fishes in Norway: history, consequences and perspectives. Journal of Fish Biology 71: 173-183.
Hindar, K., Fleming, I.A., Jonsson, N., Breistein, J., Sægrov, H., Karlsbakk, E., Gammelsæter, M. & Dønnum, B.O. 1996. Regnbueørret i Norge: forekomst, reproduksjon og etablering. NINA Oppdragsmelding 454: 1-32.
Holst, J.C. 2004. Lakselus som trusselfaktor. I: Barlaup, B.T. (red.), Vossolaksen - bestandsutvikling, trusselfaktorer og tiltak. DN-utredning 2004-7.
Houde A L S, Smith A D, Chris C. Wilson CC, Peres-Neto PR, Neff BD. 2016. Competitive effects between rainbow trout and Atlantic salmon in natural and artificial streams. Ecology of Freshwater Fish 2016: 25: 248–260.
Huitfeldt-Kaas, H. 1918. Ferskvandsfiskenes utbredelse og innvandring i Norge, med et tillæg om krebsen. Centraltrykkeriet Kristiania. 106s.
Jensen A. J., H. Sægrov, L.P. Hansen, P. Fiske, and H. Gjøsæter. 2013. Rainbow trout and pink salmon in Norway, and their potential threat to Atlantic salmon. Working paper 2013/17 NASWG, ICES. 10s.
Jonsson, N., Jonsson, B., Hansen, L.P. & Aass, P. 1993a. Coastal movement and growth of domesticated rainbow trout ( Oncorhynchus mykiss (Walbaum)) in Norway. Ecology of Freshwater Fish 2: 152-159.
Jonsson, N., Jonsson, B., Hansen, L.P. & Aass, P. 1993b. Potential for sea ranching rainbow trout, Oncorhynchus mykiss (Walbaum): evidence from trials in two Norwegian fjords. Aquaculture and Fishery Management 24: 653-661.
Gatz AJ, Sale MJ, Loar JM . 1987. Habitat shifts in rainbow trout: competitive influences of brown trout. Oecologia 74:7-19
Laird, L.M. & Needham, T. 1988. The farmed salmonids. I: Laird, L.M. & Needham, T. (red.), Salmon and trout farming, s. 15-31. Ellis Horwood, Chichester.
Landergren, P. 1999. Spawning of anadromous rainbow trout, Oncorhynchus mykiss (Walbaum): a threat to sea trout, Salmo trutta L., populations? Fisheries Research 40: 55-63.
MacCrimmon, H.R. 1971. World distribution of rainbow trout ( Salmo gairdneri ). Journal of the Fisheries Research Board of Canada 28: 663-704.
Mo, T.A. 1991.Variations of opisthaptoral hard parts of Gyrodactylus salaris Malmberg, 1957 (Monogenea: Gyrodactylidae) on rainbow trout Oncorhynchs mykiss (Walbaum, 1792) in a fish farm, with comments on the spreading of the parasite in south-eastern Norway. Systematic Parasitology 20: 1-9.
Quinn, T.P. 2005. The behaviour and ecology of Pacific salmon and trout. American Fisheries Society/University of Washington Press, Bethesda, MD/Seattle, WA.
Rikardsen, A.H. & Sandring, S. 2006. Diet and size-selective feeding by escaped hatchery rainbow trout Oncorhynchus mykiss (Walbaum). ICES Journal of Marine Science 63: 460-465.
Roloson S D, Knysh K M, Coffin M R S, Gormley K.L., Pater S C, Van den Heuvel M R. 2018. Rainbow trout ( Oncorhynchus mykiss ) habitat overlap with wild Atlantic salmon ( Salmo salar ) and brook trout ( Salvelinus fontinalis ) in natural streams: do habitat and landscape factors override competitive interactions? Can. J. Fish. Aquat. Sci. Vol. 75:1949-1959.
Schade, C.B. & Bonar S.A. 2005. Distribution and abundance of nonnative fishes in streams of the western United States. North American Journal of Fisheries Management 25: 1386-1394.
Scott, W.B. & Crossman, E.J. 1973. Freshwater fishes of Canada. Fisheries Research Board of Canada Bulletin 184.
Scott, D. & Irvine, J.R. 2000. Competitive exclusion of brown trout Salmo trutta L., by rainbow trout Oncorhynchus mykiss Walbaum, in lake tributaries, New Zealand. Fisheries Management and Ecology 7: 225-237.
Singh A.K., Biju Sam Kamalam and Prem Kumar. 2016. Charting Ways to Invigorate Rainbow Trout Production in India . Journal of Fisheries Sciences 10(2): 025-032.
Skilbrei, O. 2005. Rømt laks og regnbueørret bør fiskes opp. Kyst og havbruk 2005. Fisken og havet, Særnr. 2-2005: 110-111.
Skilbrei, O.T & Wennevik, V. 2006. The use of catch statistics to monitor the abundance of escaped farmed Atlantic salmon and rainbow trout in the sea. ICES Journal of Marine Science 63: 1190-1200.
Stolz, J., Schnell, J. 1991. Trout. Harrisburg, Stackpole Books. ISBN 0-8117-1652-X.
Sægrov, H., Hindar, K. & Hurdal, K. 1996. Natural reproduction of anadromous rainbow trout in Norway. Journal of Fish Biology 48: 292-294.
Taniguchi, Y., Miyake, Y., Saito, T., Urabe, H., Nakano, S. 2000. Redd superimposition by introduced rainbow trout, Oncorhynchus mykiss , on native charrs in a Japanese stream. Ichthyological Research 47: 149-156.
Tautz, A.F. & Groot, C. 1975. Spawning behavior of chum salmon ( Oncorhynchus keta ) and rainbow trout ( Salmo gairdneri ). Journal of the Fisheries Research Board of Canada 32: 633-642.
Tilzey, R.D.J. 1976. Observations on interactions between indigenous Galaxiidae and introduced Salmonidae in the Lake Eucumbene Catchment, New South Wales. Australian Journal of Marine and Freshwater Research 27: 551-564.
Waknitz, F.W., Iwamoto, R.N. & Strom, M.S. 2003. Interactions of Atlantic salmon in the Pacific Northwest IV. Impacts on the local ecosystems. Fisheries Research 62: 307-328.
Walker, A. 2004. Rainbow trout ( Oncorhynchus mykiss ). I: Davies, C.E., Shelley, J., Harding, P.T., McLean, I.F.G., Gardiner, R. & Peirson, G. (red.), Freshwater fishes in Britain. Harley books.