4 - Fiskeri, bestandsinndeling og -utvikling for havsil
4.1 - Fiskeriet
I all hovedsak er det Danmark og Norge som driver et tobisfiske i Nordsjøen der man tråler på dagtid når havsilen samler seg i stimer på jakt etter dyreplankton. Over tid har det vært store endringer i hvilke tråler som brukes, men i dag brukes store bunntråler med et relativt lett bunngir med en trålhøyde på opptil 40 meter som kan dekke nesten hele vannsøylen. Trålingen foregår på slett grus og sandbunn da man ikke kan tråle på steinbunn med denne type trål. Trålsekken er småmasket (~18 mm) for å unngå at fisk rømmer gjennom maskene, og typisk trålhastighet er 2,5-3 knop. I henhold til den norske forvaltningsreguleringen på tobis kan man fiske tobis i norsk sone i perioden 15. april – 23. juni. I EU farvann er sesongen 1. april – 31. juli. Denne sesongbegrensingen hindrer et stort yngelfiske på høsten, noe som var et problem tidligere. Flåten har endret seg dramatisk i løpet av de siste tiårene med en sterk reduksjon i antall fartøy. Samtidig har de aktive fartøyene blitt større. Nå er det ca. 100 danske og litt under 30 norske trålere i tillegg til noen få svenske fartøy som fisker tobis (ICES, 2017).
4.2 - Historisk forvaltning
Fisket etter tobis startet i 1950-årene, men utviklet seg raskt i begynnelsen av 1970-årene der man årlig fanget mellom 0,5 og 1,2 millioner tonn med tobis. Inntil 2003, var det få kvotebegrensninger utover det at man ikke burde øke fisketrykket mer enn fjoråret (Greenstreet et al., 2006; ICES, 2010). I praksis var derfor dette et fritt fiskeri som typisk startet i mars og ble avsluttet i oktober. Om høsten kunne store deler av fangsten bestå av yngel. Utgangspunktet for denne forvaltningen var antagelsen om at fiskeriet i stor grad var selvregulerende slik at redusert bestand ville medføre lave fangstrater og et ikke-økonomisk fiskeri og dermed redusert innsats.
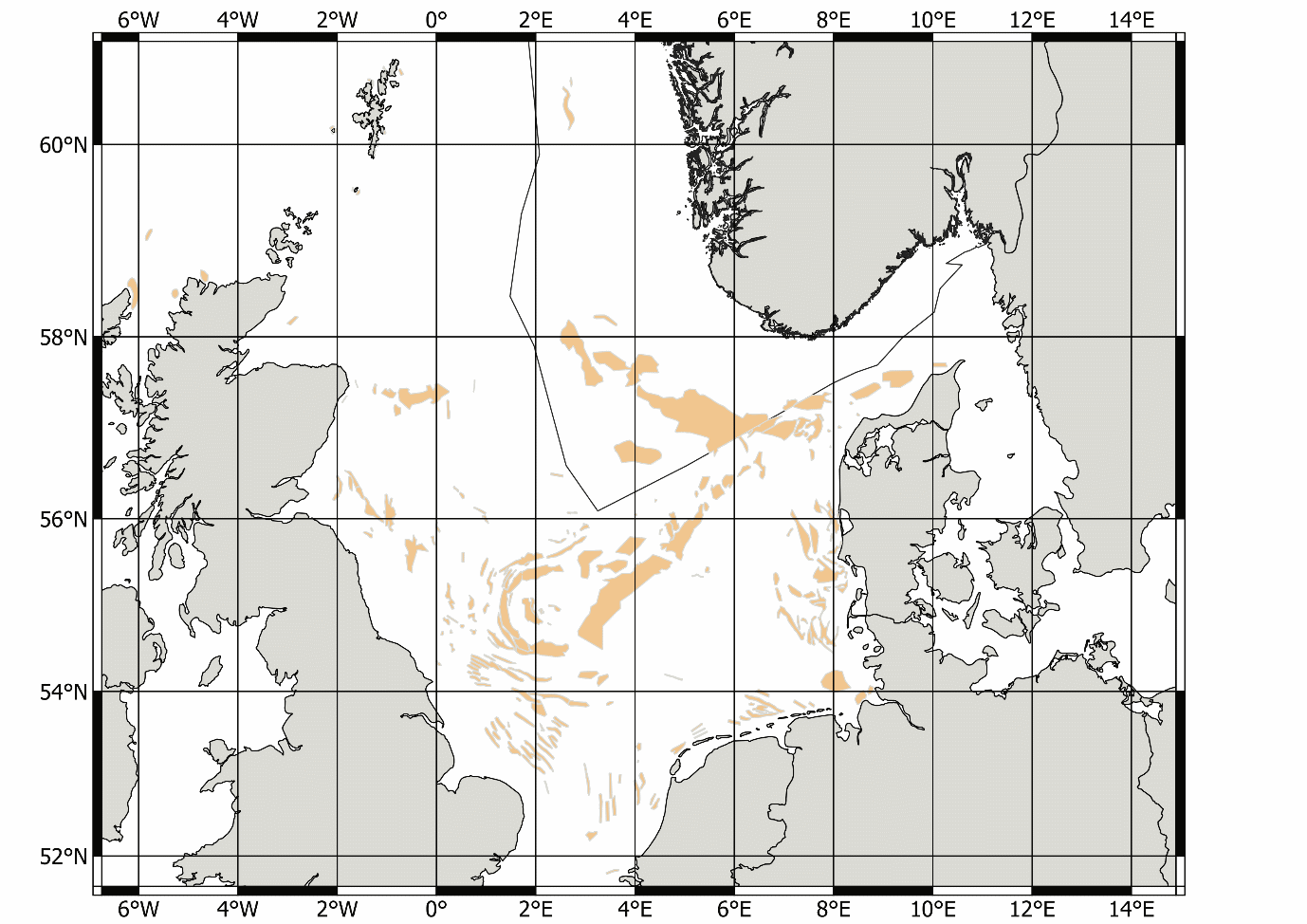
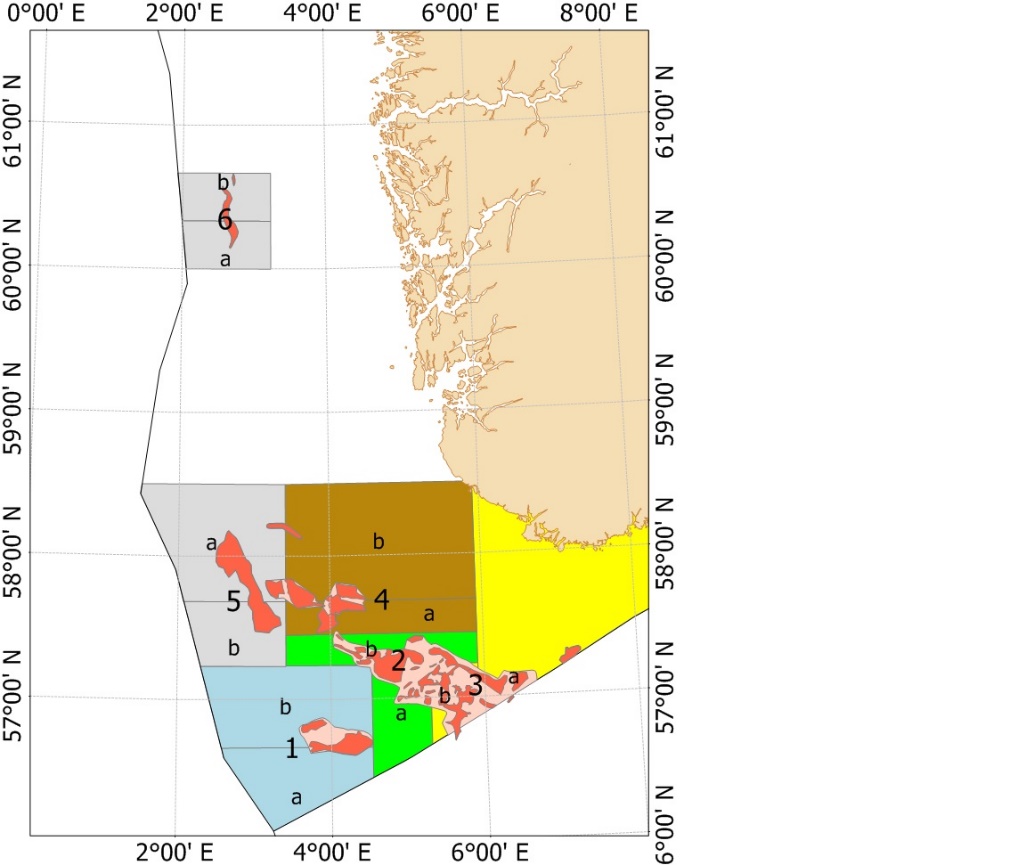
På slutten av 1990-årene ble det økt fokus på at fiskeriet kunne ha lokale negative påvirkninger på økosystemet. For å sikre mattilgang for sjøfuglene utenfor Skottland ble det laget et større forbudsområde for tobistrålerne i 2000 (Fredriksen et al., 2004). Samtidig ble det et større fokus på at det var regionale forskjeller i rekruttering, vekst og alder ved kjønnsmodning (Protector et al., 1998), men det ble gitt et felles kvoteråd og en global kvote for Nordsjøen og omliggende områder helt frem til 2010 (ICES, 2010). I forbindelse med arbeidet med revidering av bestandsvurderings-metodikken ble det besluttet å dele Nordsjøen inn i 7 forskjellige bestandsvurderingsområder (ICES, 2010) basert på forskjeller i vekst, kjønnsmodning og larvespredning predikert med larvedriftmodeller (ICES, 2010). Siden 2011 har kvotene blitt gitt per område som vist i Figur 3 (ICES, 2010; ICES, 2017; ICES, 2020).
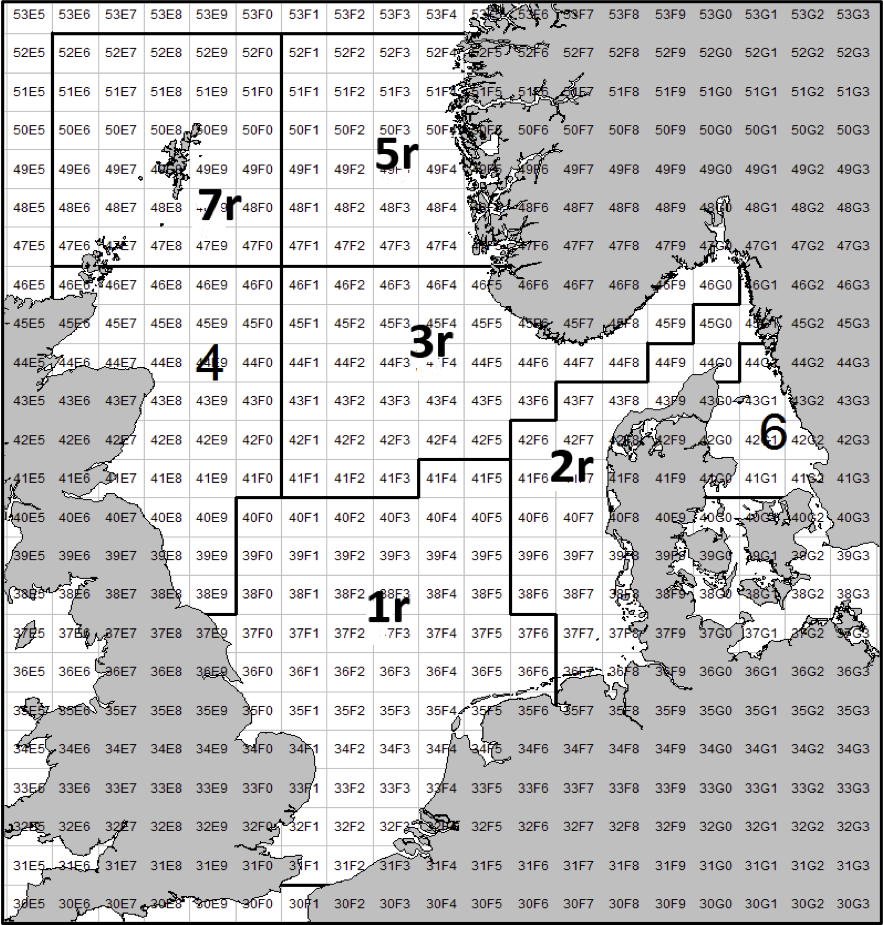
Figur 3. ICES bestandsområder. Denne områdefordelingen ble etablert i 2011, men etter en mindre revisjon i 2017 ble grensene som vises i dette kartet etablert fra og med fiskerisesongen 2018 (ICES, 2017).
Fra begynnelsen av 2000-tallet opplevde man en generell nedgang i tobisbestandene i Nordsjøen, men nedgangen var særlig stor i norsk sone (ICES, 2010; Johannessen & Johnsen, 2015). Situasjonen var kritisk ettersom kvoterådene som ble gitt for hele Nordsjøen ikke tok spesifikt hensyn til bestandssituasjonen i norsk sone, og tillot i teorien en stor fiskeriinnsats i norsk sone. For å unngå et for stort lokalt fiskepress på disse utsatte tobisbankene ga HI tilleggsråd som begrenset fiskeriaktivitet i norsk sone (ICES, 2010). Situasjonen skapte støy og uforutsigbarhet for det norske tobisfisket. Med dette som utgangspunkt fikk HI og Fiskeridirektoratet i oppgave fra Fiskeri- og kystdepartementet å lage en nasjonal forvaltningsplan for tobis i norsk del av Nordsjøen. Grunnet den uoversiktlige situasjonen, og med et klart behov for bedre informasjon startet HI et toktprogram i 2005 med målsetning om å kartlegge utbredelse og bestandsutvikling av havsil i norsk sone. Med nye toktdata og mer grundige studier av fiskeridataene ble det vist at særlig ett tobisbankområde «Vestbanken» hadde høyere tetthet av voksen havsil og en jevnt høyere rekruttering i en årrekke (Johannessen & Johnsen, 2015) (Figur 4). Dette området bestod av mange små sandbanker klemt innimellom steingrunner, der disse små sandbankene fungerte som et naturlig reservat da de var for små til at tobistrålerne kunne operere der. I motsetningen til Vestbanken domineres de andre tobisområdene i norsk sone av større sammenhengende sandbanker, og analysene viste at disse bankene hadde vært utsatt for et mer geografisk homogent fisketrykk. Disse bankene manglet naturlig beskyttelse for gytebestanden, og det så ut til at rekrutteringen generelt var dårligere her enn på Vestbanken. Disse observasjonene var sentrale under utarbeidelsen av den nasjonale områdebaserte forvaltningen (ICES, 2010; Johannessen & Johnsen, 2015) da de indikerte at en bevaring av den lokale gytebestanden økte sannsynligheten for en bedre lokal rekruttering.
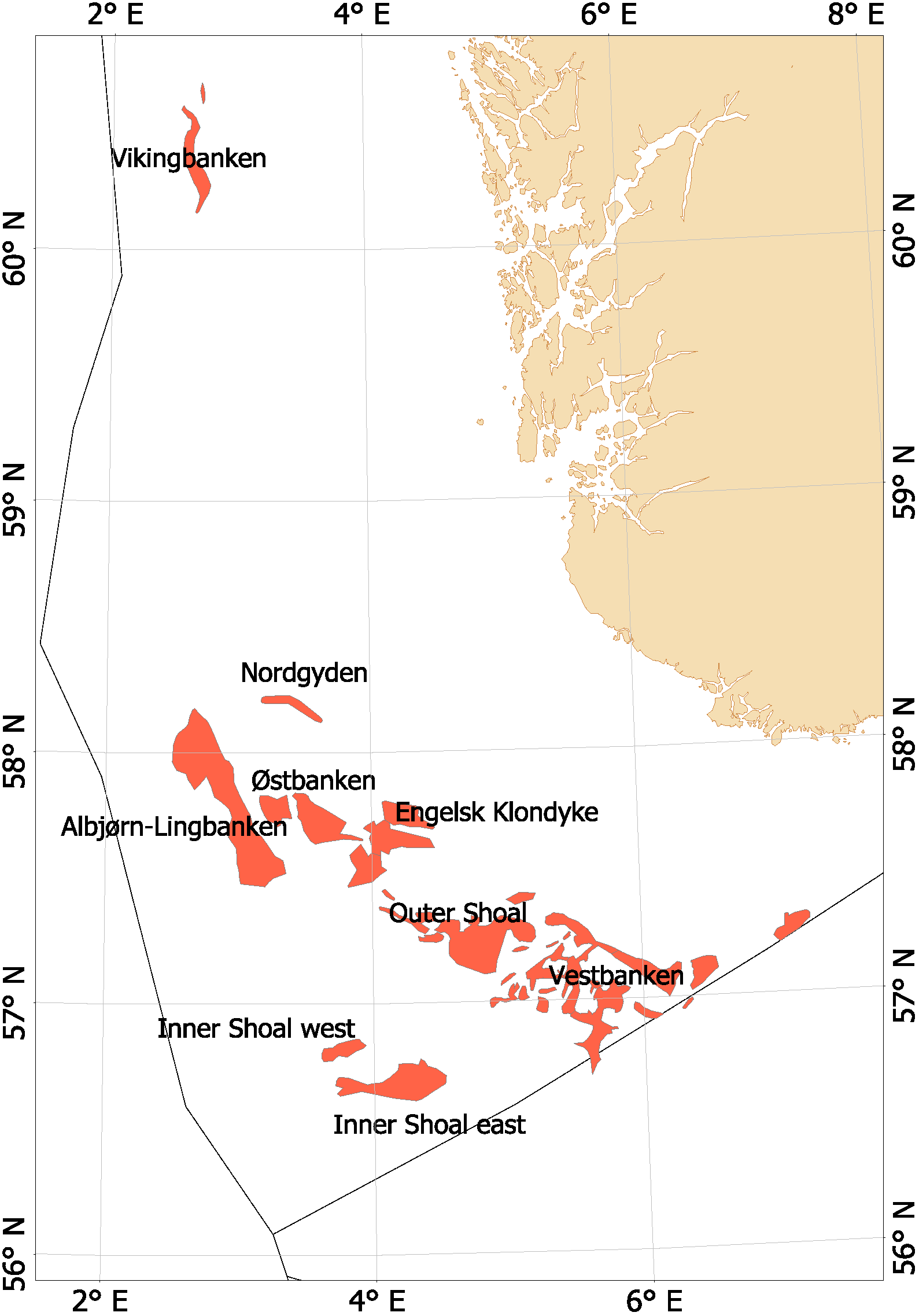
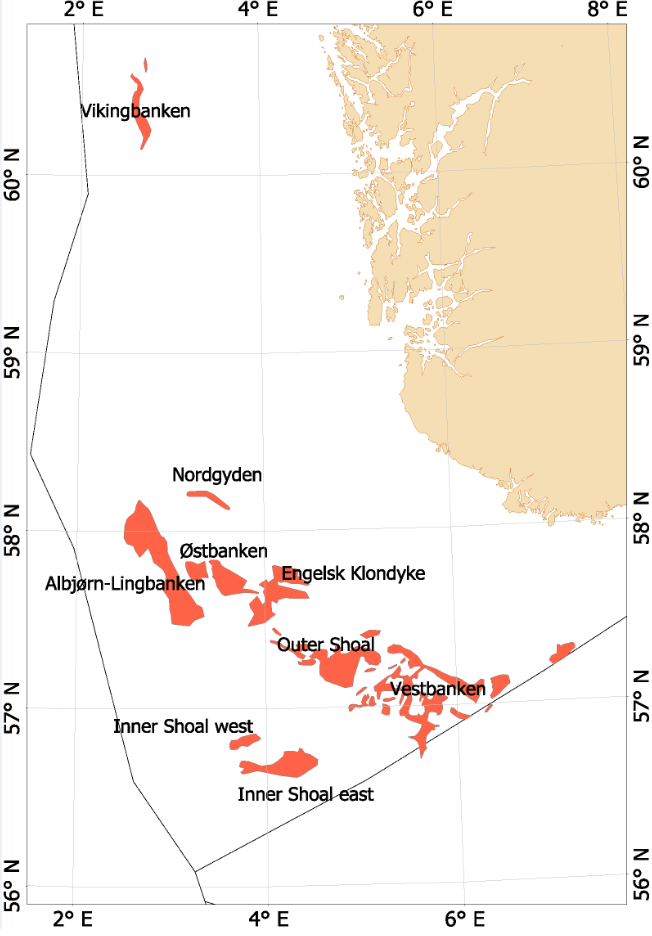
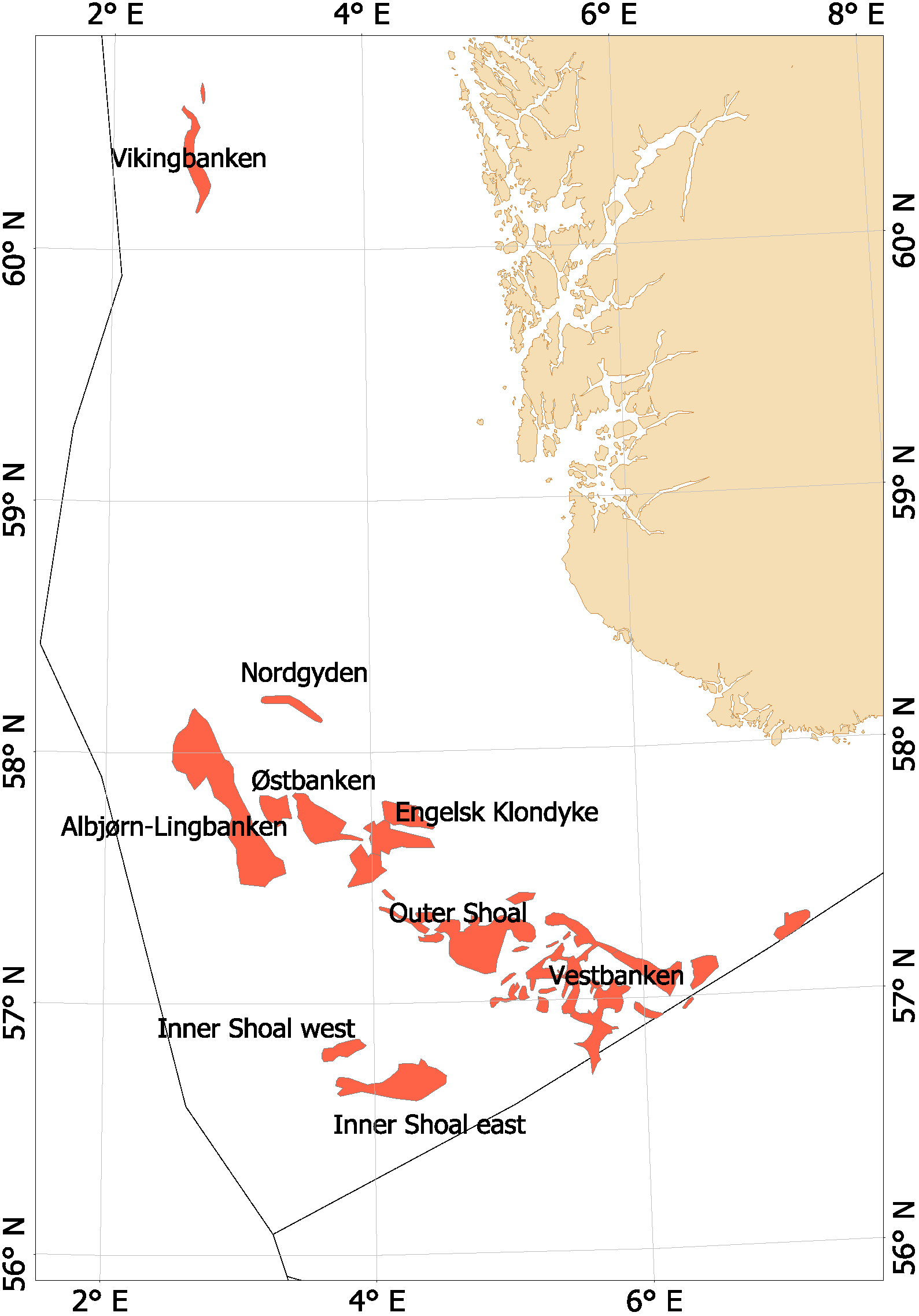
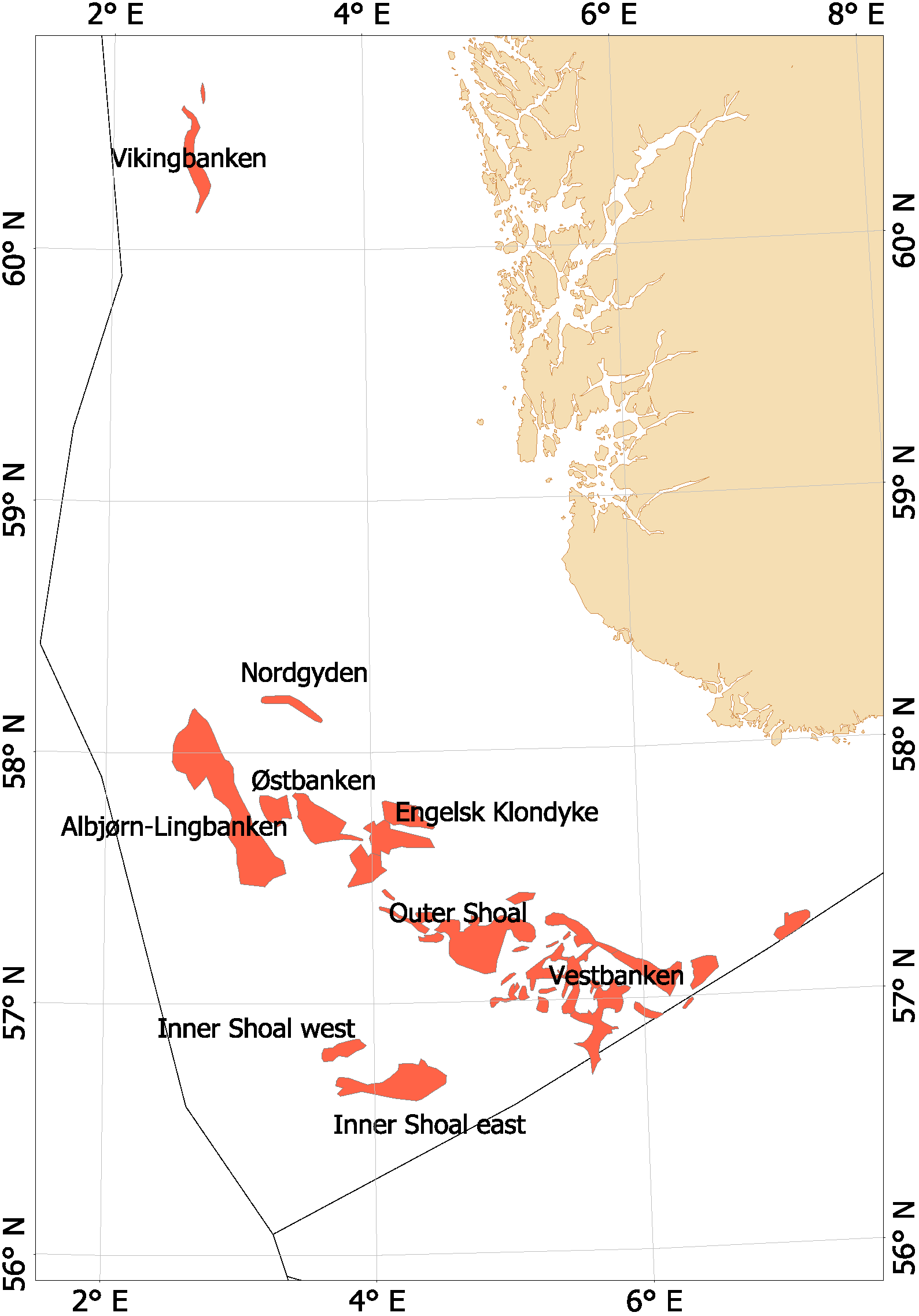
Figur 4. Tobis fiskefelt i norsk sone av Nordsjøen.
4.3 - Norsk områdeforvaltning av havsil
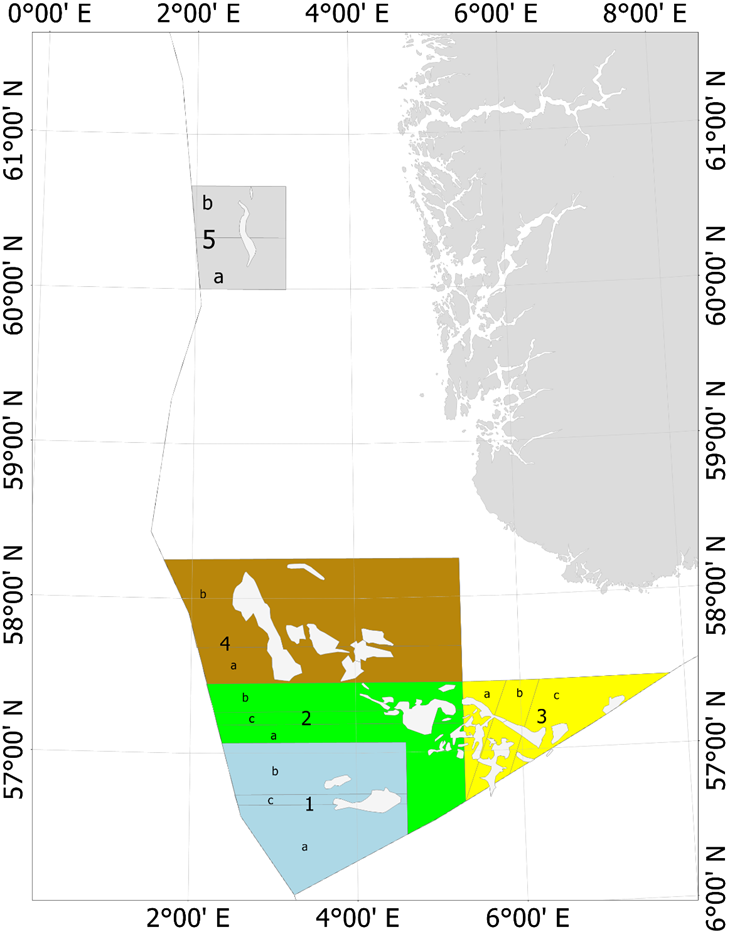
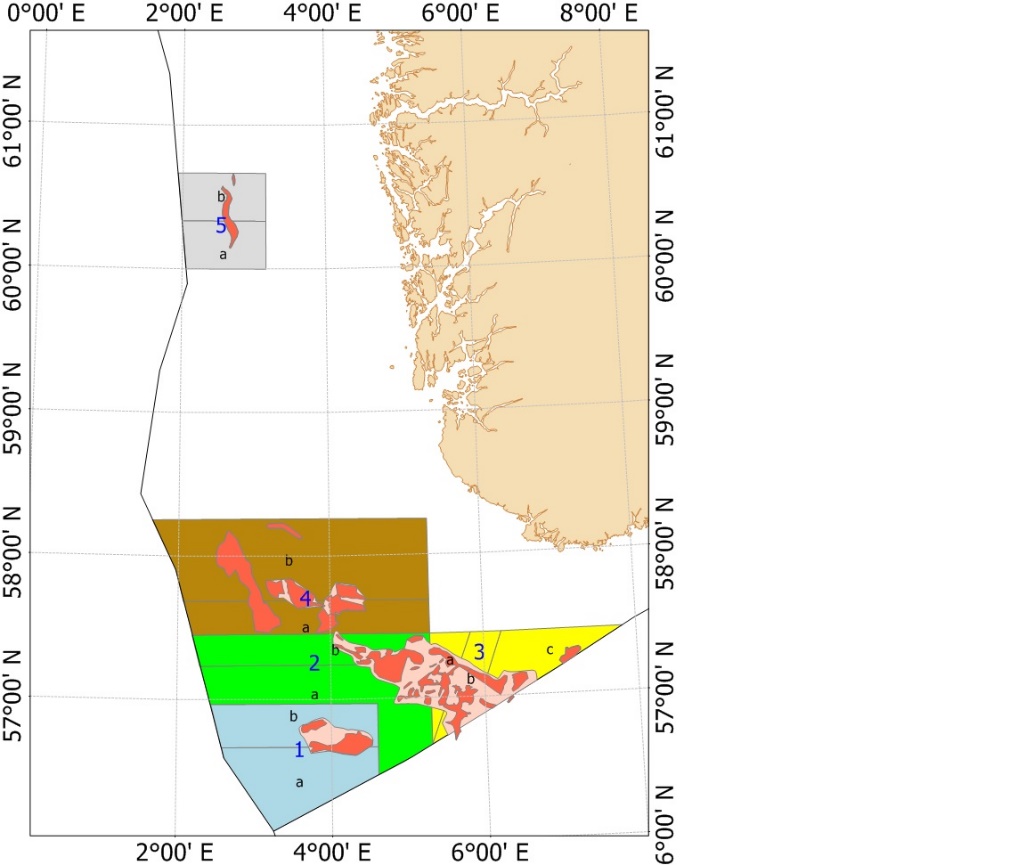
Fra og med 2010 (2010 var et forsøkssår) har havsil i norsk sone blitt forvaltet i henhold til en nasjonal områdebasert forvaltningsmodell. Med forbedret overvåkningsmetodikk og økt kunnskap om vekst og rekrutteringsmønster ble forvaltningsmodellen modifisert i 2014, 2017 og senest i 2020. Figur 5 viser områdeinndelingen av de fem nåværende forvaltningsområdene. De tidligere områdeinndelingene er vist i Vedlegg 2.
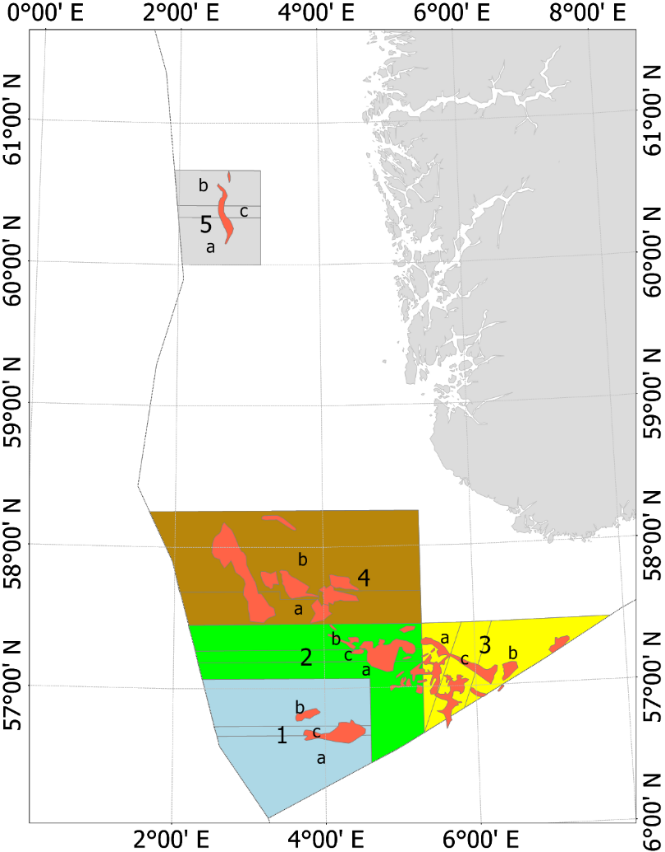
Figur 5 . Forvaltningsområdene i norsk sone (Områdeinndelingen er gyldig fra 2020). De røde feltene inni forvaltningsområdene viser de viktigste tobisfeltene.
Hvert forvaltningsområde som er inndelt i underområder (Figur 5), skal holdes stengt for tobisfiske inntil bestanden av havsil innen området vurderes til å være stor nok til å tillate et fiske. Dersom et område blir åpnet for fiske skal alltid enten dets «A» eller «B» underområde forbli stengt gjennom sesongen. Det nordligste forvaltningsområdet «5» har vært stengt siden man startet med denne forvaltningsmodellen, mens minst ett av områdene i den sørlige delen har vært åpent for fiske siden 2011 (Tabell 3). For forvaltningsområdene 1-4 blir det gitt en felles tobiskvote, men de stengte underområdene sikrer at en del av den lokale havsilbestanden innen et forvaltningsområde alltid vil overleve fiskerisesongen selv om flåten skulle konsentrere hele fisket på kun ett av disse forvaltningsområdene.
I forkant av fiskerisesongen (ca. 1. februar) blir det gitt et foreløpig og forsiktig kvoteråd (Tabell 3). På dette tidspunktet har man relativt sikre prediksjoner på forventet mengden av to år og eldre individer, mens prediksjonene av mengde ettåringer og den individuelle vekten er mye mer usikker (Johnsen, 2020). Derfor gjennomfører HI et akustisk tråltokt tidlig i fiskerisesongen for å få oppdatert informasjon om geografisk fordeling, rekruttering og total biomasse av havsil (Johnsen, 2020). Resultatene fra dette toktet gir grunnlag for et oppdatert og endelig kvoteråd som blir gjeldende fra ca. 15. mai (Tabell 3).
I tillegg til områdebegrensningene og foreløpig råd inkluderer den norske forvaltningsmodellen flere punkter som sikrer en bærekraftig høsting av havsilbestanden (se Vedlegg 2).
| År |
Foreløpig råd |
Endelig råd i mai |
Landinger |
| Kvoteråd (tonn) |
Åpne underområder |
Kvoteråd (tonn) |
Åpne underområder |
(tonn) |
| 2010 |
20 000 |
1b, 2b, 3b |
50 000 |
1b, 2b, 3b |
50 471 |
| 2011 |
60 000 |
1a, 2a, 3a |
90 000 |
1a, 2a, 3a |
90 170 |
| 2012 |
40 000 |
1b, 2b, 3b |
40 000 |
1b, 2b, 3b |
41 231 |
| 2013 |
20 000 |
3a |
20 000 |
3a |
9 827 |
| 2014 |
15 000 |
3b, 3c |
90 000 |
2a, 3b, 3c, 4b |
83 262 |
| 2015 |
100 000 |
2b, 3b, 3a |
100 000 |
1b, 2b, 3a, 3b, 4a |
101 574 |
| 2016 |
40 000 |
1b, 2a, 3a, 3b |
40 000 |
1b, 2a, 3a, 3b, 4a |
41 567 |
| 2017 |
50 000 |
1b, 1c, 2b, 2c, 3c, 3b, 4a |
120 000 |
1b, 1c, 2b, 2c, 3c, 3b, 4a |
120 938 |
| 2018 |
70 000 |
1b, 1c, 2a, 2c, 3a, 3b, 4b |
70 000 |
1b, 1c, 2a, 2c, 3a, 3b, 4b |
70 051 |
| 2019 |
55 000 |
1b, 1c, 2b, 2c, 3b, 3c, 4a |
125 000 |
1b, 1c, 2b, 2c, 3b, 3c, 4a |
125 046 |
| 2020 |
70 000 |
1a, 1c, 2b, 2c,3b,3c, 4a |
250 000 |
1a, 1c, 2b, 2c,3b,3c, 4a |
250 000 |
| 2021 |
110 000 |
1b,1c, 2a, 2c, 3a, 3c, 4b |
145 000 |
1b,1c, 2a, 2c, 3a, 3c, 4b |
146 442 |
Tabell 3. Kvoteråd og landinger for perioden 2010-2021 i norsk økonomisk sone. Se vedlegg 2 for å se områdekart for periode 2011-2019, og Figur 5 for områdekart for 2020.
4.4 - Havsil i norsk sone
I norsk sone av Nordsjøen er det naturlig å strukturere tobisområdene inn i to hovedområder. I nordlig del, langt unna andre tobisfelt finner man Vikingbanken som tidligere har hatt store forekomster av havsil. I sørlige tobisområder er det langt større og flere tobisområder (Figur 4; Tabell 4). Forvaltningsområdene er vist i Figur 5, tobisområdene med navn er vist i Figur 4 og ICES områdene er vist i Figur 3.
| Hovedområde |
Tobisområde |
Forvaltningsområde |
ICES område |
| Nord |
Vikingbanken |
Område 5 |
5r |
| Sør |
Nordgyden |
Område 4 |
3r |
| Sør |
AlbjørnLing |
Område 4 |
3r |
| Sør |
Østbanen |
Område 4 |
3r |
| Sør |
Engelsk Klondyke |
Område 4 |
3r |
| Sør |
Outer Shoal |
Område 2 |
3r |
| Sør |
Vestbanken |
Område 3 |
3r |
| Sør |
Inner Shoal* |
Område 1 |
3r |
Tabell 4. Navn på de tobisområder i norsk sone av Nordsjøen.
*Inner Shoal er vist som Inner Shoal East og Inner Shoal West i Figur 5.
4.4.1 - Nordlige tobisområder
Vikingbanken er den eneste definerte tobisbanken i nordlige tobisområde, og er omringet av nærliggende oljeaktivitet ved Oseberg, Brage og Veslefrikk. Tobisbestanden på Vikingbanken har vært kritisk lav siden slutten av 1990-tallet, og den siste gode rekrutteringen var i 1995 da norske og danske trålere fisket over 150 000 tonn på Vikingbanken (ICES, 2020). De påfølgende årene var også fiskeriet relativt godt, men sannsynligvis ble det i hovedsak fisket på 1995-årsklassen. Siden begynnelsen av 2000-tallet har det ikke blitt høstet noe havsil fra Vikingbanken. De årlige tobistoktene siden 2009 viser at bestanden fremdeles er kritisk lav. Biomasseestimatene for Vikingbanken har variert fra under 500 tonn til 12 800 tonn (Figur 6), og ingen sterke årsklasser har rekruttert her siden 1995.
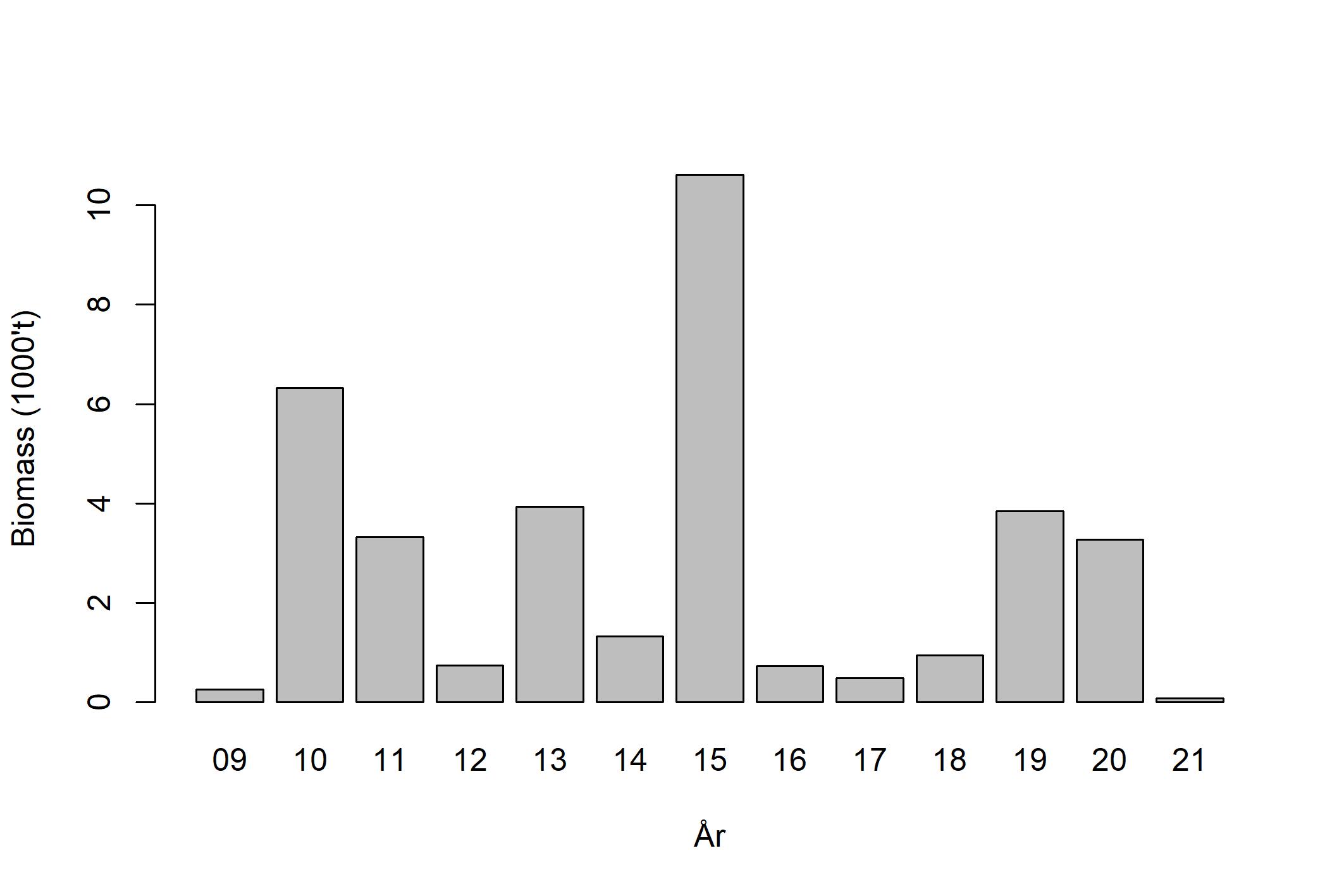
Figur 6 . Estimert biomasse på Vikingbanken (Johnsen, 2021).
Basert på den dårlige bestandstilstanden i nordlige tobisområder har derfor både Havforskningsinstituttet (Johnsen, 2020) og ICES (2019) anbefalt at området forblir stengt for tobisfiske (Tabell 3).
4.4.2 - Sørlige tobisområder
De sørlige tobisområdene inkluderer Nordgyden, AlbjørnLing, som var der det norske tobisfiskeriet startet midt på 1950-tallet, de historisk viktige tobisområdene på Østbanken og Engelsk Klondyke, Outer Shoal, Vestbanken og Inner Shoal (Figur 4). Alle disse områdene var viktige fangstområder frem til slutten av 1990-tallet, men fangstene falt til nær null i perioden fra 2001 til 2006 på disse bankene med unntak av Vestbanken (ICES, 2010; Johannesen & Johnsen, 2015). I denne perioden gjennomførte man ikke noen systematisk toktkartlegging av tobis, men de lave fangstene reflekterer en tilnærmet kollaps i gytebestanden og rekrutteringen av havsil i de sørlige tobisområdene i denne perioden (ICES, 2010; Johannessen & Johnsen, 2015).
Mot slutten av 2000-tallet bedret rekrutteringen seg, og tobistoktet i 2010 avdekket at rekrutteringen av 2009-årsklassen var sterk og hadde rekruttert over store deler av det sørlige tobisområdet. Med en ny forvaltning på plass og en mer restriktiv høsting, ble gytebestanden gradvis større (Figur 7) frem mot 2011, men en svært dårlig rekruttering i 2010, 2011 og 2012 ga bestanden en ny knekk (Figur 8). Det er ofte store lokale forskjeller i rekruttering og tetthet av tobis, men gjennom den norske områdebaserte forvaltningsmodellen har man spredt fiskeriinnsatsen slik at man har sikret en rest-gytebestand. Denne geografiske spredningen av fiske i kombinasjon med et generelt forsiktig uttak har medført at langt flere individer har oppnådd en høyere alder (Figur 8) og gitt en mer stabil høy gytebestand. Da rekrutteringen bedret seg igjen fra 2013-årsklassen har den voksne bestanden bygget seg stadig sterkere og nådde en topp i 2020 (Figur 7). Mengden havsil estimert i 2020 var den høyeste i toktserien (Johnsen, 2020; Figur 7), og sannsynligvis har ikke bestanden vært høyere i dette området siden midten av 1990-tallet (ICES, 2020).
Nå er bestanden relativt godt spredt mellom de ulike tobisbankene (Johnsen, 2020; Johnsen, 2021), og for første gang i toktseriens historie var tre av fire påfølgende årsklasser over middels sterke (Johnsen, 2020). Rekrutteringen av tobis (2019-årsklassen) var historisk sterk, antall toåringer (2018-årsklassen) var over middels høy, og den meget sterke 2016-årsklassen av tobis var fortsatt tallrik som 4-åringer. Derimot var rekrutteringen av 2017-årsklassen meget lav (Figur 8). Av alle tobisbankene i sørlige tobisområder så er det kun Nordgyden (Figur 4) som ikke har hatt en god økning i bestanden. Toktresultatene i 2021 viste en kraftig tilbakegang i biomasse fra toppåret 2020, men fremdeles er bestanden på et høyt nivå (Johnsen, 2021).
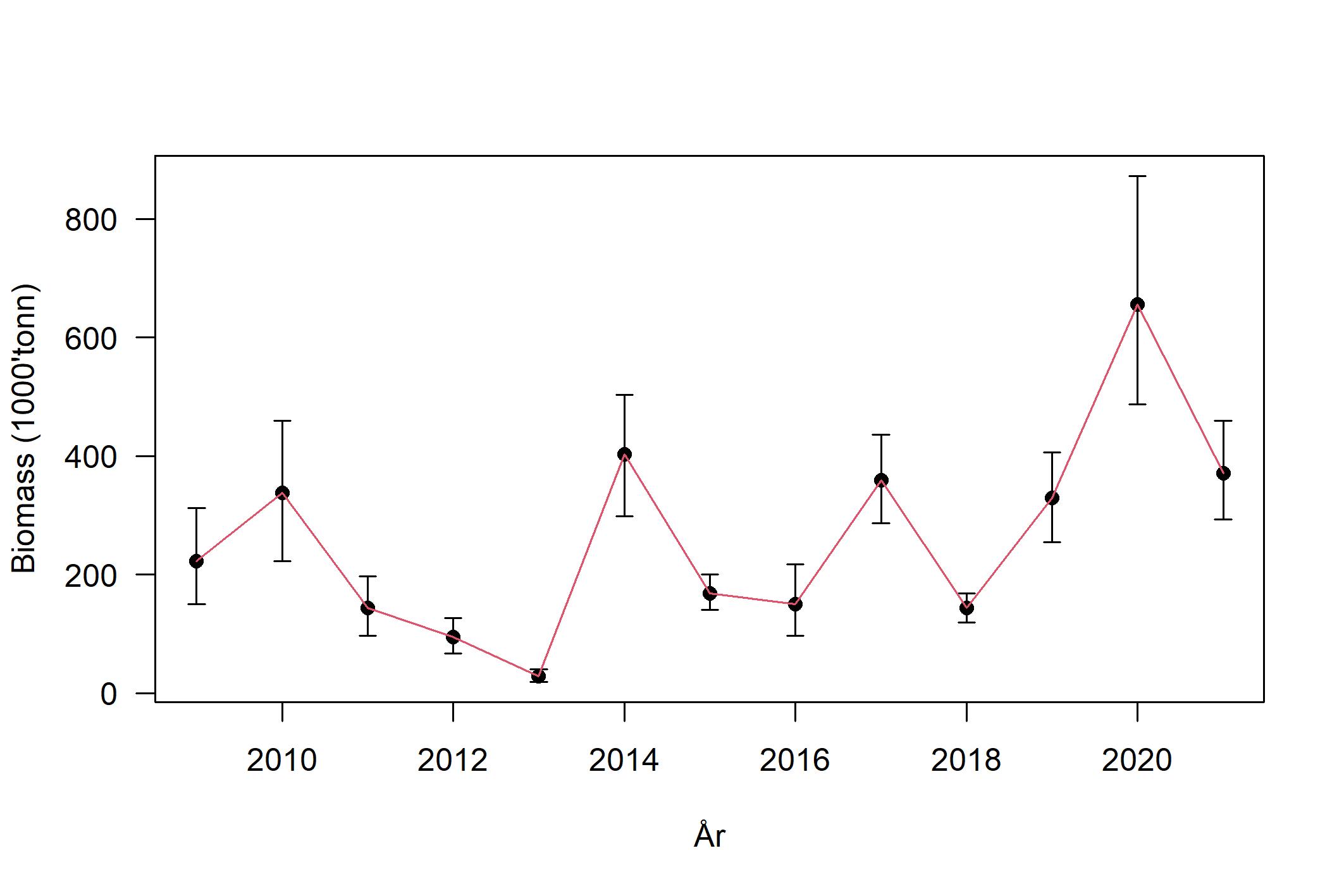
Figur 7. Biomasse estimat med 90% konfidensintervall for sørlige tobisområder (Johnsen, 2021).
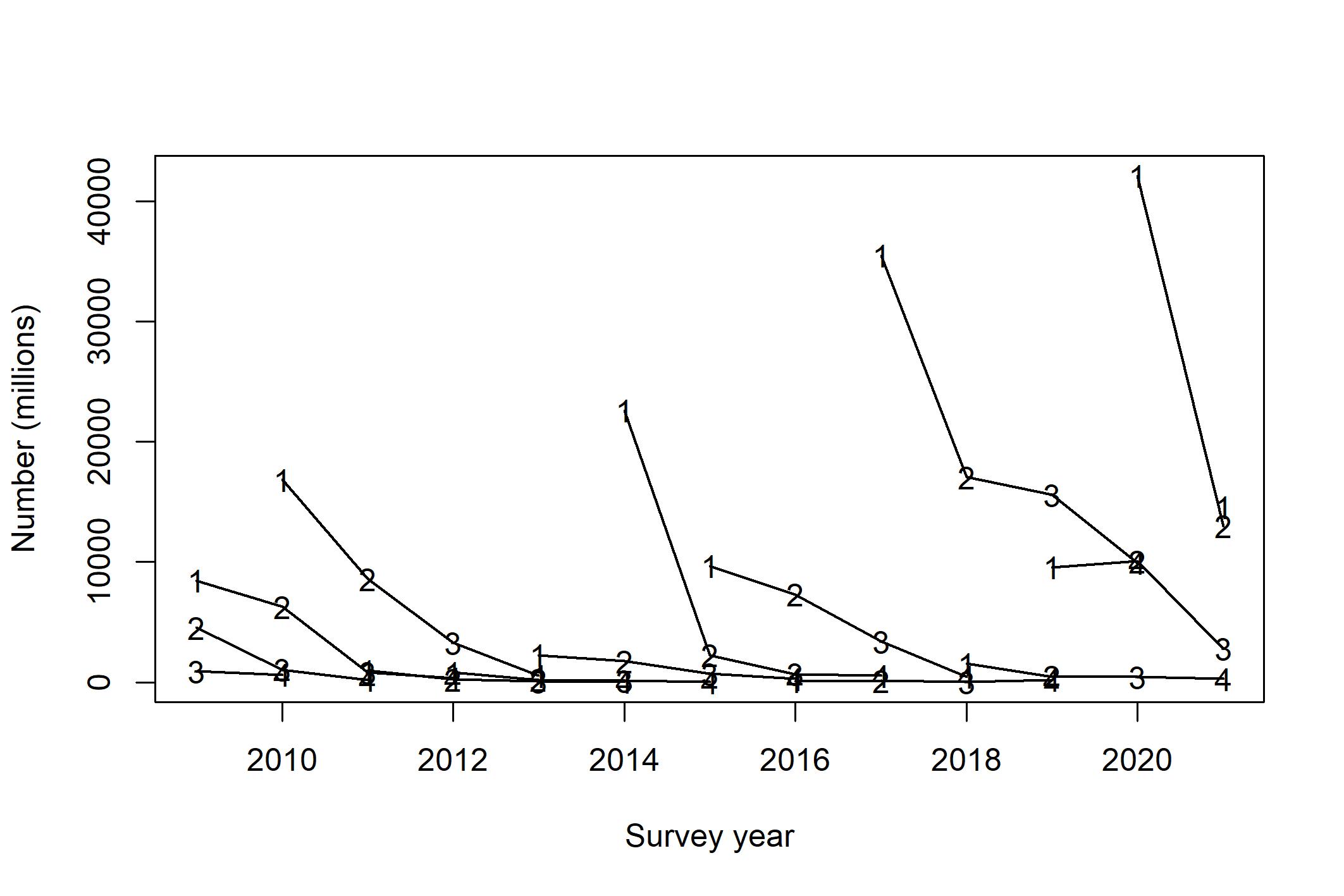
Figur 8 . Estimert antall individer (millioner) per årsklasse (linjer) fra alder 1 til alder 4. Tallene i linjene viser alder på fisken (Johnsen, 2021).
4.4.3 - Kystnære tobisområder
Havsil finnes også langs hele norskekysten og i det sørlige Barentshavet og Kvitsjøen, men i motsetning til i Nordsjøen foreligger det ikke noen fangststatistikk i kystområdene av havsil eller systematisk innsamling av data som kan gi informasjon over historiske bestandsendringer (Bergstad et al., 2013). I tillegg finnes det ikke noen god nasjonal kartlegging av de viktigste kystnære tobisområder, men lokalt finnes sannsynligvis god kunnskap om hvilke områder som har en betydelig havsilbestand siden dette har betydning for tilgjengelighet av større fisk. Allerede i 1762 skriver Hans Strøm at såkalt fiske-lykke egentlig bare er kunnskap om «Hælder» eller «Siil-Støer». Med andre ord så har man lokalt lenge visst at andre arter samler seg på tobisområdene for å spise havsil, og utnyttet denne kunnskapen i kystfiskeriet (Tangen et al., 2016). For å bøte på kunnskapsmangelen om tobis langs kysten har Havforskningsinstituttet i samarbeid med Runde Miljøsenter utviklet målemetoder4 for å kartlegge tobisbestander i grunne og kystnære farvann. I løpet av de neste årene skal man sannsynligvis starte med årlige tokt ved Runde og noen få andre utvalgte områder for å måle endringer i havsilbestanden over tid.
Selv uten en nasjonal helhetlig oversikt viser studier og rapporter at havsil (og til dels småsil) har en stor betydning som byttedyr for sjøfugl, fisk og pattedyr i kystøkosystemet (Bergstad et al., 2013) langs store deler av norskekysten.
I Tanamunningen naturreservat er det godt kjent at havsil er fordelt på flere sandlokaliteter og er et viktig byttedyr for fisk og fugl (Svenning et al., 2005; Sømme & de Ruiter, 2015; Kystverket, 2017; Sevedzem, 2019). Lengre øst i Varangerfjorden er det også dokumentert forekomster av havsil (Ruus et al., 2005).
I de store undersøkelsene av sjøfuglkolonier vet man at havsil inngår som et viktig byttedyr for flere sjøfugler som krykkje, lomvi, alke og lunde. Dette er blant annet rapportert på Hornøya, Troms-Finnmark (Anker-Nilssen et al., 2006), på Anda og Røst, Nordland (Anker-Nilssen et al., 2006), på Sklinna, Trønderlag (Hillersøy, 2011), og Runde, Møre og Romsdal (Hagenlund, 2011).
Lengre sørover finnes det også havsilområder der farvannene rundt Karmøy er mest studert (Bergstad et al., 2011; Bergstad et al., 2002; Høines & Bergstad, 2001). For Sørlandet og Østlandet viser Bergstad et al. (2013) til at sil (småsil og havsil) fanges regelmessig i flere strandnotstasjoner langs hele kysten. I en studie ved Hvaler, Viken ser man også at tobis inngår som en vanlig komponent i dietten hos sel5
På tross av at det ikke foreligger noen god oversikt over historiske endringer av havsilbestandene langs kysten tyder mye på at det generelt har vært en sterk nedgang de siste tiårene. Tangen et al. (2016) viser til at man på Vestlandet regelmessig hadde store forekomster av tobis (sannsynligvis havsil) langs kysten i 1950-1960 årene. Dette ble mer og sjeldent, men i 2019 fikk man en kjemperekruttering av tobis over store deler av kysten mellom fra Ryfylke i sør til Trøndelag i nord 6. Man har også sett mer lokale sterke rekrutteringer7, men inntrykket er at det har skjedd en dramatisk nedgang i havsilbestanden (Tangen et al., 2016).
4.5 - Utveksling av individer mellom områder
Mange studier har vist at voksen havsil ikke forflytter seg mellom tobisbanker etter at individene bunnslår (Kunzlik et al., 1986; Gauld, 1990; Jensen et al., 2011; Johnsen at al., 2017), og selv om merkeforsøk har vist at individer kan forflytte seg opptil 65 km over noen år, er voksen havsil generelt svært stedbunden (Jensen et al., 2011; Johnsen et al., 2017). Eggene som klistres til sand og grus på bunnen under gytingen i desember-februar er også stedbundne. Derimot drifter individene planktonisk i den første perioden av larvestadiet (Figur 9). Larvene vil typisk drifte noe bort fra gyteområdene (Jensen, 2001), og gjennomsnittlig modellert driftsdistanse er mellom 50 og 100 km (Christensen et al., 2008). De larvene som ikke er plassert over tobishabitat der de kan grave seg ned når de er klare for bunnslåing etter ved metamorfosen vil antageligvis bli spist opp da de er sterkt utsatt for predasjon når de ikke lengre er gjennomsiktige (Christensen et al., 2008).
Figur 9. Modellert larvedrift mellom ulike områder i Nordsjøen (fra Christensen et al., 2008).
Ved en kroppslengde på 20-30 mm begynner de å bli mer svømmedyktige og de begynner å samle seg i større konsentrasjoner i produktive områder rundt tobisbankene (Jensen, 2001). Metamorfosen starter når larvene oppnår en lengde på 40-‑55 mm (Wright & Bailey, 1996), og da bunnslår de i de samme tobisområdene som de voksne individene lever i (Macer, 1966; Jensen, 2001; Proctor et al., 1998).
Denne livshistorien tilsier at den største utvekslingen av individer skjer i tidlig larvefase der svømmekapasiteten er dårlig. Det er uklart om larvene aktivt søker spesifikke dybdelag og strømforhold for å begrense drift og dermed holde seg nær gyteområdet i tidlig larvefase. Driftsmodellene av havsillarver inkluderer ikke en slik mulig aktiv vertikalfordeling (Christensen et al., 2008), men selv uten et slikt ledd i modellene tyder modellprediksjonene at larvedriftdistansen fra gyteområde til posisjon for metamorfose generelt er relativt liten og i hovedsak kun noen titalls kilometer (Christensen et al., 2008; ICES, 2010). Det er larvedriften og spredningen fra disse modellene som gir faglig grunnlag for å dele bestanden av havsil inn i ulike ICES tobisområder (ICES, 2010).
Larvedriftsfasen er usikker, og i norsk sone ser det ut til lokal gytebestand er viktig for rekrutteringen innenfor en radius på noen få titalls kilometer (ICES, 2010, Johannessen & Johnsen, 2015). På den andre side viser ikke genetiske analyser noen sterke genetiske forskjeller mellom Runde, sentrale og nordlige Nordsjøen (Jiménez-Mena et al., 2019). En mulig forklaring på en liten genetisk forskjell mellom havsil fra ulike områder er at selv små mengder utveksling av larver kan viske bort genetiske forskjeller. Analyser av mikrokjemiske avsetninger i otolittene er en annen metodikk for å undersøke utveksling av larver mellom områder (Wright et al., 2018). Metoden baserer seg på at man kan sammenligne kjemi i otolittene med kart over kjemi i vannmassene for dermed å spore hvilke områder larvene har oppholdt seg i ved en gitt alder lest fra otolitten (Wright et al., 2018). Denne metoden ønsker man å bruke i norske farvann for å undersøke opprinnelse og forflyttingsmønster av de larvene man fanger på ulike steder i norsk sektor av Nordsjøen og langs kysten av Norge.
I løpet av de siste årene har Havforskningsinstituttet gjennomført flere tokt i Nordsjøen for å undersøke vertikal og geografisk fordeling av tobislarver (Falkenhaug et al., 2016). Disse fordelingene kan potensielt sammenlignes med prediksjonene fra larvedriftsmodellene. Denne valideringsanalysen er ikke gjennomført, og er identifisert som en kunnskapsmangel. Dataene fra disse toktene (Figur 10) viser at det er store forskjeller i fangstratene av tobislarver i ulike områder, men det synes som at mye larver befinner seg i tobisområdene sør i norsk sone.
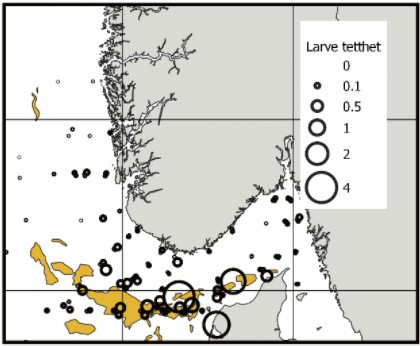
Figur 10. Fordeling av tobislarver fanget i alle planktonhal i perioden 2016, 2017-2020 i Nordsjøen. Tetthet er antall per m3. (se Falkenhaug et al. (2016) for metode).
5 - Sårbarhet
5.1 - Sårbarhet som følge av økt havtemperatur
Flere studier peker på at havsil vil være sårbar for klimaendringer i Nordsjøen grunnet to forhold. For det første vil varmere vann påvirke dyreplanktonsammensetningen. Det er forventet en fortsatt økning i varmekjære arter og en nedgang i forekomst av Calanus finmarchicus (Beaugrand et al., 2002) og dermed redusert mengde egnet dyreplankton for havsil (Van Deurs et al., 2009). Dette vil kunne påvirke både larveoverlevelse, veksthastighet og gytebiomasse av havsil. For det andre vil nedgravd havsil få en høyere metabolisme i varmere vann, noe som medfører redusert sannsynlighet for vinteroverlevelse og lavere mengde energireserve til gyting (Van Deurs et al., 2009; Eliasen, 2013; Henriksen et al., 2021). I tillegg viser Johnsen et al. (2017) at større tettheter med havsil øker stimformasjon og predasjonsunnvikelse, og følgelig vil en generell nedgang i mengde tobis redusere stimstrukturer og den naturlige predasjonsunnvikelsen. Havsilens avhengighet av et passende habitat på relativt grunt vann med bunnsubstrat bestående av oksygenrik grus og grov sand begrenser dens mulighet til å flytte til nye områder. Den er derfor særlig sårbar for større miljøendringer.
5.2 - Sårbare tobisområder
I norsk sone var bestanden av havsil svært lav i begynnelsen og midten av 2000-tallet (Figur 4). Det var kun Vestbanken som hadde en regelmessig rekruttering, men utover dette var gytebestanden kritisk lav og rekrutteringen dårlig. Med en ny nasjonal områdebasert tobisforvaltning på plass tillot man et begrenset fiske i noen få områder (Tabell 3), og kombinasjonen av forbudsområder og lavere høstingsgrad har medført en demografisk endring med flere eldre individer. Forbudsområdene beskytter også mot total lokal nedfisking innen et forvaltningsområde. I norsk sone har man over tid sett en re-etablering av havsil i de norske tobisområdene (Johnsen, 2020). Rekruttering hos havsil varierer sterkt, og er i stor grad naturgitt, men en større og mer spredt gytebestand øker sannsynligheten for en jevnt bedre rekruttering. I tre av de fire siste årene har rekrutteringen vært sterk (Figur 8), og bestanden i norsk sone er definert til å være god i forvaltningsområdene 1, 2, 3 og i sørlige deler av 4 (Figur 5). På Nordgyden og i nordlig del AlbjørnLing (Figur 4) er tettheten av havsil fremdeles lav (Johnsen, 2020). På Vikingbanken (forvaltningsområde 5) er bestanden kritisk lav, og det er usikkert hvordan dette økosystemet som er et viktig gyte- og oppvekstområde for andre fiskearter som torsk, hyse, hvitting, sei, lyr og gapeflyndre (Sundby et al., 2017) påvirkes av at fødetilgangen på havsil er så dårlig.
5.3 - Sårbare livsfaseperioder
Havsil er etter bunnslåing svært stasjonær og lever store deler av tiden nedgrav i oksygenrikt sediment beståendende av grus og grov sand. Behovet for egnet habitat medfører at tettheten av nedgravd havsil varierer svært selv innenfor korte avstander (<100 m) (Johnsen & Harbitz, 2013).
Enhver forringelse av dette sedimentet vil negativt påvirke overlevelsen til de nedgravde individene. Tilsvarende vil redusert oksygen-gjennomstrømming i sanden eller en ytre forurensing kunne medføre en økt dødelighet i eggene som ligger klistret til sedimentene på bunnen. Gytingen foregår i desember-januar, og man har kjennskap fra andre fiskearter at gytesuksess kan reduseres ved at støy påvirker den naturlige gyteadferden. Støy kan også påvirke naturlig svømmeadferd i beitesesongen. I larvefasen fordeler larvene seg i vannsøylen der de beiter på dyreplankton, og larvene vil være sårbare for redusert mattilgang av dyreplankton og forurensning i denne fasen.
| Livsfase |
Hovedperiode |
| Gyting |
Desember-januar |
| Egg i sanden |
Desember-februar |
| Klekking |
Mars-april |
| Spredt larvefordeling |
Mars-april |
| Bunnslåing av yngel |
Mai-juni |
| Beitesesong nullåringer |
Juni-september |
| Beitesesong ettåringer og eldre |
April-juni |
| Overvintring i sand |
August-februar |
Tabell 5. Oversikt over ulike livsfaseperioder.
5.4 - Sårbarhet for ulike påvirkninger knyttet til petroleumsvirksomhet
Oversikt over petroleumsaktiviteten i Nordsjøen viser at tildelte lisenser, letebrønner og rørledninger overlapper med gyteområder for tobis som er definert som særlig sårbare og verdifulle områder (Figur 11). Spesielt stor overlapp i aktivitet fra olje og gassvirksomheten ser vi på tobisområdet på Vikingbanken. Det er tildelt mange lisenser i tobisområder, den siste (TFO 2020) med en lisens som overlapper med Inner Shoal. Dette forteller hvor det i fremtiden kan forventes økt aktivitet. Petroleumsaktivitet medfører også økt intensitet av skipstrafikk (Figur 12). Aktivitetene innebærer risiko for påvirkning både fra operasjonelle og akutte utslipp, samt forstyrrelser som bunnpåvirkning og støy. Vi ønsker å belyse kunnskapsstatus med hensyn på sårbarheten til havsil for ulike typer påvirkninger fra petroleumsaktiviteten i dette kapittelet.
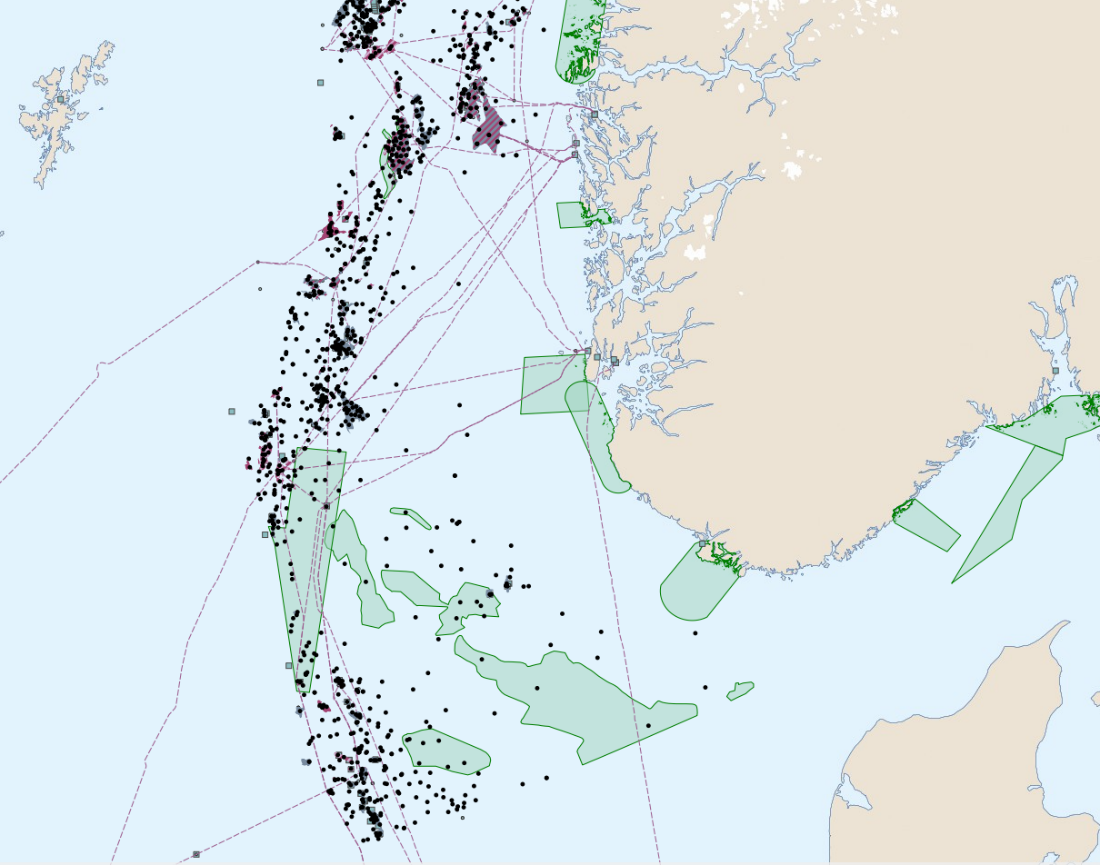
Figur 11. Kart over SVO områder i Nordsjøen (grønn farge) sammenstilt med petroleumsaktiviteter (felt, installasjoner, rørledninger og letebrønner) (Barentswatch.no).
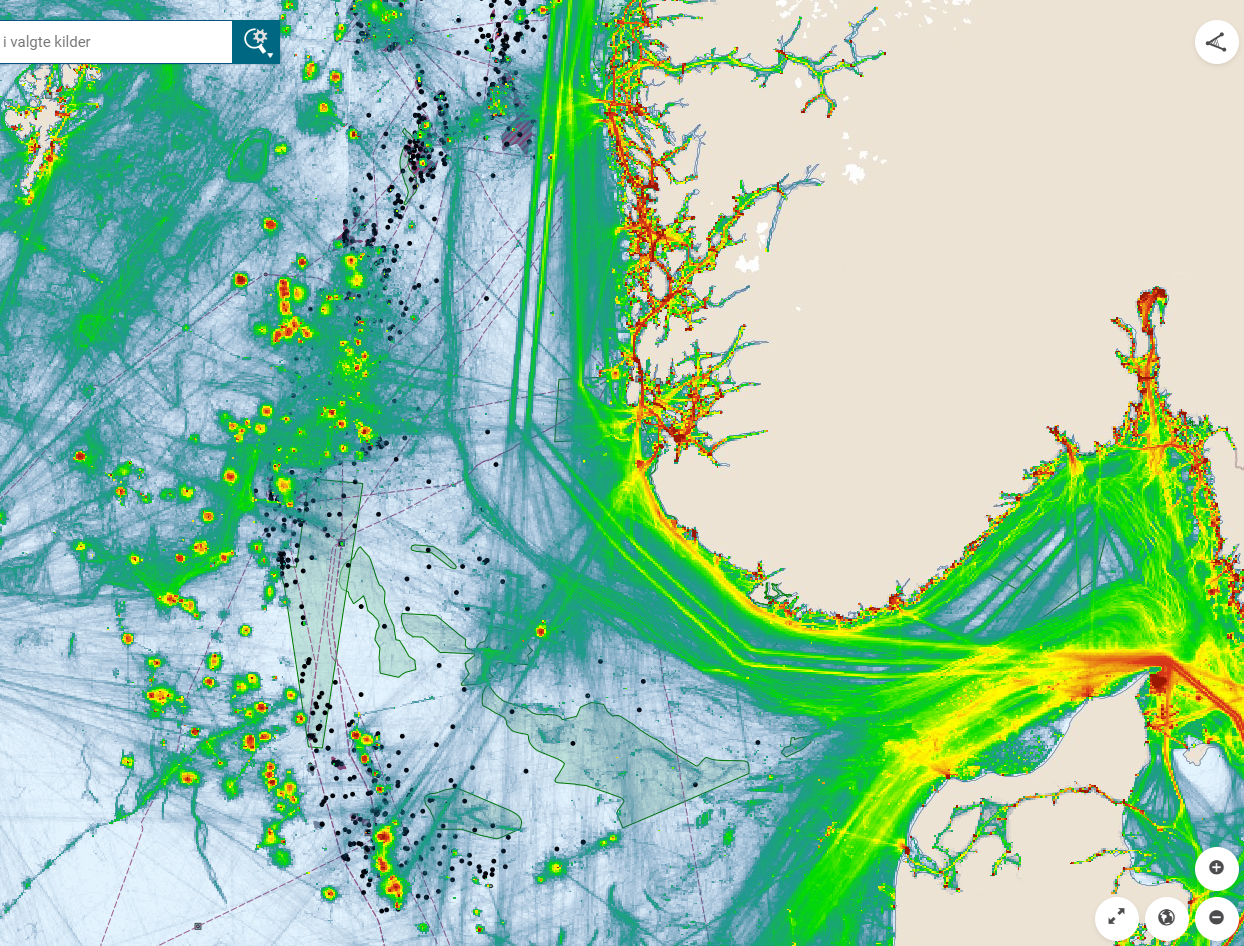
Figur 12. Kart over SVO områder i Nordsjøen sammenstilt med petroleumsaktiviteter (felt, installasjoner, rørledninger og letebrønner) og akkumulert skipstrafikk i 2019 (Barentswatch.no).
5.5 - Sårbarhet for bunnpåvirkning
Havsilhabitatene består av områder med bunnsediment med grov sand eller fin grus med lavt innslag av leire og silt med gode oksygenforhold. Bunnpåvirkning som medfører mindre mengde oksygen nær eller i bunnen vil redusere leveforholdene til havsil. Dette er erfart i kystnære områder (Behrens et al., 2009). I de norske områdene av Nordsjøen vil avsetninger av kjemisk forurensing på havbunnen eller borekaks, graving eller grøfting eller utplassering av større installasjoner være aktuelle problemstillinger. Ved installering av en større offshore vindpark fant man en kortvarig positiv bestandsutvikling for flere arter tobis, antageligvis som en konsekvens av mindre innslag av silt og leire i habitatet, men på litt lengre sikt forsvant den positive effekten og det så ut som mengden yngel sank i vindparkområdet sammenlignet med kontrollområdet uten at man klarte å forklare årsaken (Van Deurs et al., 2012). Fysisk aktivitet som graving og grøfting på havbunnen i havsilhabitatet kan medføre forringelse av habitatet og drepe nedgravd havsil og eggene som ligger på bunnen. Denne type inngrep vil sannsynligvis ha størst negativ effekt om vinteren mens individene ligger i dvale.
5.6 - Sårbarhet for operasjonelle utslipp
Utslipp av produsertvann og produksjonskjemikalier fra norsk og britisk sektor utgjør det største regulære utslippet i Nordsjøen. Tabell 6 viser tall for utslipp av produsertvann og kjemikalier fra Tampen-regionen og sum for hele norsk sokkel i 2020. Produsertvann inneholder svært mange forbindelser inkludert benzene, toluen, etylbenzen og xylen (BTEX), polysykliske aromatiske hydrokarboner (PAH), tungmetaller og produksjonskjemikalier. PAH profilen til produsertvann består hovedsakelig av 2- og 3-rings PAH (Meier et al., 2020; Nepstad et al., 2021). Norske utslipp av produsertvann utgjør ca 130 mill m3 per år og tilsvarte årlige utslipp på 1600-1800 tonn dispergert olje i perioden 2012-2016 (NOROG, 2020; OSPAR 2018a). I 2020 tilsvarte produsertvannsutslippet 1548 tonn olje. Utslippet fra Tampen-regionen utgjør ca 53 % av norske produsertvannsutslipp og tilsvarer 828 tonn olje (Tabell 6).
| Felt |
Produsertvann til sjø (m3) |
Olje til sjø fra produsertvann (tonn) |
Kjemikalieutslipp svarte stoff (tonn) |
Kjemikalieutslipp røde stoff (tonn) |
Kjemikalieutslipp gule stoff (tonn) |
Kjemikalieutslipp grønne stoff (tonn) |
| BRAGE |
4482469 |
45,93 |
0,02 |
11,76 |
100 |
128 |
| GULLFAKS |
22667004 |
290,77 |
0,03 |
2,52 |
3881 |
14040 |
| GULLFAKS SØR |
0 |
0,06 |
|
0,16 |
21 |
1331 |
| KVITEBJØRN |
0 |
0 |
0,38 |
1,24 |
1 |
2 |
| OSEBERG |
915048 |
12,77 |
0 |
31,52 |
262 |
2399 |
| OSEBERG SØR |
30993 |
0,97 |
|
11,55 |
28 |
208 |
| OSEBERG ØST |
0 |
0 |
|
4,37 |
1 |
136 |
| STATFJORD |
26092733 |
403,88 |
|
33,22 |
1113 |
4455 |
| VALEMON |
0 |
0 |
|
|
39 |
78 |
| VESLEFRIKK |
2683573 |
66,77 |
0,11 |
0,76 |
1 |
2 |
| VISUND |
514730 |
7,04 |
0 |
2,23 |
47 |
1209 |
| VISUND SØR |
0 |
|
|
|
1 |
78 |
| Sum Tampen |
57386549 |
828 |
0,54 |
99 |
5497 |
23995 |
| Hele norsk sokkel |
126347509 |
1548,00 |
7,06 |
408,00 |
14605 |
132515 |
Tabell 6. Utslippstall for operasjonelle utslipp på Tampen-regionen og samlet tall for norsk sokkel i 2020. Kilde: Miljødirektoratet.
Gjennomsnittlig strømmønster i Nordsjøen for april i perioden 1998-2008 viser at Vikingbanken ligger nedstrøms utslipp av produsertvann fra Tampen (Figur 13). Modelleringsstudier viser at produsert vann fra olje- og gassplattformer i området ved Vikingbanken og Tampen kan overstige sumPAH nivå på 20 ng/L (ppt) og at strømmønsteret også kan gå nordover fra Vikingbanken (Nepstad et al., 2021). Vi viser til kapittelet 5.6.4 under om terskelverdier for effekter fra andre arter. I dag er terskelverdi for ingen effekt på hyseembryo <10 ppb olje (Cresci et al., 2020). Hvis dette blir omregnet til sum PAH blir terskelverdien ca 0,1 ppb (100 ppt), avhengig av hvor stor andel PAH utgjør av oljen. Terskelverdi for oljepåvirkning av hyseembryoer er derfor 5 ganger høyere enn de nivåene som er blitt modellert fra produsertvannsutslipp på Vikingbanken (Nepstad et al., 2021). Vi mangler tilsvarende terskelverdier for havsil.
Utslipp på britisk sektor er oppgitt til å være ca 155 mill m3 per år. Dette utgjorde årlige utslipp på 2000-2400 tonn dispergert olje i perioden 2012-2016 (OSPAR, 2018b), men vi mangler informasjon om hvor stor del av produsertvannutslippet som kommer fra britisk sektor ved Tampenområdet.
Utfelling av oljekomponenter og kjemikalier fra regulære utslipp av produsertvann fra oljeproduksjon vil kunne påvirke tilstanden til disse habitatene. Kilden til den økte eksponeringen i dette området stammer mest sannsynlig fra utfelling av oljekomponenter fra produsert vann og/eller tidligere avsatt borekaks med oljebasert borevæske (Bakke et al., 2013). Hyse er en bunntilknytta fiskeart med bunndyr, skjell og småfisk på menyen, noe som gjør den ekstra utsatt for forurenset bunnsediment.
Økte nivåer av DNA-addukter, endret fettsyreprofil og PAH-metabolitter i galle ble funnet i villfanget hyse i Tampen området i 2002 (Balk et al., 2011). Tilstandsovervåkingen fra 2011 viste at både hyse fra Tampen og fra Vikingbanken hadde nivå av DNA addukt i leveren over EAC (Environmental Assessment Criteria) (Grøsvik et al., 2012). Tilsvarende høye nivå av DNA addukt i lever fra hyse, torsk og sei ble rapportert fra vannsøyleovervåkingen fra Tampen i 2019 (Pampanin et al., 2019). Nivåer høyere enn EAC indikerer miljørisiko og oppfølgende studier bør gjennomføres (Davies & Vethaak, 2012).
Stagg & McIntosh (1996) observerte en økning i nivåer av hydrokarboner i den nordlige Nordsjøen (5-10 ganger høyere enn bakgrunn) og økt enzymaktivitet av 7-Ethoxyresorufin O-deethylase (EROD) ble målt i prøver av havsillarver og larver av torskefisk.
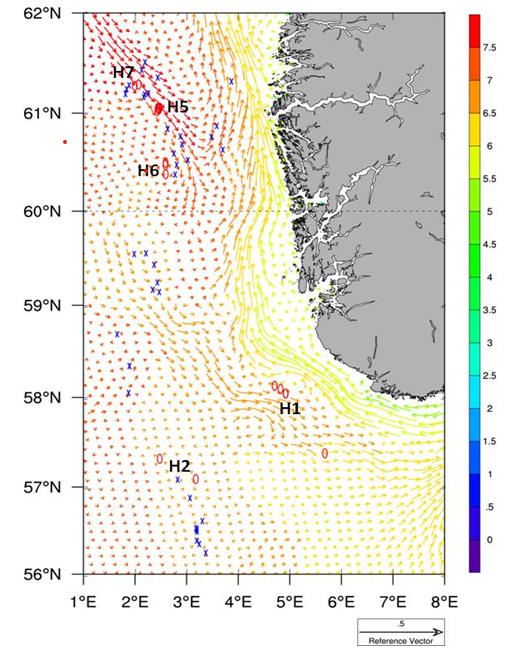
Figur 13. Gjennomsnittlig strømmønster i april i perioden 1989-2008 basert på ROMS modell med 4x4 km oppløsning. Strømmønster gitt ved 20 m dyp. Farger viser temperatur i °C. Blå kryss viser olje- og gass installasjoner. H1: Egersundbanken, H2: Ula området, H5: Tampen sør, H6: Vikingbanken, H7: Tampen mellom Statfjord og Gullfaks. Figur fra Grøsvik et al. (2012).
Nye feltstudier viser at dyreplankton (Calanus sp.) fra områder med høy oljeaktivitet har høyere innhold av oljekomponenter (Hansen et al., 2020). Fettrike kopepoder fra Calanus-slekten har sakte nedbrytning av oljekomponenter. Dette utgjør dermed en potensiell fare for videreføring av oljekomponenter oppover i næringspyramiden (Agersted et al., 2018). Havsil er storkonsument av fettrikt dyreplankton (Van Deurs et al., 2009). Oral eksponering over tid vil blant annet kunne føre til endret lipidsammensetning (Balk et al., 2011), gi økt mengde DNA addukter (Meier et al., 2020) og kunne gi irreversible effekt på DNA (Wells et al., 1997).
Nanopartikler
Vi mangler kunnskap om operasjonelle utslipp fra olje- og gassindustrien inneholder nanopartikler. Nanopartikler er definert av EU som partikler med størrelse mindre enn 100 nm i minst en dimensjon. På grunn av størrelsen vil slike partikler ha et stort forhold mellom overflateareal og volum. Dette gjør at partiklene har ulik reaktivitet per vektenhet i forhold til større partikler eller enkelt-ioner/molekyl av samme forbindelse. Derfor vil også nanopartikler kunne ha ulik fare, toksisitet og risiko. Negative effekter av nanopartikler har blitt vist i ulike organismer som evertebrater, fisk og pattedyr, men det er fortsatt store kunnskapshull både om forekomst, fordeling, farer, risiko, toksisitet og eksponering i forhold til nanopartikler. Havforskningsinstituttet jobber med utvikling av analysemetoder for påvisning og kvantifisering.
5.7 - Sårbarhet for olje
Det er svært få publiserte artikler om eksperimentelle studier av oljeeksponering på havsil. Vi må derfor basere kunnskapen vår på det vi vet om andre arter. Prosjekter som gir bedre kunnskap om havsil sin følsomhet for slik påvirkning gjennom ulike livsstadier er ønsket for å kunne gi bedre råd om mulige effekter og bedre grunnlag for risikovurdering for slik type påvirkning.
5.7.1 - Tidlige livsstadier av fisk er spesielt sårbare for oljeeksponering
Tidlige livsstadier av fisk dvs egg- og larvestadiet, er mest sårbare for oljeforurensning. Et høyt overflate til volum forhold fører til større relativ eksponering for disse stadiene (Incardona & Scholz, 2017). Tidlige livsstadier har også mye lavere metabolsk aktivitet i forhold til voksen fisk, og oljekomponenter akkumuleres i organismen (Sørhus et al., 2021; Incardona & Scholz, 2017). Dette betyr at fiskeembryo som er eksponert for svært lave mengder olje (>30 µg olje/L) kan oppnå høye vevskonsentrasjoner (Sørhus et al., 2021) og kan biokonsentrere oljekomponenter opp til 100 000 ganger i løpet av 3 til 6 dager (Petersen & Kristensen, 1998). I tillegg vil både korte og lengre eksponeringer under tidlig utvikling (f.eks. når organer blir dannet) kunne påvirke cellesignalisering og føre til irreversible deformiteter (Incardona et al., 2017). Typiske deformiteter er ødemdannelse, kjeve-, øye-, ryggmargs- og hjertedeformiteter (Incardona & Scholz, 2017). Hjertet er spesielt sårbart for oljeeksponering, og oljekomponenter kan direkte påvirke hjertefunksjonen (Brette et al., 2014), samt forstyrre cellesignaler som er viktige for utviklingen av hjertet (Incardona et al., 2017). Blodsirkulasjon er viktig for å tilføre oksygen og næring til celler og organer. Det er derfor mange nedstrømseffekter av dysfunksjonell hjertefunksjon, som for eksempel utilstrekkelig transport av lipider fra plommesekken (Laurel et al., 2019; Sørhus et al., 2017) og nedsatt svømmeevne (Cresci et al., 2020; Incardona et al., 2015). Eksponering for svært små mengder olje (ned til 10 µg olje/L) på embryostadiet gav ingen synlige deformiteter, men påvirket svømmeevne i senere stadier av både hyse (Melanogrammus aeglefinus) og Stillehavssild (Clupea pallasii) (Cresci, 2020; Incardona, 2015). Redusert svømmeevne vil kunne få konsekvenser for overlevelse i naturen hvor individene er utsatt for predatorer og har begrenset adgang på føde (Heintz et al., 2000; Heintz et al., 2007).
5.7.2 - Artssensitivet
Noen arter er mer sårbare for oljeeksponering enn andre. Hyse og polartorsk har begge et klistrete eggeskall (Sørhus et al., 2015; Laurel et al., 2019). Det karakteristiske eggeskallet fører til at oljedråper i vannsøylen kan adsorbere til skallet, og gjør artene opp mot 10 ganger mer sårbare enn andre lignende arter (Sørensen et al., 2017). Oljedråper på eggeskallet gir både en økt lokal konsentrasjon og overføring av mer høymolekylære oljekomponenter til embryoet (Sørensen et al., 2017), samt forlenger eksponering ved overføring til rent vann (Sørhus et al., 2016). Dermed vil kort eksponering for relativt lave konsentrasjoner (for eksempel 72 timer i 300 µg olje/L) føre til store konsekvenser (Sørhus et al, 2021). Havsil har også et klistrete eggeskall slik at eggene kan klistre seg til den grove sanden etter fertilisering (Proctor et al., 1998). Men det er ikke undersøkt om havsileggene også akkumulerer oljedråper på samme måte som hyse eller polartorsk. Vi mangler også kunnskap om eventuell varighet av dette. For eksempel er overflaten til hyseeggene mindre klistrete mot slutten av eggstadiet (Sørhus et al., 2021).
Genetisk slektskap kan gi indikasjon om hvilke arter som er mest naturlig å sammenligne sårbarhet med, på samme måte som biologiske tilpasninger kan indikere slik likhet. Sammenligninger av sekvensdata fra mitokondrielle genom fra utvalgte fiskearter viser at flyndrefisk ( Pleuronectes og Limanda ) og stingsild ( Gasterosteus ) er nærmest beslektet med silfamilien, og at laksefisk og lodde er nærmere beslektet enn sild, torskefisk og sebrafisk ( Danio rerio ) (Figur 14).
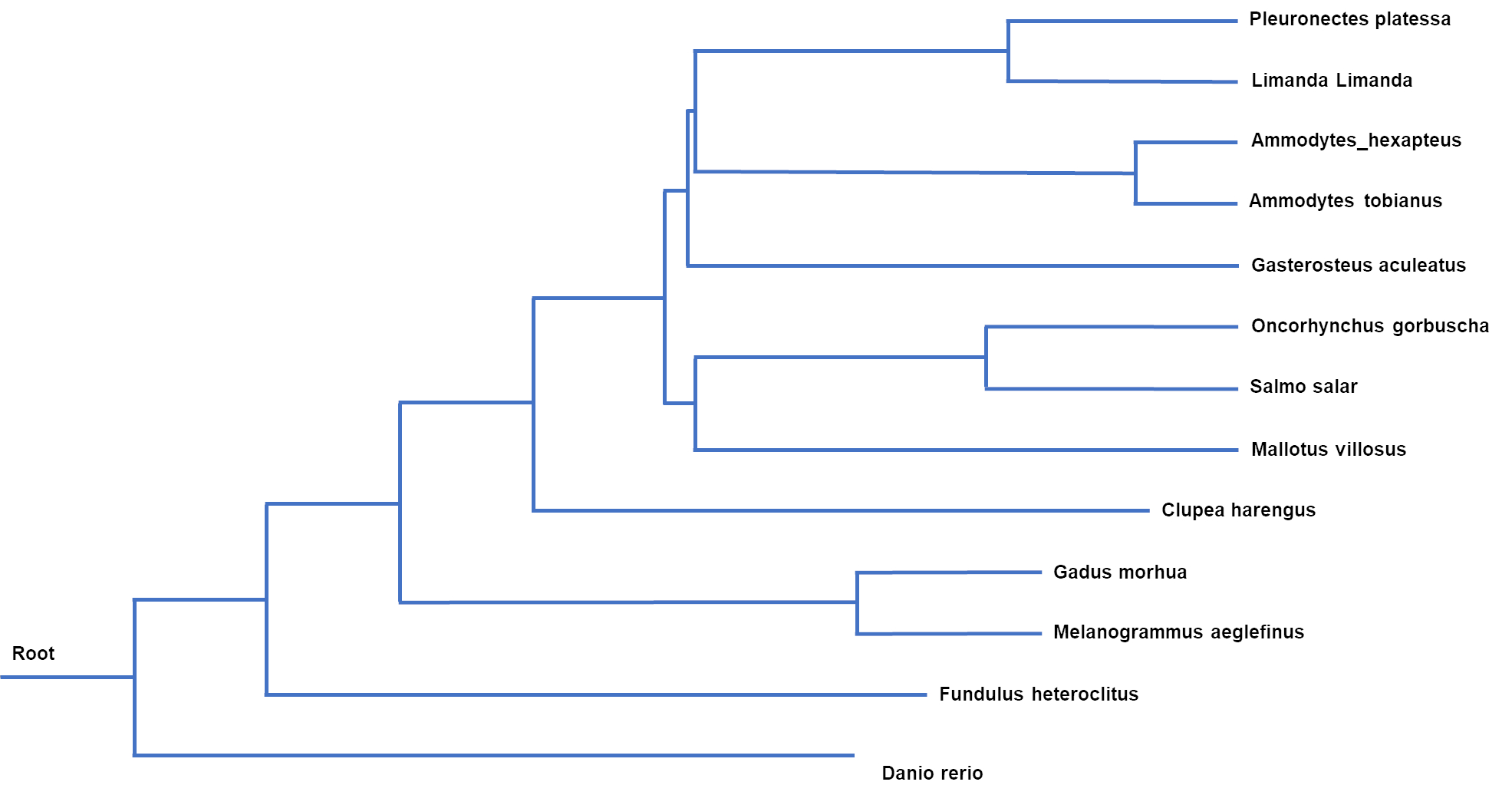
Figur 14. Fylogenetisk tre fra utvalgte arter basert på mitokondrielle genomsekvenser.
5.7.3 - Eksempler fra akutte oljeutslipp
Akutte oljeutslipp i gyteområder med høye konsentrasjoner av tidlige livsstadier av fisk kan gi effekter i lang tid. En overraskende konsekvens av Deep Water Horizon ulykken i 2010 var dannelsen av marin oljesnø. Store mengder olje ble felt ut sammen med organiske og uorganiske partikler og dekket havbunnen i store områder. Langtidskonsekvensene for disse bunnhabitatene er fremdeles uavklarte (Daly et al., 2016).
I 1989 gikk Exxon Valdez på grunn utenfor Prince William-sundet som er gyteområde for Stillehavssild (Clupea pallasi) og Stillehavslaks (Oncorhynchus gorbuscha). Dette fikk store konsekvenser for gyteprodukter for flere arter det året (Brown et al., 1996, Carls et al., 1996, Wertheimer et al., 1996, Willette et al., 1996), og økt dødelighet i gyteproduktet til Stillehavslaks ble observert 4 år etter hendelsen (Bue et al., 1996; Bue et al., 1998). Dødelighet flere år etter skyldtes mest sannsynlig at olje nedgravd i sanden ble skylt ut med tidevannet over tid (Bue et al., 1998). Først et tiår etter oljeutslippet ble det observert tegn til at elvene var restituert eller på vei til å bli restituert (Carls et al., 2004). På lik linje med Stillehavslaksen legger havsil eggene i sand i spesifikke områder (Proctor et al., 1998). Disse habitatene er derfor svært sårbare for eksponering fra akutte oljeutslipp. Det ble påvist en nedgang i populasjonen av Beringteist (Cepphus columba) i olje-påvirkete områder etter Exxon Valdez ulykken, mens populasjonen økte i ikke-påvirkete områder. Økte nivå av flere enzymaktiviteter (inkludert CYP1A) indikerte påvirkning på populasjonen 10 år etter ulykken, selv om redusert tilgjengelighet av silarten sand lance (Ammodytes hexapterus), et foretrukket byttedyr også kan ha spilt en rolle (Golet et al., 2002). Dette kan indikere økosystemeffekter, men vi mangler direkte bevis for dette.
Havsil er spesielt tilknyttet egnet bunnhabitat (Wright et al., 2000). Laboratoriestudier viser at en beslektet art, Pacific sand lance (Ammodytes hexapterus), tolererer høye konsentrasjoner olje før de bytter til ugunstige habitat. I tillegg oppholdt fisken seg i kortere perioder i forurenset sand (Pinto et al., 1984; Pearson et al., 1984), noe som kan bidra til å gjøre dem mer utsatte for predatorer.
5.7.4 - Terskelverdier fra andre arter
Kunnskapsgrunnlaget for havsil sin sårbarhet til påvirkning fra olje- og gassvirksomheten er svært begrenset. Vi mangler kunnskap om konsekvensene av eksponering for kjemikalier og oljekompenter på ulike livsstadier. Eksponering under organdannelsen (embryo-fasen) har vist seg å kunne gi irreversible konsekvenser (Sørhus et al., 2016; Sørhus et al., 2021). Men dersom eggeskallet begrenser eksponering, kan for eksempel larvefasen være mer sårbar enn eggfasen der hele kroppen er eksponert. I larvefasen kan en også bli eksponert via fødeopptaket.
Siden eggeskallet til havsil er klistrete er det mulig at eggene kan akkumulere oljedråper på eggeskallet på liknende måte som hyseegg. I hyse ble det observert signifikante morfologiske effekter etter eksponering for 30 µg olje/L (30 ppb) i kun 72 timer på tidlig embryostadie (Sørhus et al., 2021). Studier av atferdsendringer har vist at så lite som 10 µg olje/L (10 ppb) i 10 dager i embryofasen kan føre signifikante endringer i atferd i larvestadiet (Cresci et al., 2020).
Inntil vi får data fra forsøk med havsil bør en derfor bruke grenseverdier fra andre ekstra sårbare arter til risikovurderinger. I dag er terskelverdi for ingen effekt på hyseembryo <10 ppb olje. Hvis dette blir omregnet til sum PAH blir grenseverdien ca 0,1 ppb (100 ppt), avhengig av hvor stor andel PAH utgjør av oljen. Dette er 5 ganger høyere enn det som er modellert for produsertvannsutslipp på Vikingbanken (Nepstad et al., 2021).
5.8 - Sårbarhet for lyd og rystelser
Støy fra impulsive lydkilder, som pæling og seismikk, kan skade fisk direkte, og føre til skader i svømmeblære, lever og hørselsorganet, men bare svært nært selve lydkilden (Popper et al., 2014). Ved større avstander kan imidlertid adferden til fisk bli påvirket (Herbert-Read et al., 2017). For seismikk er det for eksempel vist at fisk forflyttet seg i et område på 33 km (18 nautiske mil), med varighet på minimum fem dager etter avsluttet seismikkskyting (torsk og hyse; Engås et al., 1996). Dette resultatet støttes også av tidligere fangstforsøk (Soldal & Løkkeborg, 1993; Løkkeborg & Soldal, 1993).
Kontinuerlig støy, som skipsstøy, kan påvirke fisk både fysiologisk og atferdsmessig (de Jong et al., 2020). Skipstøy kan påvirke reproduksjon, beiteadferd og unnvikelse av predatorer hos fisk (Nedelec et al., 2016; Simpson et al., 2016; Magnhagen et al., 2017), og kontinuerlig lavfrekvent støy kan muligens også ha en større påvirkning på reproduksjon hos fisk enn impulsiv støy (de Jong et al., 2020). Teoretisk er det også mulig at maskering av naturlig lyd kan påvirke orienteringsevnen til fisk hvis de bruker lyd til å orientere seg i forhold til omgivelsene (Slabbekoorn & Bouton, 2008).
Det er gjennomført en studie med havsil (Hassel et al., 2004), hvor videoopptak viste irregulær svømming og noe alarmrespons i respons til seismikk 5 km fra lydkilden. Man så også at haleslagfrekvensen økte når seismikkfartøyet var nært, og sank til normalnivå igjen etter passering (Hassel et al., 2003). Derimot ble det ikke påvist at havsil gravde seg ned i sanden, som var hypotesen i forkant av undersøkelsen. Faktisk ble fisken observert å stå høyere oppe i vannsøylen under eksponering sammenliknet med observasjoner gjort i forkant av eksponering (Hassel et al., 2003). Studien ble utført med fisk i et bur, hvor burets tak begrenset hvor høyt fisken kunne komme. Derfor er det er ikke mulig å si om den alarmresponsen ville ha ført til unnvikelse hvis de hadde mulighet til det. Da seismikkfartøyet nærmet seg fra avstand, ble lyden fra seismikkskytingen gradvis høyere, slik at fisken til en viss grad kan ha blitt tilvendt før den ble eksponert for den kraftigste lyden.
Det ble observert en nedgang i fangster etter seismikkskytingen, men siden nedgangen skjedde rundt 17. mai er det ikke sikkert at dette var et resultat av unnvikelse eller om det skyldes redusert fiskeriaktivitet på grunn av at fiskemottakene var stengt på nasjonaldagen.
Studiet sier heller ikke noe om eventuelle langtidseffekter, da observasjoner ble avsluttet relativt kort tid etter seismikkskytingen var avsluttet. Dette studiet er derfor ikke entydig i forhold til å konkludere med hvordan seismikk påvirker havsil, men det tyder på at seismikk ikke fører til umiddelbar dødelighet/skader eller at fisken flykter ned i sanden. Imidlertid kan de observerte adferdsendringene antyde at fisk som ikke er fanget i et bur vil svømme vekk. For havsil som er en svært stedbunden art, vil en forflytning som fører den bort fra sitt område potensielt være av vesentlig betydning dersom forflytningen er varig eller skjer i en viktig periode som under gyting.
Selv om vi vet fra Hassel et al. (2004) at havsil kan høre seismikk på 5 km avstand, og generelt at fisk hører best under 500 Hz (Popper et al., 2014), vet vi lite spesifikt om hørsel hos havsil. Det finns en studie som sammenligner to Ammotydes arter som ikke forekommer i Norge, Ammotydes americans og Ammotydes personatus (Figur 15). Disse artene hadde en veldig ulik terskel for hørsel under 500 Hz; mens, A. personatus hørte bedre ved lave frekvenser, hørte A. americans best rundt 300 Hz. Dette viser at det muligens er stor variasjon i hørsel mellom artene innad i Ammodytes familien. Derfor er det nødvendig å teste hørsel i artene som er av interesse for å finne ut hvilken lyder de kan høre best.
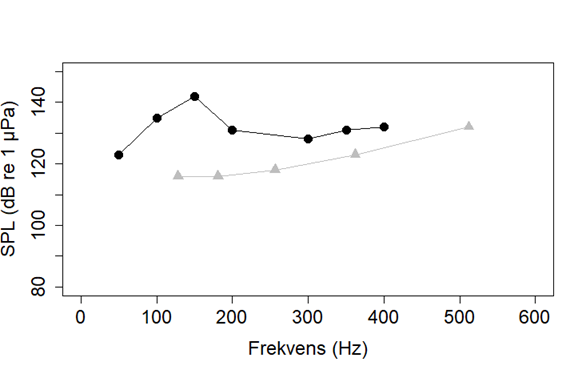
Figur 15. Hørselsterskler for Ammodytes americans (svart) og Ammotydes personatus (grå). Lyd som er høyere enn terskelen kan høres. Leg merke til at lydnivå under vann har en annen referanseverdi enn lydnivå over vann, og dB-verdier kan derfor ikke sammenlignes med dB-verdier i luft. Figur er basert på data fra Suga et al. (2005) og Strobel & Mooney (2012).
Det er også ukjent om tobis bruker lyd til gyting eller annen adferd. Spesielt kontinuerlig støy kan maskere både signaler som fisk bruker til kommunikasjon og viktige signaler fra omgivelsene, som, for eksempel, lyd forårsaket av bevegelser fra predatorer eller byttedyr. For å forutsi hvor sensitiv tobis kan være for støypåvirkning er det viktig å vite i hvor stor grad de bruker lyd til adferd som kan føre til endringer i populasjoner, som gyteadferd, beiting, og unnvikelse av predatorer (de Jong et al., 2020).
Havforskningsinstituttet fraråder seismikkskyting i gyteområder for å unngå at unnvikelse på grunn av støy kan føre til effekter på populasjonsnivå (Sivle et al., 2021). Arter som har en helt spesifikk bunntilknytning, som havsil, anses som særlig sårbare, da en mulig forflytning på 20 nmi kan føre dem bort fra dette spesifikke bunnhabitatet og dermed forhindre gyting (Sivle et al., 2021). Siden havsil er tilknyttet områdene hele året, kan det være viktig også i resten av året å unngå lengre støyperioder som kan føre til at de forflytter seg definitivt. Det er imidlertid ikke kjent om havsil kan venne seg til støy etter hvert.
7 - Referanser
Anker-Nilssen, T., Barrett, R.T., Bustnes, J., Erikstad, K., Fauchald, P., Lorentsen, S., Steen, H., Strøm, H., Systad, G.H., Tveraa, T. 2007. SEAPOP studies in the Lofoten and Barents Sea area in 2006. Norsk Institutt for Naturforskning. 63 p. NINA rapport (249).
Agersted, M.D., Møller, E.F., Gustavson, K., 2018. Bioaccumulation of oil compounds in the high-Arctic copepod Calanus hyperboreus. Aquat. toxicol. 195, 8-14.
Bakke, T., Klungsøyr, J., Sanni, S., 2013. Environmental impacts of produced water and drilling waste discharges from the Norwegian offshore petroleum industry, Mar Environ Res 92, 154-169.
Balk, L., Hylland, K., Hansson, T., Berntssen, M. H. G., Beyer, J., Jonsson, G., Melbye, A., Grung, M., Torstensen, B. E., Borseth, J. F., Skarphedinsdottir, H., Klungsøyr, J., 2011. Biomarkers in Natural Fish Populations Indicate Adverse Biological Effects of Offshore Oil Production. Plos One 6.
Beaugrand, G., Reid, P.C., Ibañez, F., Lindley, J.A., Edwards, M. 2002. Reorganization of North Atlantic Marine Copepod Biodiversity and Climate. Science (New York, N.Y.). 296. 1692-4. 10.1126/science.1071329
Behrens, J. W. B. W., Ærtebjerg, G. Æ., Petersen, J. K. P. K., and Carstensen, J. C. 2009. Oxygen deficiency impacts on burying habitats for lesser sandeel, Ammodytes tobianus, in the inner Danish waters. Canadian Journal of Fisheries and Aquatic Sciences. 66(6): 883-895.
Bergstad, O.A., Høines, Å.S. and Krüger-Johnsen, E.M., 2001. Spawning time, age and size at maturity, and fecundity of sandeel, Ammodytes marinus, in the north-eastern North Sea and in unfished coastal waters off Norway. Aquatic Living Resources, 14(5), pp.293-301.
Bergstad, O. A., Hoines, A. S., and Jorgensen, T. 2002. Growth of sandeel, Ammodytes marinus, in the northern North Sea and Norwegian coastal waters. Fisheries Research, 56: 9–23.
Bergstad, T.A., Johannessen, T., Nilssen, T.A., Barrett, R.T. 2013. Fagrapport for tobis (Ammodytidae) på norskekysten - Miljødirektoratet. M5-2013. Pp 20 . https://www.miljodirektoratet.no/publikasjoner/2013/juli-2013/fagrapport-for-tobis-ammodytidae-pa-norskekysten/
Boer, M. N. de. 2010. Spring distribution and density of minke whale Balaenoptera acutorostrata along an offshore bank in the central North Sea. Marine Ecology Progress Series, 408: 265–274.
Boulcott, P., Wright, P.J., Gibb, F.M., Jensen, H. and Gibb, I.M., 2007. Regional variation in maturation of sandeels in the North Sea. ICES Journal of Marine Science: Journal du Conseil, 64(2), pp.369-376.
Brette, F., Machado, B., Cros, C., Incardona, J.P., Scholz, N.L., Block, B.A., 2014. Crude oil impairs cardiac excitation-contraction coupling in fish. Science 343, 772-776.
Brown, E.D., Baker, T.T., Hose, J.E., Kocan, R.M., Marty, G.D., McGurk, M.D., Norcross, B.L., Short, J.W. 1996. Injury to the early life history stages of Pacific herring in Prince William Sound after the Exxon V aldez oil spill. Am Fish Soc Symp 18:448– 462.
Bue, B. G., S. Sharr, S. D. Moffitt, and A. Craig. 1996. Effects of the Exxon Valdez oil spill on pink salmon embryos and preemergent fry. Pages 619-627 in Rice et al. (1996).
Bue, B.G., Sharr, S., Seeb, J.E., 1998. Evidence of Damage to Pink Salmon Populations Inhabiting Prince William Sound, Alaska, Two Generations after the Exxon Valdez Oil Spill. T Am Fish Soc 127, 35-43.
Carls, M.G., Rice, S.D., Marty, G.D., Naydan, D.K., 2004. Pink salmon spawning habitat is recovering a decade after the Exxon Valdez oil spill. T Am Fish Soc 133, 834-844.
Carls, M.G., Wertheimer, A.C., Short, J.W., Smolowitz, R.M., Stegeman, J.J.. 1996. Contamination of juvenile pink and chum salmon by hydrocarbons in Prince William Sound after the Exxon Valdez oil spill. Am Fish Soc Symp 18:593–607.
Christensen, A., Jensen, H., Mosegaard, H., John, M. S., and Schrum, C. 2008. Sandeel (Ammodytes marinus) larval transport patterns in the North Sea from an individual-based hydrodynamic egg and larval model. Canadian Journal of Fisheries and Aquatic Sciences, 65: 1498–1511.
Conway, D.V.P., Coombs, S.H. and Smith, C., 1997. Vertical distribution of fish eggs and larvae in the Irish Sea and southern North Sea. ICES Journal of Marine Science: Journal du Conseil, 54(1), pp.136-147.
Cresci, A., Browman, H.I., Skiftesvik, A.B., Shema, S., Bjelland, R., Durif, C., Foretich, M., Di Persia, C., Lucchese, V., Vikebø, F., Sorhus, E., 2020. Effects of exposure to low concentrations of oil on expression of cytochrome P4501a and routine swimming speed of Atlantic haddock (Melanogrammus aeglefinus) larvae in situ. Environ. Sci. Technol.
Das, K., Lepoint, G., Leroy, Y., and Bouquegneau, J. M. 2003. Marine mammals from the southern North Sea: feeding ecology data from δ13C and δ15N measurements. Marine Ecology Progress Series, 263: 287–298.
Davies, I. M. and Vethaak, A. D. 2012. Integrated marine environmental monitoring of chemicals and their effects. ICES Cooperative Research Report No. 315. Pp 277.
Daly, K. L., Passow, U., Chanton, J. & Hollander, D. 2016. Assessing the impacts of oil-associated marine snow formation and sedimentation during and after the Deepwater Horizon oil spill. Anthropocene 13, 18-33.
de Jong, K., Forland, T. N., Amorim, M. C. P., Rieucau, G., Slabbekoorn, H. and Sivle, L. D. 2020. Predicting the effects of noise on fish reproduction from available data: the importance of types of noise and stages of reproduction. Reviews in Fish and Fisheries 30:245-268. doi: 10.1007/s11160-020-09598-9
Engås, A., Olsen, S., Soldal, A. V. 1989. Undersøkelser av effekten på torsk i mær av refraksjonsseismiske sprenginger i Øygarden. Oppdragsrapport, Fangstseksjonen, Fiskeriteknologisk forskningsinstitutt, Institute of Fishery Technology research.
Engås, A., Løkkeborg, S., Ona, E., Soldal, A.V. 1996. Effects of seismic shooting on local abundance and catch rates of cod (Gadus morhua) and haddock (Melanogrammus aeglefinus). Canadian Journal of Fisheries and Aquatic Science 53, 2238–2249.
Eliasen, K. 2013. Sandeel, Ammodytes spp., as a link between Climate and Higher Trophic Levels on the Faroes Shelf (Doctoral dissertation, PhD Thesis, Faroe Marine Research Institute).
Falkenhaug, T, Nash, R., Gundersen, K., Larsen, S., Albretsen, J., Heldal, H.E., Hosia, A. 2016. North Sea Ecosystem Cruise 2016, Cruise Report. Institute of Marine Research Cruise number GOS 2016106. Toktrapport/Havforskningsinstituttet/ISSN 1503 6294/Nr. 16–2016
Frederiksen, M., Wanless, S., Rothery, P., and Wilson, L. J. 2004. The role of industrial fisheries and oceanographic change in the decline of North Sea black-legged kittiwakes. Journal of Applied Ecology, 41: 1129–1139.
Freeman, S., Mackinson, S., and Flatt, R. 2004. Diel patterns in the habitat utilisation of sandeels revealed using integrated acoustic surveys. Journal of Experimental Marine Biology and Ecology, 305: 141–154.
Furness, R. W. 1990. A preliminary assessment of the quantities of Shetland sandeels taken by seabirds, seals, predatory fish and the industrial fishery in 1981–83. Ibis, 132: 205–217.
Furness, R. W., and Tasker, M. L. 2000. Seabird-fishery interactions: quantifying the sensitivity of seabirds to reductions in sandeel abundance, and identification of key areas for sensitive seabirds in the North Sea. Marine Ecology-Progress Series, 202: 253–264.
Furness, R. W. 2002. Management implications of interactions between fisheries and sandeel-dependent seabirds and seals in the North Sea. Ices Journal of Marine Science, 59: 261–269.
Gauld, J. A. 1990. Movements of lesser sandeels ( Ammodytes marinus Raitt) tagged in the northwestern North Sea. ICES Journal of Marine Science, 46: 229–231. Oxford Academic.
Gauld, J.A. and Hutcheon, J.R., 1990. Spawning and fecundity in the lesser sandeel, Ammodytes marinus Raitt, in the north‐western North Sea. Journal of Fish Biology, 36(4), pp.611-613.
Gilbert, M., Fortier, L., Ponton, D., Drolet, R. 1992. Feeding ecology of marine fish larvae across the Great Whale River plume in seasonally ice-covered south eastern Hudson Bay. Mar Ecol Prog Set 84:19-30.
Golet, G.H., Seiser, P.E., McGuire, A.D., Roby, D.D., Fischer, J.B., Katherine J. Kuletz, K.J., David B. Irons, D.B., Thomas A. Dean, T.A., Jewett, S.J., Newman, S.H. 2002. Long-term direct and indirect effects of the ‘Exxon Valdez’ oil spill on pigeon guillemots in Prince William Sound, Alaska. Mar Ecol Prog Ser Vol. 241: 287–304.
Greenstreet, S. P. R., Armstrong, E., Mosegaard, H., Jensen, H., Gibb, I. M., Fraser, H. M., Scott, B. E., et al. 2006. Variation in the abundance of sandeels Ammodytes marinus off southeast Scotland: an evaluation of area-closure fisheries management and stock abundance assessment methods. Ices Journal of Marine Science, 63: 1530–1550.
Grøsvik, B.E., Kalstveit, E., Liu, L., Nesje, G., Westrheim, K., Bertnssen, M.H.G. Le Goff, J., Meier, S. 2012. Condition monitoring in the water column 2011: Oil hydrocarbons in fish from Norwegian waters. IMR Report No. 19-2012.
Hagenlund, M. 2011. Effekten av næringstilgang og havtemperatur på bestandsstørrelsen av krykkje (Rissa tridactyla), i tre norske kolonier.: 36.
Hansen, B. H., Sørensen, L., Størseth T.R., Altin, D., Gonzalez S.V., Skancke, J., Rønsberg M.U., Nordtug, T. 2020. The use of PAH, metabolite and lipid profiling to assess exposure and effects of produced water discharges on pelagic copepods. Sci. Total Environ. 714, 136674.
Hassel, A. Knudsen, T., Dalen, J., Løkkeborg, S., Skaar, K., Østensen, Ø., Haukland, E.K., Fonn, M., Høines, Å. and Misund, O.A. (2003). Reaction of sandeel to seismic shooting: A field experiment fishery statistics study. Fisken og Havet 4-2003. Report Institute of Marine research. 62 p.
Hassel, A., Knutsen, T., Dalen, J., Skaar, K., Løkkeborg, S., Misund, O. A., Østensen, Ø., Fonn, M., & Haugland, E. K. 2004. Influence of seismic shooting on the lesser sandeel (Ammodytes marinus). ICES Journal of Marine Science, 61(7), 1165–1173. https://doi.org/10.1016/j.icesjms.2004.07.008
Harris, M.P., Wanless, S. 1997. Breeding success, diet, and brood neglect in the kittiwake (Rissa tridactyla) over an 11-year period. ICES J Mar Sci 54:615–623.
Heintz, R.A., 2007. Chronic exposure to polynuclear aromatic hydrocarbons in natal habitats leads to decreased equilibrium size, growth, and stability of pink salmon populations. Integr Environ Assess Manag 3, 351-363.
Heintz, R.A., Rice, S.D., Wertheimer, A.C., Bradshaw, R.F., Thrower, F.P., Joyce, J.E., Short, J.W., 2000. Delayed effects on growth and marine survival of pink salmon Oncorhynchus gorbuscha after exposure to crude oil during embryonic development. Mar. Ecol. Prog. Ser. 208, 205-216.
Henriksen, O., Rindorf, A., Brooks, M. E., Lindegren, M., and van Deurs, M. 2021. Temperature and body size affect recruitment and survival of sandeel across the North Sea. ICES Journal of Marine Science. https://doi.org/10.1093/icesjms/fsaa165 (Accessed 23 March 2021).
Herbert-Read, J. E., Kremer, L., Bruintjes, R., Radford, A. N., & Ioannou, C. C. 2017. Anthropogenic noise pollution from pile-driving disrupts the structure and dynamics of fish shoals. Proceedings of the Royal Society B: Biological Sciences, 284(1863), 20171627. https://doi.org/10.1098/rspb.2017.1627
Hillersøy, G. 2011. Annual variation in the diet of the European shag (Phalacrocorax aristotelis) at Sklinna, central Norway, and a possible relationship between reproduction and abundance of year class 1-saithe in the diet. 47. Norwegian University of Life Sciences, Ås. https://nmbu.brage.unit.no/nmbu-xmlui/handle/11250/186724 (Accessed 17 November 2020).
Holland, G. J., Greenstreet, S. P. R., Gibb, I. M., Fraser, H. M., and Robertson, M. R. 2005. Identifying sandeel Ammodytes marinus sediment habitat preferences in the marine environment. Marine Ecology-Progress Series, 303: 269–282.
Huserbråten, M. B. O., Moland, E., and Albretsen, J. 2018. Cod at drift in the North Sea. Progress in Oceanography, 167: 116–124.
Høines, Å. S., and Bergstad, O. A. 2001. Density of wintering sand eel in the sand recorded by grab catches. Fisheries Research, 49: 295–301.
ICES. 2010. Report of the Benchmark Workshop on Sandeel (WKSAN), 6–10 September. ICES CM 2010/ACOM:57. Copenhagen, Denmark.
ICES. 2017. Report of the Benchmark on Sandeel (WKSand 2016), 31 October - 4 November 2016, Bergen, Norway. ICES CM 2016/ACOM:33. 319 pp.
ICES. 2019. Sandeel (Ammodytes spp.) in Division 4.a, Sandeel Area 5r (Northern North Sea, Viking and Bergen banks). In Report of the ICES Advisory Committee, 2019. ICES Advice 2019, san.sa.5r, https://doi.org/10.17895/ices.advice.4724
ICES. 2020. Herring Assessment Working Group for the Area South of 62° N (HAWG). ICES Scientific Reports. 2:60. 1054 pp. http://doi.org/10.17895/ices.pub.6105
Incardona, J.P., 2017. Molecular Mechanisms of Crude Oil Developmental Toxicity in Fish. Arch. Environ. Contam. Toxicol. 73, 19-32.
Incardona, J.P., Carls, M.G., Holland, L., Linbo, T.L., Baldwin, D.H., Myers, M.S., Peck, K.A., Tagal, M., Rice, S.D., Scholz, N.L., 2015. Very low embryonic crude oil exposures cause lasting cardiac defects in salmon and herring. Sci. Rep. 5, 13499.
Incardona, J.P., Scholz, N.L., 2017. 6 - Environmental Pollution and the Fish Heart, in: Gamperl, A.K., Gillis, T.E., Farrell, A.P., Brauner, C.J. (Eds.), Fish Physiology. Academic Press, pp. 373-433.
Jensen, H. 2001. Settlement dynamics in the lesser sandeel Ammodytes marinus in the North Sea. University of Aberdeen. https://ethos.bl.uk/OrderDetails.do?uin=uk.bl.ethos.368840 (Accessed 21 October 2020).
Jensen, H., Rindorf, A., Wright, P. J., and Mosegaard, H. 2011. Inferring the location and scale of mixing between habitat areas of lesser sandeel through information from the fishery. Ices Journal of Marine Science, 68: 43–51.
Jiménez-Mena, B., Le Moan, A., Christensen, A., van Deurs, M., Mosegaard, H., Hemmer-Hansen, J., and Bekkevold, D. 2019. Weak genetic structure despite strong genomic signal in lesser sandeel in the North Sea. Evolutionary Applications.
Johannessen and Johnsen 2015. http://www.ices.dk/sites/pub/ASCExtendedAbstracts/Shared%20Documents/E%20-%20Beyond%20ocean%20connectivity.%20Embracing%20advances%20on%20early%20life%20stages%20and%20adult%20connectivity%20to%20assessment%20and%20management/E1215.pdf
Johnsen, E., and Harbitz, A. 2013. Small-scale spatial structuring of burrowed sandeels and the catching properties of the dredge. ICES Journal of Marine Science: Journal du Conseil.
Johnsen, E., Rieucau, G., Ona, E., and Skaret, G. 2017. Collective structures anchor massive schools of lesser sandeel to the seabed, increasing vulnerability to fishery. Marine Ecology Progress Series, 573: 229–236.
Johnsen, E. 2018. Råd for tobisfiskeriet i norsk sone for 2018 og rapport for tobistokt i Nordsjøen 24. april – 14. mai. Toktrapport/Havforskningsinstituttet/ISSN 1503 6294/Nr.9–2018.
Johnsen, E. 2019. Råd for tobisfiskeriet i norsk sone for 2019 og rapport for tobistokt i Nordsjøen 23. april – 13. mai. Toktrapport/Havforskningsinstituttet/ISSN 1503 6294/Nr.10–2019.
Johnsen, E. 2020. Råd for tobisfiskeriet i norsk sone for 2020 og rapport for tobistokt i Nordsjøen 23. april – 13. mai. Toktrapport/Havforskningsinstituttet/ISSN 1503 6294/Nr.9–2020.
Johnsen, E. 2021. Råd for tobisfiskeriet i norsk sone for 2021 og rapport for tobistokt i Nordsjøen 23. april – 16. mai. Toktrapport/Havforskningsinstituttet/ISSN 15036294/Nr.6–2021.
Kvist, T., Gislason, H., and Thyregod, P. 2001. Sources of variation in the age composition of sandeel landings. ICES Journal of Marine Science, 58: 842–851. Oxford Academic.
Kunzlik, P. A., Gauld, J. A., and Hutcheon, J. R. 1986. Preliminary results of the Scottish sandeel tagging project. ICES Document CM 1986/G: 07. 8 pp.
Kystverket. 2017. Forslag til planprogram. Detaljregulering for farleden til Leirpollen i Tana kommune. Planprogram til høring og offentlig ettersyn Nasjonal arealplan-ID: 20252017001
Laurel, B.J., Copeman, L.A., Iseri, P., Spencer, M.L., Hutchinson, G., Nordtug, T., Donald, C.E., Meier, S., Allan, S.E., Boyd, D.T., Ylitalo, G.M., Cameron, J.R., French, B.L., Linbo, T.L., Scholz, N.L., Incardona, J.P., 2019. Embryonic crude oil exposure impairs growth and lipid allocation in a keystone arctic forage fish. IScience.
Lewis, S., Wanless, S., Wright, P.J., Harris, M.P., Bull, J. & Elston, D.A. 2001. Diet and breeding performance of black-legged kittiwakes Rissa tridactyla at a North Sea colony. Marine Ecology Progress Series, 221, 277–284.
Løkkeborg, S. & Soldal, A.V. .1993. The influence of seismic exploration with air guns on cod (Gadus morhua) behaviour and catch rates. ICES mar. Sci. Symp., 196: 62-67.
Macer, C.T., 1966. Sand eels (Ammodytidae) in the south-western North Sea; their biology and fishery.
Magnhagen, C., Johansson, K., Sigray, P. 2017. Effects of motorboat noise on foraging behaviour in Eurasian perch and roach: a field experiment. Marine Ecology Progress Series 564:115–125. https://doi.org/10.3354/meps11997
Monaghan, P. (1992) Seabirds and sandeels: the conflict between exploitation and conservation in the northern North Sea. Biodiversity and Conservation, 1, 98–111.
Meier, S., Karlsen, Ø., Le Goff, J., Sørensen, L., Sørhus, E., Pampanin, D.M., Donald, C.E., Fjelldal, P.G., Dunaevskaya, E., Romano, M., Caliani, I., Casini, S., Bogevik, A.S., Olsvik, P.A., Myers, M., Grøsvik, B.E., 2020. DNA damage and health effects in juvenile haddock (Melanogrammus aeglefinus) exposed to PAHs associated with oil-polluted sediment or produced water. PLoS ONE 15(10): e0240307. https://doi. org/10.1371/journal.pone.0240307
Nedelec, S.J., Radford, A.N., Pearl, L. et al. 2017. Motorboat noise impacts parental behaviour and offspring survival in a reef fish. Proceedings of the Royal Society B 284:20170143
Nepstad, R., Hansen, B.H., Skancke, J. 2021. North Sea produced water PAH exposure and uptake in early life stages of Atlantic Cod. Marine Environmental Research 163, 105203. https://doi.org/10.1016/j.marenvres.2020.105203
NOROG 2020. Klima og miljørapport. Olje- og gassindustriens klima- og miljøarbeid. Fakta og utviklingstrekk. Pp 80.
OSPAR, 2018a. Assessment of discharges, spills and emissions from offshore oil and gas operations on the Norwegian Continental Shelf, 2012-2016. Pp33.
OSPAR, 2018b. Assessment of discharges, spills and emissions from offshore oil and gas operations on the United Kingdom Continental Shelf, 2012-2016. Pp 35.
Pampanin, D.M., Brooks, S., Grøsvik, B.E., Sanni, S. 2019. Water Column Monitoring 2017. Environmental monitoring of petroleum activities on the Norwegian continental shelf 2017. NORCE-Environment REPORT 007 – 2019, pp 92.
Pearson, W.H., Woodruff, D.L., Sugarman, P.C., Olla, B.L., 1984. The burrowing behavior of sand lance, Ammodytes hexapterus: Effects of oil-contaminated sediment. Mar. Environ. Res. 11, 17-32.
Petersen, G.I., Kristensen, P., 1998. Bioaccumulation of lipophilic substances in fish early life stages. Environ. Toxicol. Chem. 17, 1385-1395.
Pethon, P. 2019. Aschehougs store fiskebok. H. Aschehougs@ Co A/S. Oslo.
Pinto, J.M., Pearson, W.H., Anderson, J.W., 1984. Sediment preferences and oil contamination in the Pacific sand lance Ammodytes hexapterus. Mar Biol 83, 193-204.
Popper, A. N., Hawkins, A. D., Fay, R. R., Mann, D. A., Bartol, S., Carlson, T. J., Coombs, S., Ellison, W. T., Gentry, R. L., Halvorsen, M. B., Løkkeborg, S., Rogers, P. H., Southall, B. L., Zeddies, D. G., Tavolga, W. N. 2014. Sound Exposure Guidelines for Fishes and Sea Turtles: A Technical Report prepared by ANSI-Accredited Standards Committee S3/SC1 and registered with ANSI, Springer, New York, ASA S3/SC1. 4 TR-2014.
Proctor, R., Wright, P.J. and Everitt, A., 1998. Modelling the transport of larval sandeels on the north‐west European shelf. Fisheries Oceanography, 7(3‐4), pp.347-354.
Reay, P.J., 1970. Synopsis of biological data on North Atlantic sandeels of the genus Ammodytes. FAO Fisheries Synopsis No. 82. http://www.fao.org/3/a-a8703e.pdf
Reay, P.J. 1986. Ammodytidae p. 945-950 in: Whitehead P.J.P., Bauchot M.-L., Hureau J.-C., Nielsen J. & Tortonese E. 1984–1986: Fishes of the north-eastern Atlantic and the Mediterranean. Vol I-II, 1473p. Paris: UNESCO.
Régnier, T., Gibb, F. M., and Wright, P. J. 2018. Temperature effects on egg development and larval condition in the lesser sandeel, Ammodytes marinus. Journal of Sea Research, 134: 34–41.
Rindorf, A., Wanless, S., and Harris, M. P. 2000. Effects of changes in sandeel availability on the reproductive output of seabirds. Marine Ecology-Progress Series, 202: 241–252.
Ruus, A., Ugland, K. I., Espeland, O., and Skaare, J. U. 1999. Organochlorine contaminants in a local marine food chain from Jarfjord, Northern Norway. Marine Environmental Research, 48: 131–146.
Sevedzem, V. N. 2019. Lesser sandeel (Ammodytes marinus) in the Tana river delta: temporal variation in abundance, habitat use and demography. Norwegian University of Life Sciences, Ås. https://nmbu.brage.unit.no/nmbu-xmlui/handle/11250/2629597 (Accessed 21 October 2020).
Smigielski, A., Halavik, T., Buckley, L., Drew, S., and Laurence, G. 1984. Spawning, embryo development and growth of the American sand lance Ammodytes americanus in the laboratory. Marine Ecology Progress Series, 14: 287–292.
Simpson, S. D., Radford, A. N., Nedelec, S. L., Ferrari, M. C., Chivers, D. P., McCormick, M. I. & Meekan, M. G 2016. Anthropogenic noise increases fish mortality by predation Nature Communications, 7, 10544.
Sivle, L.D.; Forland, T.N.; de Jong, K.; Kutti, T.; Zhang, G., Wehde, H., Grimsbø, E. 2021. Havforskningsinstituttets Rådgivning for Menneskeskapt støy i Havet. Rapport fra Havforskningen No 2021-4; Institute of Marine Research: Bergen, Norway; ISSN 1893-4536.
Slabbekoorn, H., Bouton, N. 2008. Soundscape orientation: a new field in need of sound investigation. Animal Behaviour 76:e5–e8
Soldal, A.V. & Løkkeborg, S. 1993. Seismisk aktivitet og fiskefangster. Analyse av innsamlede fangstdata. Fisken og Havet, 4 (1996): 44 s.
Stagg, R.M., McIntosh, A. 1996. Hydrocarbon concentrations in the Northern North Sea and effects on fish larvae. The Science of the Total Environment 186: 189-201.
Strobel, S. M., & Mooney, T. A. 2012. Detection of low-frequency tones and whale predator sounds by the American sand lanceAmmodytes americanus. Journal of Fish Biology, 81(5), 1646–1664. https://doi.org/10.1111/j.1095-8649.2012.03423.x
Strøm, H. 1762. Physisk og Oeconomisk beskrivelse over fogderiet Søndmør, beliggende i Bergens stift i Norge. Opplyst med Landkort og kobberstykker. Første part. Trykt i Sørøe, 1762. Sælges i Kiøbenhavn i den Rotheske Boglade i No 11, 12 og 13 på Børsen. Omsatt frå gotisk skrift til latinske skrift i ny utgåve i 2001 av Stein Uglevik Larsen. ISBN 82-92168-00-1
Suga, T., Akamatsu, T., Sawada, K. et al. 2005. Audiogram measurement based on the auditory brainstem response for juvenile Japanese sand lance Ammodytes personatus. Fish Sci 71, 287–292. https://doi.org/10.1111/j.1444-2906.2005.00962.x
Svenning, M.-A., Borgstrøm, R., Dehli, T. O., Moen, G., Barrett, R. T., Pedersen, T., and Vader, W. 2005. The impact of marine fish predation on Atlantic salmon smolts (Salmo salar) in the Tana estuary, North Norway, in the presence of an alternative prey, lesser sandeel (Ammodytes marinus). Fisheries Research, 76: 466–474.
Sundby, S., Kristiansen, T., Nash, R., & Johannessen, T. 2017. Dynamic Mapping of North Sea Spawning–Report of the KINO Project.
Sømme, H. O., & de Ruiter, H. 2015. Leirpollen, Tana kartlegging av marint miljø og vurdering av effekter ved mudring og deponering. Miljørapport: Rambøll.
Sørensen, L., Sørhus, E., Nordtug, T., Incardona, J.P., Linbo, T.L., Giovanetti, L., Karlsen, O., Meier, S., 2017. Oil droplet fouling and differential toxicokinetics of polycyclic aromatic hydrocarbons in embryos of Atlantic haddock and cod. Plos One 12, e0180048.
Sørhus, E., Donald, C.E., da Silva, D., Thorsen, A., Karlsen, Ø., Meier, S., 2020. Untangling mechanisms of crude oil toxicity: linking gene expression, morphology and PAHs at two developmental stages in a cold-water fish. Sci. Total Environ. 2021, 757, 143896 .
Sørhus, E., Edvardsen, R.B., Karlsen, O., Nordtug, T., van der Meeren, T., Thorsen, A., Harman, C., Jentoft, S., Meier, S., 2015. Unexpected interaction with dispersed crude oil droplets drives severe toxicity in atlantic haddock embryos. Plos One 10, e0124376.
Sørhus, E., Incardona, J.P., Furmanek, T., Goetz, G.W., Scholz, N.L., Meier, S., Edvardsen, R.B., Jentoft, S., 2017. Novel adverse outcome pathways revealed by chemical genetics in a developing marine fish. Elife 6.
Sørhus, E., Incardona, J.P., Karlsen, O., Linbo, T., Sørensen, L., Nordtug, T., van der Meeren, T., Thorsen, A., Thorbjørnsen, M., Jentoft, S., Edvardsen, R.B., Meier, S., 2016. Crude oil exposures reveal roles for intracellular calcium cycling in haddock craniofacial and cardiac development. Sci. Rep. 6, 31058.
Tangen, M., Hamre, J., Johnsen, E., Nakken, O., Nedreaas, K., Tangen, Ø., and Ågotnes, P. 2016. Tobis ved Vestlandet og i Nordsjøen 1950 - 1990. 22 s. https://imr.brage.unit.no/imr-xmlui/handle/11250/2440934 (Accessed 9 January 2020).
Van Deurs, M., R. van Hal, M. T. Tomczak, S. H. Jonasdottir, and P. Dolmer. 2009. Recruitment of Lesser Sandeel Ammodytes Marinus in Relation to Density Dependence and Zooplankton Composition. Marine Ecology-Progress Series 381: 249–58. https://doi.org/10.3354/meps07960.
Deurs, M. van, Grome, T. M., Kaspersen, M., Jensen, H., Stenberg, C., Sørensen, T. K., Støttrup, J., et al. 2012. Short- and long-term effects of an offshore wind farm on three species of sandeel and their sand habitat. Marine Ecology Progress Series, 458: 169–180.
van Deurs, M., Koski, M., and Rindorf, A. 2014. Does copepod size determine food consumption of particulate feeding fish? ICES Journal of Marine Science, 71: 35–43.
Wanless, S., Harris, M.P., Greenstreet, S.P.R. 1998. Summer sandeel consumption by seabirds breeding in the Firth of Forth, south-east Scotland. ICES J Mar Sci 55:1141–1151.
Wells, P.G., Kim, P.M., Laposa, R.R., Nicol, C.J., Parman, T., Winn, L.M., 1997. Oxidative damage in chemical teratogenesis. Mutat. Res. 396, 65-78.
Wertheimer AC, Celewycz AG. 1996. Abundance and growth of juvenile pink salmon in oiled and non-oiled locations of western Prince William Sound after the Exxon Valdez oil spill. Am Fish Soc Symp 18:518–532.
Willette, M. 1996. Impacts of the Exxon Valdez oil spill on the migration, growth and survival of juvenile pink salmon in Prince William Sound. Am Fish Soc Symp 18:533–550.
Winslade, P. 1974. Behavioural studies on lesser sandeel Ammodytes marinus (Raitt) 3. Effect of temperature on activity and environmental control of annual cycle of activity. Journal of Fish Biology, 6: 587–599.
Wright, P.J. and Bailey, M.C., 1996. Timing of hatching in Ammodytes marinus from Shetland waters and its significance to early growth and survivorship. Marine Biology, 126(1), pp.143-152.
Wright, P. J., Jensen, H., and Tuck, I. 2000. The influence of sediment type on the distribution of the lesser sandeel, Ammodytes marinus. Journal of Sea Research, 44: 243–256.
Wright, P. J., Régnier, T., Gibb, F. M., Augley, J., and Devalla, S. 2018. Identifying stock structuring in the sandeel, Ammodytes marinus, from otolith microchemistry. Fisheries Research, 199: 19–25.
Yamashita, Y., Aoyama, T. 1986. Starvation resistance of larvae of the Japanese sand eel Ammodytes personaEus. Bull Jap Soc Scient Fish 52:635-639.