A review of the knowledge related to spawning in cages for farmed cod shows that temperature is a key factor in the assessment of environmental risk. Atlantic cod is widespread on both sides of the Atlantic Ocean, and within its distribution area the main rule is spawning during spring. But populations with spawning in other seasons covering most of the months of the year also exist. Along the Norwegian coast, summer and autumn spawning among wild cod has not been verified, but in Western Finnmark Northeast Atlantic cod with mature roe has been observed as late as the turn of May-June. Experiments have shown that the physiological processes leading to good normal maturation and egg development in cod are negatively affected at temperatures from approx. 10 °C and higher, while cod larvae have a greater tolerance for such temperatures and can grow well at 17 °C in the more developed larval stages. However, during maturation and spawning above 10 °C, experiments have shown that a small proportion of eggs will be fertilized, and a majority of these will have normal development in the first egg stage. In case of extensive maturation in a cod farm under such temperature conditions, with subsequent spawning in the cages, it is therefore plausible that a significant number of fertilized eggs may be developing normally. Seasonal temperature data have not been available for the seven locations evaluated, and simulated data from a hydrodynamic model was therefore used. The simulations show a significant variation between years and within a month, and data on actual temperature conditions should therefore be used in addition to assess whether maturation in a farm facility needs follow-up outside of the normal spawning season. Zooplankton data show that prey for cod larvae will be present along the Norwegian coast outside the normal spawning season, both in summer and autumn.
Risiko knyttet til gyting i merd hos oppdrettstorsk ulike deler av året
Rapportserie:
Rapport fra havforskningen 2024-60
ISSN: 1893-4536
Publisert: 04.12.2024
Oppdragsgiver(e): Fiskeridirektoratet
Referanse: 24/9845
Forskningsgruppe(r):
Reproduksjon og utviklingsbiologi
Tema:
Torskeoppdrett
Program:
Miljøeffekter av akvakultur
Godkjent av:
Forskningsdirektør(er):
Geir Lasse Taranger
Programleder(e):
Mari Skuggedal Myksvoll
English summary
Sammendrag
En gjennomgang av kunnskapen knyttet til gyting i merd hos oppdrettstorsk viser at temperatur er en sentral faktor for å kunne vurdere miljørisiko. Atlantisk torsk er utbredt på begge sider av Atlanterhavet, og innenfor utbredelsesområdet er hovedregelen gyting om våren. Men det forekommer også populasjoner med gyting på andre årstider som omfatter de fleste av årets måneder. Langs norskekysten er sommer- og høstgyting blant villtorsk ikke verifisert, men i Vest-Finnmark er det påvist skrei med moden rogn så seint som månedsskiftet mai-juni. Eksperimentelle forsøk har vist at de fysiologiske prosessene som leder til god eggmodning og normal eggutvikling hos torsk blir negativt påvirket ved temperaturer fra ca. 10 °C og høyere, mens torskelarver har en større toleranse for slike temperaturer og kan vokse godt ved 17 °C i de mer utviklede larvestadiene. Ved kjønnsmodning og gyting i temperaturer over 10 °C har forsøk imidlertid vist at en liten andel egg vil befruktes, og en god del av disse vil ha en normal utvikling i det første eggstadiet. I et tilfelle med omfattende kjønnsmodning i et oppdrettsanlegg og påfølgende gyting i merd under slike temperaturforhold kan det derfor tenkes å være en betydelig mengde befruktede egg i god utvikling. Data for årstidsvariasjoner i temperatur har ikke vært tilgjengelig for de syv lokalitetene det ønskes en vurdering for, og simulerte data fra en hydrodynamisk modell har derfor blitt benyttet. Simuleringene viser en betydelig variasjon mellom år og innen en måned, og data om faktiske temperaturforhold bør benyttes som et tillegg i en vurdering om kjønnsmodning i et anlegg har behov for oppfølging utenom normal gytesesong. Data på forekomst av dyreplankton viser at byttedyr for torskelarver vil være til stede langs norskekysten utenom normal gytesesong, både sommer og høst.
1 - Innledning
Denne rapporten er et svar på bestilling av råd av 03.09.2024 fra Fiskeridirektoratet knyttet til gyting i merd hos oppdrettstorsk. Med tanke på tilsyn med modning og gyting i merd har Fiskeridirektoratet behov for råd knyttet til miljørisiko ulike deler av året, og da spesielt sommer og sensommer (juni-september). Bestillingen viser til behov for et kort kunnskapssammendrag og et forvaltningsråd basert på dette. Videre ønskes det vurdering av den økologiske risikoen ved gyting i merd sommer og sensommer. Viktige punkt i vurderingen kan være:
- Kunnskap om variasjoner i villtorskens gytesesong.
- Hva vet man om gyting hos villtorsk i sommerhalvåret.
- Kunnskap om modning og eggkvalitet ved ulike temperaturer.
- Kunnskap om overlevelse av egg og yngel ved ulike temperaturer og fysiske forhold i vannsøylen (tetthet, pyknokliner mm).
- Kunnskap om fødetilgang for larver og yngel ved ulike tider på året, med hovedvekt på sommer og sensommer.
Vurderingene ønskes knyttet mot syv spesifikke lokaliteter som i 2024-2025 kommer til å ha torsk som er i sin andre vintersesong i sjø.
2 - Kunnskap om variasjoner i villtorskens gytesesong
Torsken har en utbredelse på begge sider av Atlanterhavet, og i Europa fra Irskesjøen til Barentshavet. I europeiske farvann er torsken en vårgyter med gyting fra januar til mai i Nordsjøen avhengig av breddegrad. Langs norskekysten vil gyting skje i samme tidsrom som for Nordsjøen, men med noe forskyvning av gytetoppen i tid med økende breddegrad, blant annet på grunn av temperatur (Otterå m.fl. 2012). Havforskningsinstituttet har f.eks. verifisert gytende skrei vest av Sørøya så seint som i månedsskiftet mai-juni, og lokal fjordtorsk i enkelte fjorder i Troms og Finnmark kan gyte helt til juni (Aglen m.fl. 2005).
Det er imidlertid vist eksperimentelt at mønsteret med seinere gytetid nordover ikke er absolutt. Otterå m.fl. (2006) fant at torsk fra Finnmark (Porsangerfjorden) hadde gyteperiode senere enn torsk fra Hordaland (Øygarden) mens torsk fra Helgeland (Meløy) hadde gyteperiode enda senere enn Porsangertorsken. Gytetidspunktet kan variere med flere uker for grupper av torsk kun få kilometer fra hverandre (Otterå m.fl. 2006), og det ble konkludert med at det er en genetisk komponent involvert i bestemmelse av når torsken gyter siden dette overføres mellom generasjoner (Otterå m.fl. 2012). Gytetidspunkt for torsk langs Norskekysten er ikke undersøkt i detalj. Variasjoner i gyteperiode med hensyn til ulike bestandskomponenter, f.eks. representert ved lokale stammer, er derfor i stor grad ukjent.
I kontrast til vårgyting rapporterte Fulton (1904) om gytemoden torsk fanget i Nordsjøen midt mellom Aberdeen og Stavanger fra seint i august til oktober. Dette ble også verifisert ved funn av torskeegg i seint utviklingsstadium samlet inn fra dette havområdet. Videre er det beskrevet høstgyting i Loch Fyne på vestkysten av Skottland og fra Østersjøen (Fulton 1904). Høstgyting er også observert på vestsiden av Atlanterhavet, fra Nova Scotia (McKenzie 1940), mens sommergyting ble rapportert fra Gulf of St. Lawrence i Canada (Dannevig 1919). På sydkysten av Newfoundland er det i en studie fra 1995 til 2014 registrert gytemoden kystnær torsk nær året rundt med hovedvekt fra mars til november, mens en mer sammentrukket vårgyting skjedde for torsk offshore (Rose & Rowe 2020). I nyere tid har gytetidspunkt for torsk i Østersjøen utvidet fra sein vår til sommer, der endring i temperatur, byttedyrtilgang, aldersstruktur samt tetthetsavhengige faktorer relatert til størrelse av gytebestand er viktige faktorer i endringen (Wieland m.fl. 2000). FAO (2020) har angitt følgende gytetider for torsk:
- Norskekysten: februar - april
- Østersjøen: april - juli
- Nordsjøen: desember - mai
- Gulf of Maine: november - april
- Newfoundland: april - juni
- Vestgrønland: mars - juni
- Sørvestlige Gulf of St. Lawrence: mai - september
Torsk som art ser ut til å vise en betydelig variasjon i gytetidspunkt, og dette er avhengig av både fysiske og genetiske forhold. I tillegg kan biologiske faktorer knyttet til fødetilgang og bestandsdemografi spille en rolle. Temperatur vil være en viktig komponent siden torsken her vil ha begrensninger knyttet til utvikling og modning av egg og melke, se avsnitt 3) og 4) nedenfor.
3 - Hva vet man om gyting hos villtorsk i sommerhalvåret
Ifølge litteraturen angitt under avsnitt 1) ovenfor er sommergyting observert hos torsk i Canada (Gulf of St. Lawrence), på Newfoundland og i Østersjøen. Dette viser at daglengde alene ikke bestemmer modning hos noen torskestammer. Både temperatur og genetikk kan ha innvirkning på gytetidspunkt. For eksempel er det vist for torsk i Nordsjøen og Irskesjøen at gytetidspunktet skjer tidligere enn for 30 år siden (McQueen & Marshall 2017). Tilsvarende er observert for skrei med forskyvning til tidligere på året med økende vanntemperatur, men også at skreien kan stille inn gytetidspunktet uavhengig av temperatur til våroppblomstringen av plankton som avkommet er avhengig av for overlevelse (Opdal m.fl. 2024).
Når det gjelder norske farvann eksisterer det anekdotisk informasjon fra lokalbefolkningen i Vest-Finnmark om sommergyting hos torsk. Relativt nylig bunnslått torskeyngel (4 cm totallengde) er observert i siste halvdel av september og begynnelsen av oktober på feltarbeid Havforskningsinstituttet har gjennomført i Kvænangen og Loppa kommuner (Olderfjorden og Frakkfjorden), men det har ikke lykkes å sikkert slå fast alder på disse f.eks. gjennom dagsonelesing av otolitter. Eksistens av sommergyting i norske farvann er derfor foreløpig ikke dokumentert.
4 - Kunnskap om modning og eggkvalitet ved ulike temperaturer
Blant de forskjellige livsstadiene har fysiologi knyttet til reproduksjon, modnende kjønnsceller i gytende fisk og embryoer et smalere termisk toleranseområde enn larver, yngel og ikke-reproduktive voksne fisk, og disse tidlige livsstadiene er mest sårbare for temperaturøkning (Dahlke m.fl. 2020). Ifølge Righton m.fl. (2010) varierer det vanlige temperaturområdet for torsk (den termiske nisjen) fra -1,5 til 19 °C, mens torsk under gytesesongen lever i farvann med temperaturer mellom 1 og 8 til10 °C. Hos villtorsk så gytesesongen i varmere farvann ut til å være tidligere hos større hunner sammenlignet med mindre hunner, mens dette var ikke tilfelle i kaldere vann (Kjesbu m.fl. 2010).
I et upublisert forsøk utført i 2018–2019 ved Havforskningsinstituttet (Matre forskningsstasjon) ble 200 kysttorsk (sør for 62 °N) holdt ved forskjellige temperaturer (3, 6, 9 og 12 °C) fra starten av reproduksjonssyklusen (i slutten av september) til slutten av gytesesongen (i begynnelsen av mai). En sporingsstudie på disse fiskene, med månedlig prøvetaking, fremhevet at modning/gyting ved temperaturer over 10 °C har en tydelig negativ effekt på flere reproduktive responser, som:
- en reduksjon i topp- og maksimalnivået av hormonet 17β-østradiol, som er involvert i vekst av eggceller (oocytter). En nedgang i dette hormonet var også observert hos torsk utsatt for høy temperatur (12 °C) (Tveiten 2008).
- endringer i genuttrykk for flere gener (Alix, Kjesbu m.fl. upubliserte data; Skjærven m.fl. 2024).
- en større andel av hunnene med atresi (tilbakedanning av oocytter), men ikke større omfang av atresi i rogna ved høyere temperaturer (9 og 12 °C) sammenlignet med optimale temperaturer (3 og 6 °C).
Når det gjelder egg- og spermkvalitet fra disse fiskene, observerte vi en økning i spermaktivitet ved 9 °C, etterfulgt av en reduksjon ved 12 °C mens avlesningen av genetisk informasjon i egg (eggtranskriptomet) er påvirket av temperaturøkning (Thorsen m.fl. upubliserte data; Skjærven m.fl. 2024). Hos gytende torsk (skrei) som opplever temperaturer over 9,6 °C (selv kortvarig), økte variasjonen i gytefrekvens, og den vanlige rytmiske gytesyklusen ble uberegnelig og varte ved selv om temperaturen senere sank til under 9,6 °C (Kjesbu m.fl. 2023). I tillegg er det vist at befruktningsraten synker betydelig i egg fra torsk som har opplevd slike temperaturer (Tveiten 2008; van der Meeren & Ivannikov, 2006).
Eksponering av torsk benyttet til stamfisk for høyere temperaturer (9,5 °C eller over 9,6 °C) svekket gametkvaliteten, noe som resulterte i redusert befruktningssuksess sammenlignet med stamtorsk hold ved lavere temperatur (van der Meeren & Ivannikov, 2006; Dahlke m.fl. 2022). For stamfisk av oppdrettstorsk som holdes ved optimale forhold (6 °C), fant Dahlke m.fl. (2022) at temperaturvinduet for høy befruktningssuksess (over 75 %) var relativt bredt, tilsvarende et temperaturområde fra 0,7 til 11,1 °C, med et optimalt nivå ved 6,4 °C. For stamtorsk holdt ved 9,5 °C ble dette vinduet for befruktningssuksess redusert (2,6 til 11,4 °C), mens økt forsuring av vannet for stamfisken holdt på 9,5 °C førte til ytterligere reduksjon i vinduet for høy befruktningssuksess (4,8 til 10,7°C).
5 - Kunnskap om overlevelse av egg og yngel ved ulike temperaturer og fysiske forhold i vannsøylen (tetthet, pyknokliner mm).
Overlevelsen av egg fra befruktning til klekking hos torsk blir negativt påvirket når individene opplever temperaturøkninger utenfor de foretrukne gyteforholdene for torsk (≤0 °C og ≥9 °C). Dette resulterer i redusert eggoverlevelse (Tabell 1; Dahlke m.fl. 2016, 2018, 2020; Geffen m.fl. 2006; Skjærven m.fl. 2024; van der Meeren & Ivannikov, 2006) og en nedgang i normal embryoutvikling (Dahlke m.fl. 2022; Tveiten 2008; van der Meeren & Ivannikov, 2006).
| Temperatur gjennom inkuberingen (°C): | 0 | 3 | 6 | 9 | 9,5 | 12 |
|---|---|---|---|---|---|---|
| Overlevelse ved klekking (Dahlke m.fl. 2018) | 74 | 85 | 86 | 62 | 7 | |
| Overlevelse ved klekking (Dahlke m.fl. 2020) | 87 | 84 | ||||
| Overlevelse ved klekking (Skjærven m.fl. 2024) | 46 | 18 | 0 | |||
| Deformitetsrate ved klekking (Dahlke m.fl. 2018) | 13 | 9 | 9 | 24 | 36 |
I tillegg har temperaturen sterk innflytelse på utviklingsrate, larvemorfometri og deformitetsrate hos torskelarver, der utviklingsraten øker med økt temperatur (Alix, Kjesbu m.fl. upubliserte data; Geffen m.fl. 2006; Hall & Johnston, 2003; Skjærven m.fl. 2011 og 2024), larvelengden ved klekking kan avta med økt temperatur (Alix, Kjesbu m.fl. upubliserte data; Politis m.fl. 2014; Dahlke m.fl. 2018), og deformitetsraten ved klekking øker med temperaturøkning (Alix, Kjesbu m.fl. upubliserte data; Dahlke m.fl. 2018).
Hvis stamfisken også opplever høye temperaturer i tillegg til temperaturøkning i de tidlige livsstadiene, kan utviklingssuksessen til eggene bli ytterligere påvirket. I det tidligere nevnte forsøket ved Havforskningsinstituttet (Matre forskningsstasjon) i 2018-2019 observerte vi at selv om individer var i stand til å gyte under alle temperaturforhold (med en forsinkelse av start og topp for gytingen ved laveste temperatur på 3 °C), var utviklingssuksessen målt som overlevelse, klekking og deformitetsrate, samt alvorlige effekter på larvemorfometri, tydelig negativt påvirket ved den høyeste temperaturen på 12 °C (Alix, Kjesbu m.fl. upubliserte data; Skjærven m.fl. 2024). Dette skyldes sannsynligvis redusert gametkvalitet hos begge kjønn i varmere vann, i tillegg til temperaturens direkte påvirkning på utviklingen av embryoene med hensyn til avlesing av genetisk informasjon (transkripsjon ved RNA). De transkriptomiske forskjellene for enkelte gener i embryoene ble også reflektert i rognsekkens egganlegg flere måneder før gytesesongen (Skjærven m.fl. 2024).
Torskeegg vil ha en oppdrift som fører til at de vil plassere seg i vannsøylen der det omliggende vannet vil ha noenlunde lik tetthet som eggene (nøytral oppdrift). Fysiske prosesser som strøm og turbulens vil ytterligere fordele eggene. Tettheten på sjøvann bestemmes først og fremst av saltinnhold, men varmere vann vil også bidra litt til lavere tetthet sammenlignet med kjøligere vann. Sprangsjikt bestående av både ferskere og varmere vann vil derfor kunne være effektive barrierer som hindrer egg i å nå overflaten. De fysiske forholdene på en lokalitet vil derfor være viktige for å avgjøre om torskeegg fra gyting utenfor sesong vil utsettes for miljøforhold som reduserer normal embryonalutvikling.
I en studie med stamtorsk fra Øygarden, Meløy, Tysfjord og Porsanger ble flyteevne for torskeegg funnet å være signifikant forskjellig med hensyn til stamtorskens opprinnelse (Stenevik m.fl. 2008). I dette arbeidet var egg fra Porsanger-torsk lettest med en nøytral oppdrift ved saltholdighet tilsvarende 31 ‰ ved 6 °C, mens egg fra Tysfjord-torsk var tyngst og hadde tilvarende en nøytral oppdrift ved 32,52 ‰. Slike forskjeller kan være genetiske tilpasninger til de lokale fysiske forholdene i området torsken kommer fra ut fra og ha effekt på fordeling av egg i og utenfor et fjordsystem (Stenevik m.fl. 2008). Fordelingen av oppdrift for egg er ikke uniform slik at nøytral oppdrift av eggene innen hver av de fire torskestammene fordelte seg over et intervall av saltholdigheter på i underkant av 2 ‰ for Tysfjord- og Meløy-torsk, nesten 2,5 ‰ for torsk fra Øygarden og 3 ‰ for torsk fra Porsanger. Det er i tillegg vist at egg kan endre oppdrift da de blir tyngre i løpet av eggutviklingen (Mangor-Jensen 1987). I en ny studie av nøytral oppdrift for egg med torsk fra Meløy, Tysfjord og Porsanger ble et større antall egg undersøk, og her ble det ikke funnet forskjell mellom disse tre populasjonene (Jung m.fl. 2012). I denne studien ble det imidlertid bekreftet at nøytral oppdrift endrer seg med eggutviklingen, og at eggene først blir litt lettere for så å bli tyngre når det nærmer seg klekking.
Torskelarver har høyere temperaturtoleranse enn i eggstadiene. Få dager etter klekking og initiering av startfôring er det standard prosedyre å heve temperaturen til ca.12 °C (van der Meeren m.fl. 2007), og fra forsøk i pollsystemer er det vist at temperaturer helt opp mot 17 °C gir overlevelse og svært god vekst hos eldre torskelarver (Finn m.fl. 2002).
6 - Kunnskap om fødetilgang for larver og yngel ved ulike tider på året, med hovedvekt på sommer og sensommer.
Fra tidspunktet torskelarver må begynne å fange byttedyr spiser de alt mulig av plankton som er innenfor størrelsesområdet de kan fange og svelge, inkludert algeceller ned mot 6-10 µm som de filtrerer med gjellebuene (van der Meeren 1991). Dette gir imidlertid ikke særlig vekst, og først når byttedyr av typen hoppekreps (copepoder) og deres larvestadier (nauplier) blir tilgjengelig, akselererer veksten (van der Meeren & Næss 1993). Vekst er essensielt for å vokse ut av predatorfeltene, og en vurdering om larver klekket utenfor sesong kan overleve vil derfor måtte vurdere forekomst av nauplier og copepoder (som representerer de umodne og voksne stadiene av hoppekreps).
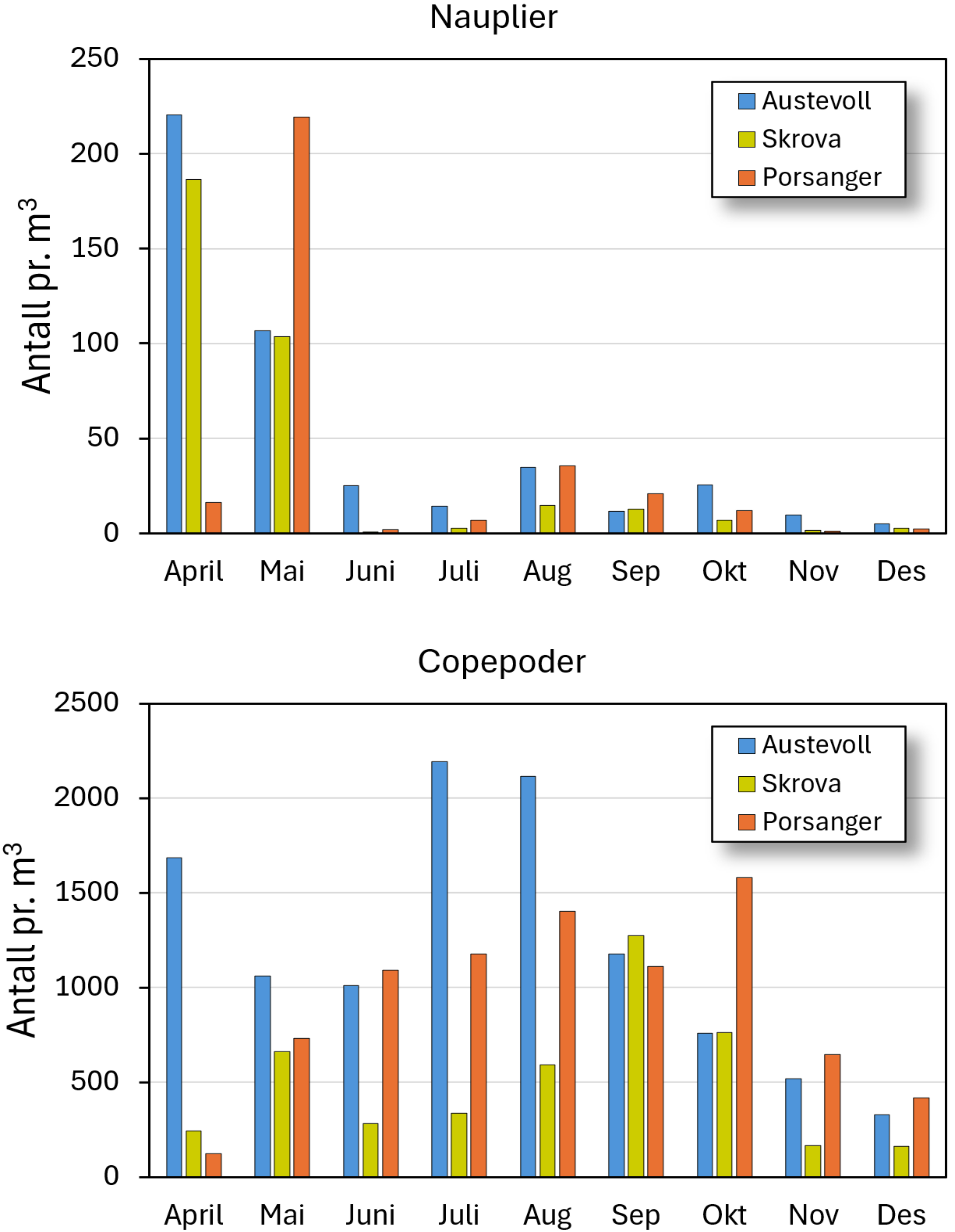
Hoppekreps har to livsstrategier, der den ene finnes blant arter i Calanus-slekten som overvintrer i dypet og kommer opp for å gyte om våren når algeoppblomstringen er i gang. Calanus-slekten er blant de største hoppekrepsene, og de fleste kommersielle fiskebestander har innrettet gytingen sin om våren etter disse. De litt mindre hoppekrepsartene som forekommer i større grad ut over sommeren, kan legge egg som enten klekker umiddelbart eller er hvilegg som synker til bunns og klekker når det blir bedre næringsforhold for naupliene. Innenfor denne gruppen er det mange arter, og alle disse vil være tilstrekkelig som byttedyr for torskelarver. Figur 1 viser forekomst av hoppekreps fra Havforskningsinstituttets egen overvåkning av plankton i perioden 2019-2023 på tre lokaliteter langs norskekysten, basert på 1-2 prøver pr. måned. Disse prøvene er tatt med en håv som er 180 µm. Dette fører til at mange av naupliene fra de mindre hoppekrepsartene er underrepresentert i prøvene, fordi flere av de nyklekte naupliene fra disse artene er ned mot 80 µm i størrelse. Data i figur 1 viser gjennomsnittet for de undersøkte årene for de aktuelle månedene, og variasjon f.eks. gitt som ett standardavvik (ikke vist i figur 1), er av samme størrelsesorden som gjennomsnittet.
Figur 1 viser at det er både nauplier og copepoder til stede i sommer- og høstmånedene. Vi kan derfor anta at torskelarver vil ha byttedyr også disse årstidene til å kunne overleve. Konsentrasjon av dyreplankton vil imidlertid være avhengig av lokalitet der strømforhold og retensjon av vannmasser vil spille en viktig rolle. Noen steder vil derfor kunne gi bedre vekst og overlevelse hos torskelarver enn andre steder.
7 - Risikovurdering for syv anlegg
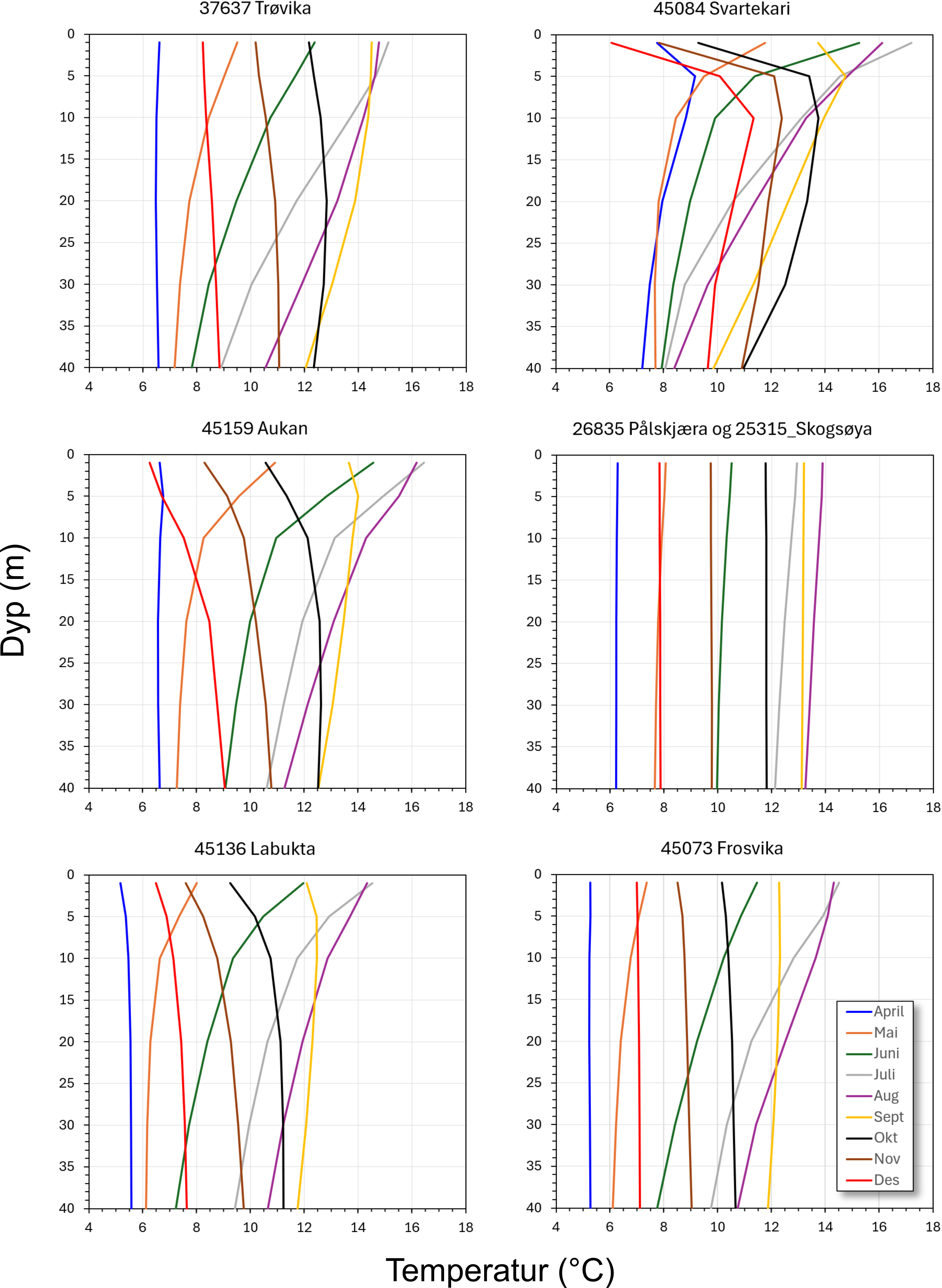
Temperatur er den viktigste fysiske faktoren som regulerer eggkvalitet ved gyting utenfor sesong. En risikovurdering vil derfor ta utgangspunkt i temperaturdata ved de syv anleggene det er bedt om vurdering for. I mangel på faktisk målte temperaturdata har vi måttet estimere temperatur fra hydrodynamiske simuleringer med NorKyst-800 modellen (Albretsen m.fl. 2011). Det er i denne sammenheng valgt å gjøre simuleringer for årene som ligger nært i tid, det vil si 2021-2024. Simuleringene er kjørt som døgnmiddel for dyp på 1, 5, 10, 20, 30 og 40 m for alle de syv lokalitetene for hvert av årene. Data for temperatur fra disse simuleringene er vist for aktuelle måneder (som gjennomsnitt) og dyp i figur 2. Det må understrekes at vurderingene med hensyn til eggkvalitet og eggoverlevelse vil være usikre all den tid faktiske målinger av temperatur gjennom årstidene over flere år ikke er tilgjengelig fra de aktuelle lokalitetene.
Et annet moment i en risikovurdering er at selv om temperatur overstiger grenser som resulterer i lav befruktning og økt forekomst av uregelmessig celledeling med feilutvikling hos embryoer, så er det en andel befruktede egg som vil gi normalutvikling under slike forhold. For eksempel er det vist at ved 13 °C vil befruktningen kunne synke til i gjennomsnitt ca. 15 % der 60 % av de befruktede eggene vil kunne ha normal utvikling i det første eggstadiet (van der Meeren & Ivannikov 2006). I et tilfelle med omfattende kjønnsmodning i et oppdrettsanlegg og gyting i merd ved f.eks. 13 °C kan det derfor tenkes å fremdeles være en betydelig mengde befruktede egg i god utvikling.
Temperatur vil være avhengig av dybde, og betydelige forskjeller kan observeres gjennom sprangsjikt. I en risikovurdering er det derfor tatt utgangspunkt i merder med størrelse innenfor to dybdeområder: 20 til 30 m dype merder, og 30 til 40 m dype merder. Merder dypere enn 40 m vil sannsynligvis gi lavere og mer stabile temperaturer gjennom året, og derved økt risiko. Dette er gjort fordi de to oppdrettsanleggene på Frøya vil ha et bunndyp på anslagsvis mellom 35 og 45 m. Risikovurderingen er gitt i tabell 2a og 2b, med fargekoder for økende sannsynlighet for god befruktning og eggutvikling gitt ut fra temperatur. Plassering i vannsøylen for egg som er gytt, er ikke vurdert fordi nøytral oppdrift hos egg fra oppdrettsstammene for torsk ikke er kjent, og fordeling av egg i vannsøylen i betydelig grad vil være bestemt av turbulens og strøm som igjen vil være avhengig av vind i overflatelagene. Risiko for torskelarver er heller ikke vurdert da overlevelse og vekst hos larvene er avhengig av tilstedeværelse av byttedyr. Ut fra vurderingene i avsnitt 5) er det sannsynlig at byttedyr vil være tilgjengelig både sommer og høst, om enn i varierende grad. Det foreligger heller ikke data for dyreplankton i de aktuelle områdene som viser variasjon innen årstider og mellom år.
Det er viktig å være klar over at variasjon i sjøtemperatur mellom år kan være betydelig. Også innen samme måned kan det være stor variasjon. For å gi et bilde på variasjon på hver lokalitet ut fra de simulerte modellresultatene er største temperaturforskjell mellom årene 2021-2024 for gjennomsnitt pr. måned innen dypene fra 20 til 40 m angitt i tabell 3 (sorte tall). Data i tabell 3 er gitt for de månedene som viser økt sannsynlighet for redusert befruktning og reduksjon i vellykket utvikling i tabell 2a og b (juni-desember). Videre er største temperaturforskjell mellom maksimum og minimum innen en måned i tidsperioden 2021-2024 angitt i tabell 3 (blå tall i parentes). Tabell 3 viser at det kan være stor variasjon fra år til år, og også innen en måned i et år. Denne variasjonen er viktig og gir en del usikkerhet til estimerte sannsynligheter. For eksempel kan temperaturen i august på lokaliteten i Nordfjord variere mellom to år så mye som over 5 °C i dybdeområdet hvor en merd befinner seg. Data om faktiske temperaturforhold bør derfor benyttes som et tillegg i en vurdering om kjønnsmodning i et anlegg har behov for oppfølging utenom normal gytesesong.
| <10 °C | |
| 10-11 °C | |
| 11-12 °C | |
| 12-13 °C | |
| 13-14 °C |
| Lokalitet: | April | Mai | Juni | Juli | Aug. | Sept. | Okt. | Nov. | Des. |
|---|---|---|---|---|---|---|---|---|---|
| 37637 Trøvika (Austreim) | |||||||||
| 45084 Svartekari (Nordfjord) | |||||||||
| 45159 Aukan (Nordmøre) | |||||||||
| 25315 Skogsøya (Frøya) | |||||||||
| 26835 Pålskjæra (Frøya) | |||||||||
| 45136 Labukta (Nesna) | |||||||||
| 45073 Frosvika (Meløy) |
| Lokalitet: | April | Mai | Juni | Juli | Aug. | Sept. | Okt. | Nov. | Des. |
|---|---|---|---|---|---|---|---|---|---|
| 37637 Trøvika (Austreim) | |||||||||
| 45084 Svartekari (Nordfjord) | |||||||||
| 45159 Aukan (Nordmøre) | |||||||||
| 25315 Skogsøya (Frøya) | |||||||||
| 26835 Pålskjæra (Frøya) | |||||||||
| 45136 Labukta (Nesna) | |||||||||
| 45073 Frosvika (Meløy) |
| Lokalitet: | Juni | Juli | Aug. | Sept. | Okt. | Nov. | Des. |
|---|---|---|---|---|---|---|---|
| 37637 Trøvika (Austreim) | 1,6 (5,5) | 1,8 (5,7) | 3,5 (8,3) | 3,3 (6,3) | 1,1 (3,4) | 0,9 (2,9) | 1,1 (2,6) |
| 45084 Svartekari (Nordfjord) | 1,6 (3,6) | 1,0 (5,1) | 5,3 (4,9) | 5,0 (5,2) | 2,5 (2,6) | 0,7 (1,9) | 0,8 (2,3) |
| 45159 Aukan (Nordmøre) | 2,6 (3,8) | 2,5 (3,7) | 3,1 (3,4) | 2,3 (2,5) | 1,1 (2,5) | 1,2 (4,4) | 1,9 (3,4) |
| 25315 Skogsøya (Frøya) | 1,4 (4,1) | 1,4 (3,7) | 1,3 (2,6) | 1,1 (2,4) | 0,5 (3,6) | 1,2 (2,1) | 0,8 (1,7) |
| 26835 Pålskjæra (Frøya) | 1,4 (4,1) | 1,4 (3,7) | 1,3 (2,6) | 1,1 (2,4) | 0,5 (3,6) | 1,2 (2,1) | 0,8 (1,7) |
| 45136 Labukta (Nesna) | 2,3 (5,1) | 3,4 (3,7) | 4,4 (4,4) | 3,3 (3,8) | 1,3 (1,3) | 0,7 (4,1) | 1,2 (3,0) |
| 45073 Frosvika (Meløy) | 2,1 (5,3) | 3,2 (5,5) | 3,9 (4,4) | 2,8 (3,7) | 0,7 (2,2) | 0,4 (2,2) | 0,7 (1,9) |
8 - Referanser:
Aglen, A., Gjøsæter, H., Holst, J.C., Klungsøyr, J. & Olsen, E. (2005). Verdifulle områder for torsk, hyse, sild og lodde i området Lofoten – Barentshavet. Rapport fra Havforskningsinstituttet til World Wildlife Fund (WWF-Norge), 16 pp. (Upublisert). https://media.wwf.no/assets/article_images/12-hi_2005_verdifulle_omraader_fisk.pdf
Albretsen, J., Sperrevik, A.K., Staalstrøm, A., Sandvik, A.D., Vikebø, F., & Asplin, L. (2011). NorKyst-800 report No. 1: User manual and technical descriptions. Fisken og Havet 2-2011: 46 pp. https://www.hi.no/resources/publikasjoner/fisken-og-havet/2011/fh_2-2011_til_web.pdf
Dahlke, F.T., Politis, S.N., Butts, I.A.E., Trippel, E.A., & Peck, M.A. (2016). Fathers modify thermal reaction norms for hatching success in Atlantic cod, Gadus morhua. Journal of Experimental Marine Biology and Ecology 474: 148-155. https://doi.org/10.1016/j.jembe.2015.10.008
Dahlke, F.T., Butzin, M., Nahrgang, J., Puvanendran, V., Mortensen, A., Pörtner, H.-O., & Storch, D. (2018). Northern cod species face spawning habitat losses if global warming exceeds 1.5°C. Science Advances 4 (11), eaas8821. https://doi.org/10.1126/sciadv.aas8821
Dahlke, F.T., Wohlrab, S., Butzin, M., & Pörtner, H.-O. (2020). Thermal bottlenecks in the life cycle define climate vulnerability of fish. Science 369 (6499): 65-70. https://doi.org/10.1126/science.aaz3658
Dahlke, F., Puvanendran, V., Mortensen, A., Pörtner, H., & Storch, D. (2022). Broodstock exposure to warming and elevated pCO2 impairs gamete quality and narrows the temperature window of fertilisation in Atlantic cod. Journal of Fish Biology 101 (4): 822-833. https://doi.org/10.1111/jfb.15140
Dannevig, A. (1919). Canadian fish-eggs and larvae. In: Canadian fisheries expedition 1914-1915, Investigations in the Gulf of St. Lawrence and Atlantic waters of Canada, Canada Department of the Naval Service: 1-74. https://doi.org/10.5962/bhl.title.7395
FAO (2020). Species Fact Sheets - Gadus morhua (Linnaeus, 1758). https://www.fao.org/figis/pdf/fishery/species/2218/en
Finn, R.N., Rønnestad, I., van der Meeren, T., & Fyhn, H.J. (2002). Fuel and metabolic scaling during the early life stages of Atlantic cod Gadus morhua. Marine Ecology Progress Series 243: 217-234. https://doi.org/10.3354/meps243217
Fulton, T. W. (1904). On the spawning of the cod (Gadus morrhua L.) in autumn in the North Sea. ICES Journal of Marine Science s1 (8-9): 3-10. https://doi.org/10.1093/icesjms/s1.8-9.3
Geffen, A.J., Fox, C.J., & Nash, R.D.M. (2006). Temperature-dependent development rates of cod Gadus morhua eggs. Journal of Fish Biology 69 (4): 1060-1080. https://doi.org/10.1111/j.1095-8649.2006.01181.x
Hall, T.E., & Johnston, I.A. (2003). Temperature and developmental plasticity during embryogenesis in the Atlantic cod Gadus morhua L. Marine Biology 142 (5): 833-840. https://doi.org/10.1007/s00227-003-1030-y
Jung, K.M., Folkvord, A., Kjesbu, O.S. Agnalt, A.L., Thorsen, A., & Sundby, S. (2012). Egg buoyancy variability in local populations of Atlantic cod (Gadus morhua). Marine Biology 159: 1969-1980. https://doi.org/10.1007/s00227-012-1984-8
Kjesbu, O. S., Righton, D., Krüger-Johnsen, M., Thorsen, A., Michalsen, K., Fonn, M., & Witthames, P. R. (2010). Thermal dynamics of ovarian maturation in Atlantic cod (Gadus morhua). Canadian Journal of Fisheries and Aquatic Sciences 67 (4): 605-625. https://doi.org/10.1139/f10-011
Kjesbu, O.S., Alix, M., Sandø, A.B., Strand, E., Wright, P.J., Johns, D.G., Thorsen, A., Marshall, C.T., Bakkeplass, K.G., Vikebø, F.B., Skuggedal Myksvoll, M., Ottersen, G., Allan, B.J.M., Fossheim, M., Stiansen, J.E., Huse, G., & Sundby, S. (2023). Latitudinally distinct stocks of Atlantic cod face fundamentally different biophysical challenges under on‐going climate change. Fish and Fisheries 24 (2): 297-320. https://doi.org/10.1111/faf.12728
Mangor-Jensen, A. (1987). Water balance in developing eggs of the cod Gadus morhua L. Fish Physiology and Biochemistry 3: 17-24. https://doi.org/10.1007/BF02183990
McKenzie, R. (1940). Nova Scotian autumn cod spawning. Journal of the Fisheries Board of Canada 5: 105-120. https://doi.org/10.1139/f40-011
McQueen, K. & Marshall, C.T. (2017). Shifts in spawning phenology of cod linked to rising sea temperatures. ICES Journal of Marine Science 74: 1561-1573. https://doi.org/10.1093/icesjms/fsx025
Opdal, A.F., Wright, P.J., Blom, G., Höffle, H., Lindemann, C. & Kjesbu, O.S. (2024). Spawning fish maintains trophic synchrony across time and space beyond thermal drivers. Ecology 105 (6): e4304. https://doi.org/10.1002/ecy.4304
Otterå, H., Agnalt, A-L., & Jørstad, K.E. (2006). Differences in spawning time of captive Atlantic cod from four regions of Norway, kept under identical conditions. ICES Journal of Marine Science 63: 216-223. https://doi.org/10.1016/j.icesjms.2005.11.004
Otterå, H., Agnalt, A-L., Thorsen, A., Kjesbu, O.S., Dahle, G., & Jørstad, K. (2012). Is spawning time of marine fish imprinted in the genes? A two-generation experiment on local Atlantic cod (Gadus morhua L.) populations from different geographical regions. ICES Journal of Marine Science 69: 1722-1728. https://doi.org/10.1093/icesjms/fss135
Politis, S.N., Dahlke, F.T., Butts, I.A.E., Peck, M.A., & Trippel, E.A. (2014). Temperature, paternity and asynchronous hatching influence early developmental characteristics of larval Atlantic cod, Gadus morhua. Journal of Experimental Marine Biology and Ecology 459: 70-79. https://doi.org/10.1016/j.jembe.2014.05.020
Righton, D., Andersen, K., Neat, F., Thorsteinsson, V., Steingrund, P., Svedäng, H., Michalsen, K., Hinrichsen, H., Bendall, V., Neuenfeldt, S., Wright, P., Jonsson, P., Huse, G., van der Kooij, J., Mosegaard, H., Hüssy, K., & Metcalfe, J. (2010). Thermal niche of Atlantic cod Gadus morhua: Limits, tolerance and optima. Marine Ecology Progress Series 420: 1-13. https://doi.org/10.3354/meps08889
Rose, G.A. & Rowe, S. (2020). Evidence of near year-around spawning in Atlantic cod off southern Newfoundland: implications for management. Canadian Journal of Fisheries and Aquatic Sciences 77: 1969-1976. https://doi.org/10.1139/cjfas-2020-0206
Skjærven, K.H., Alix, M., Kleppe, L., Fernandes, J.M.O., Whatmore, P., Nedoluzhko, A., Andersson, E., & Kjesbu, O.S. (2024). Ocean warming shapes embryonic developmental prospects of the next generation in Atlantic cod. ICES Journal of Marine Science 81 (4): 733-747. https://doi.org/10.1093/icesjms/fsae025
Skjærven, K.H., Olsvik, P.A., Finn, R.N., Holen, E., & Hamre, K. (2011). Ontogenetic expression of maternal and zygotic genes in Atlantic cod embryos under ambient and thermally stressed conditions. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology 159 (2): 196-205. https://doi.org/10.1016/j.cbpa.2011.02.026
Stenevik, E.K., Sundby, S., & Agnalt, A.L. (2008). Buoyancy and vertical distribution of Norwegian coastal cod (Gadus morhua) eggs from different areas along the coast. ICES Journal of Marine Science 65: 1198-1202. https://doi.org/10.1093/icesjms/fsn101
Tveiten, H. (2008). Temperature influence on reproductive development and gamete quality in Atlantic cod (Gadus morhua). Cybium, International Journal of Ichtyology 32 (2 Suppl): 195. https://doi.org/10.26028/cybium/2008-322SP-086
van der Meeren, T. & Ivannikov, V.P. (2006). Seasonal shift in spawning of Atlantic cod (Gadus morhua L.) by photoperiod manipulation: Egg quality in relation to temperature and intensive larval rearing. Aquaculture Research 37 (9): 898-913. https://doi.org/10.1111/j.1365-2109.2006.01510.x
van der Meeren, T. (1991). Algae as first food for cod larvae (Gadus morhua L.): Filter feeding or ingestion by accident? Journal of Fish Biology 39: 225-239. https://doi.org/10.1111/j.1095-8649.1991.tb04358.x
van der Meeren, T. & Næss, T. (1993). How does cod (Gadus morhua L.) cope with variability in the feeding conditions during early larval stages? Marine Biology 116: 637-647. https://doi.org/10.1007/BF00355482
van der Meeren, T., Mangor-Jensen, A., & Pickova, J. (2007). The effect of green water and light intensity on survival, growth and lipid composition in Atlantic cod (Gadus morhua) during intensive larval rearing. Aquaculture 265: 206-217. https://doi.org/10.1016/j.aquaculture.2007.01.042
Wieland, K., Jarre-Teichmann, A., & Horbowa, K. (2000). Changes in the timing of spawning of Baltic cod: possible causes and implications for recruitment. ICES Journal of Marine Science 57: 452-464. https://doi.org/10.1006/jmsc.1999.0522
