Open net pen farming of salmonids leads to spillover of waste feed and other materials to the surrounding water masses, which will impact the surrounding ecosystem. The objective of this report is to summarize existing knowledge of the ecological impacts of salmon farming on wild Norwegian coastal cod. Since 2021, Norwegian coastal cod has been managed as three stock units: south of 62°N, 62°N – 67°N and north of 67°N. Currently, all three stocks are in decline, with the southernmost component in a particularly dire state. Hence, there is a great need for a detailed understanding of how human activities in coastal areas impact coastal cod. In this report we provide a status of knowledge regarding how open net pen farming of salmon can 1) affect coastal cod spawning migration and spawning sites, 2) lead to malnutrition due to cod feeding on waste feed and prey associated with fish farming, 3) alter the occurrence of potentially harmful substance in cod, and 4) change disease dynamics in wild cod populations. The report is written by experts from relevant research areas and will act as the foundation for an upcoming risk assessment.
Økologiske effekter av lakseoppdrett i åpne merder på ville kysttorskbestander
— Kunnskapsstatus
Rapportserie:
Rapport fra havforskningen 2025-15
ISSN: 1893-4536
Kunnskapsstatus til risikorapport
Publisert: 26.02.2025
Godkjent av:
Forskningsdirektør(er):
Geir Lasse Taranger
Programleder(e):
Mari Skuggedal Myksvoll
English summary
Sammendrag
Oppdrett av laksefisk i åpne merder i sjø fører til at fôr, og andre stoffer, havner i vannmassene. Dette kan forventes å påvirke det tilstøtende økosystemet og artene som lever der. Formålet med denne rapporten er å oppsummere tilgjengelig kunnskap om de økologiske effektene av lakseoppdrett på ville kysttorskebestander. Siden 2021 har kysttorsk vært forvaltet i tre forvaltningsområder: sør for 62°N, 62°N – 67°N og nord for 67°N. På nåværende tidspunkt opplever alle disse en nedgang i bestandsstørrelse, og situasjonen er særlig kritisk for den sørligste bestanden. Som følge av dette er det et stort behov for kunnskap om hvordan all menneskelig aktivitet i kystsonen, påvirker kysttorsken. I denne rapporten gis det en kunnskapsstatus om hvordan lakseoppdrett i åpne merder kan 1) påvirke kysttorskens gytevandring og valg av gyteplasser, 2) føre til feilernæring ved at kysttorsk tiltrekkes laksemerder og beiter på spillfôr og oppdrettsassosierte byttedyr, 3) endre forekomst av fremmedstoffer i torsken og 4) føre til endring i sykdomsforekomst og smitte. Kunnskapsstatusen er utarbeidet av eksperter fra relevante forsknings- og forvaltningsområder og vil fungere som grunnlag for en påfølgende risikovurdering av temaet.
1 - Innledning
Oppdrett av laks (Salmo salar) og regnbueørret (Oncorhynchus mykiss) i åpne merder i sjø fører til at fôr, og andre fysiske og kjemiske stoffer, havner i vannmassene. Dette kan forventes å påvirke det tilstøtende økosystemet og artene som lever der. I denne kunnskapsoppsummeringen redegjør vi for mulige påvirkninger av lakseoppdrett i åpne merder på ville bestander av torsk (Gadus morhua). Kunnskapsoppsummeringen vil fungere som grunnlaget for en påfølgende risikovurdering av temaet. I tillegg til å gi en overordnet beskrivelse av de antatt viktigste risikofaktorene, hendelsene og konsekvensene, beskrives statusen til de ulike forvaltningsenhetene av kysttorsk, samt redegjøres for omfanget av lakseoppdrett langs Norskekysten. Som et bakteppe for kunnskapsstatusen og den påfølgende risikovurderingen er målsetningen om å ha torskebestander som kan gi et høstbart overskudd, samt motstandsdyktighet mot nåværende og forventede klimaendringer. Dette vil si torskebestander med god rekruttering, variert aldersstruktur og god genetisk status. Kunnskapssoppsummeringen er utarbeidet av eksperter fra ulike fagfelt innenfor relevante forsknings- og forvaltningsområder.
2 - Lakseoppdrett i Norge
Norge eksporterte i 2024 over 1,33 millioner tonn oppdrettslaks og regnbueørret til en samlet verdi på i overkant av 129 milliarder kroner. Dette utgjorde totalt 74 % av den samlede eksportverdien av sjømat på 175,3 milliarder kroner (Norges Sjømatråd, https://nokkeltall.seafood.no). I 2024 var den gjennomsnittlige månedlig biomassen i lakseoppdrett 871 991 tonn (tall fra Fiskeridirektoratet, 20.01.2025). Dette tilsvarer ca. 30 ganger den anbefalte fiskerikvoten for kysttorsk i 2025 på 28 598 tonn.
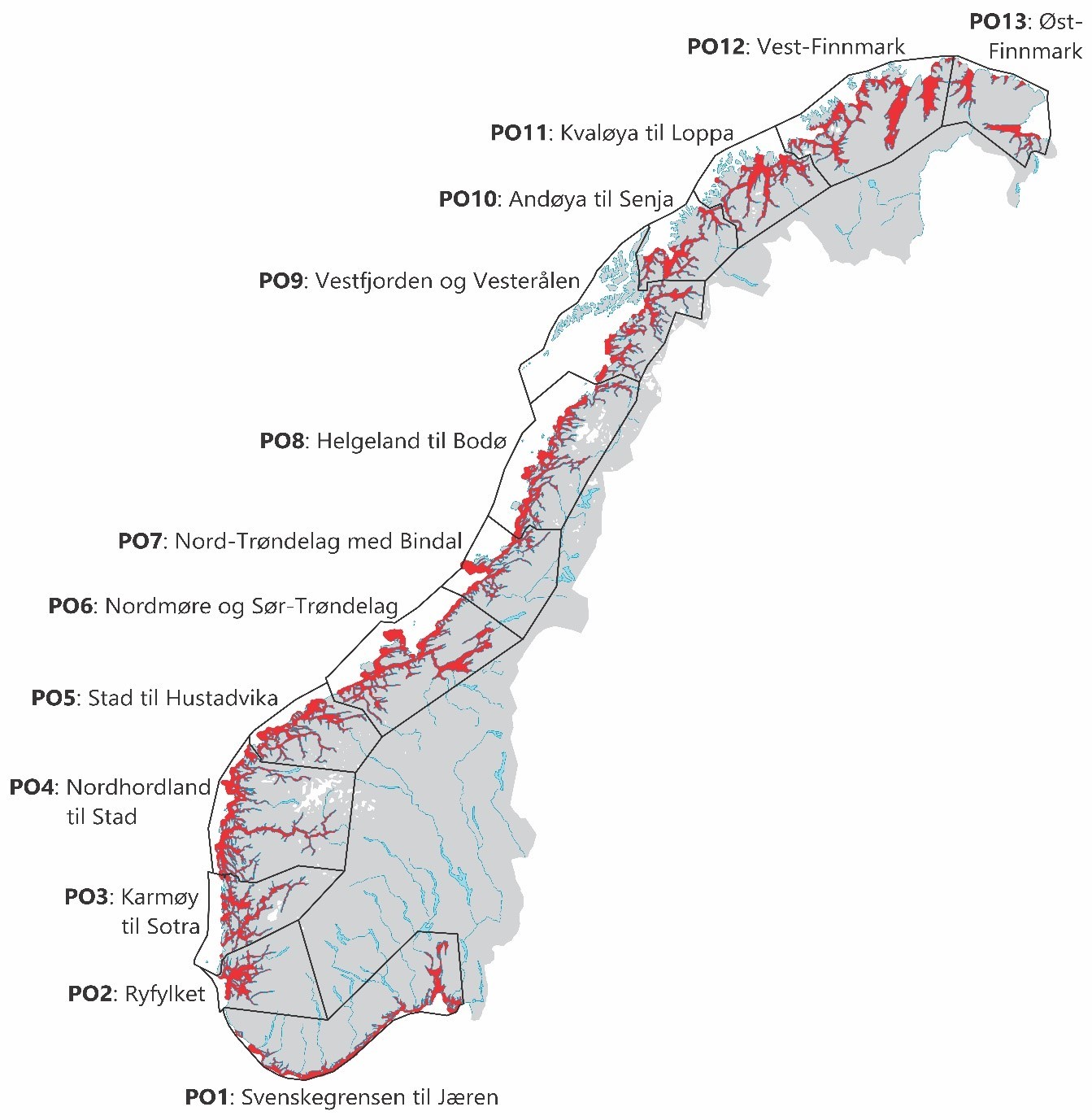
Per i dag reguleres den langsiktige produksjonen i lakseoppdrettsnæringen av trafikklyssystemet for lakseoppdrett som ble innført av Nærings- og fiskeridepartementet høsten 2017. I dette reguleringssystemet vurderes dødelighet på grunn av lakselus hos førtegangsvandrende villaks i 13 forhåndsdefinerte geografiske produksjonsområder som grunnlag for videre produksjonsvolum. For produksjonsområdene varierte den gjennomsnittlige stående biomasse av laksefisk i merder ved månedslutt mellom ca. 7 000 og 136 000 tonn, med høyest produksjon i PO6 og lavest produksjon i PO13 og PO1 (tabell 1).
|
Produksjonsområde |
Areal (km2) |
Biomasse (tonn) |
Tonn biomasse per km2 |
|---|---|---|---|
|
PO1: Svenskegrensen til Jæren |
3 864 |
12 112 |
3,13 |
|
PO2: Ryfylke |
1 977 |
44 722 |
22,62 |
|
PO3: Karmøy til Sotra |
3 558 |
96 932 |
27,24 |
|
PO4: Nordhordland til Stad |
5 584 |
90 984 |
16,29 |
|
PO5: Stad til Hustadvika |
3 950 |
47 328 |
11,98 |
|
PO6: Nordmøre og Sør-Trøndelag |
10 331 |
136 132 |
13,18 |
|
PO7: Nord-Trøndelag med Bindal |
5 182 |
65 518 |
12,64 |
|
PO8: Helgeland til Bodø |
12 766 |
83 796 |
6,56 |
|
PO9: Vestfjorden og Vesterålen |
16 115 |
93 284 |
5,79 |
|
PO10: Andøya til Senja |
4 640 |
70 224 |
15,13 |
|
PO11: Kvaløya til Loppa |
6 825 |
48 435 |
7,10 |
|
PO12: Vest-Finnmark |
10 683 |
75 043 |
7,02 |
|
PO13: Øst-Finnmark |
3 789 |
7 479 |
1,97 |
Den geografiske inndelingen av produksjonsområder sammenfaller relativt godt med bestandsinndelingen av kysttorsk, hvor oppdrett i PO1 til PO4 i stor grad overlapper med kysttorsk sør for 62°N, oppdrett i PO5 til PO8 hovedsakelig overlapper med kysttorsk fra 62°N – 67°N og oppdrett i PO9 til PO13 stort sett overlapper med kysttorsk nord for 67°N.
3 - Kysttorsk
Kysttorsk fra nærliggende områder er mer genetisk lik enn kysttorsk som lever lengre fra hverandre, noe som tyder på isolering mellom ulike populasjoner langs kysten
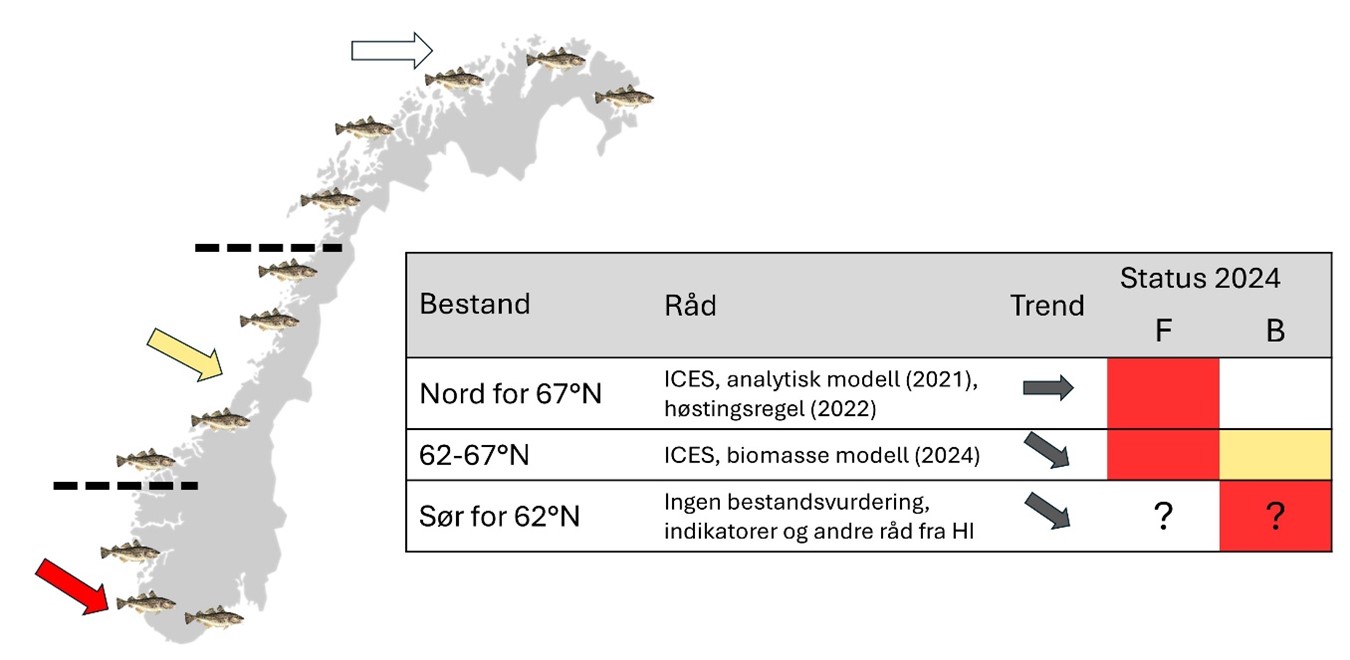
Sør for 62°N gis det ikke et eget kvoteråd på kysttorsk, men Havforskningsinstituttet har gitt tekniske forvaltningsråd, slik som minstemål, maskevidde og verneområder for å redusere beskatningen
Det fastsettes ikke egne fiskekvoter på de to bestandene av kysttorsk nord for 62°N, men kysttorskfangsten teller inn under den totale torskekvoten. Hovedgrunnen til dette er at kysttorsken i stor grad fiskes sammen med skrei i disse områdene. En kysttorsk kan ikke uten videre skilles fra en skrei i felt, og det mangler tilstrekkelig infrastruktur og ressurser for å identifisere andelen kysttorsk i fangstene gjennom fangstsesongen. Kysttorskfangsten anslås derfor når fiskeåret er avsluttet ved å analysere øresteiner (otolitter) fra fiskeriprøvetaking. Det er også mulig å skille kysttorsk og skrei genetisk med få dagers svartid
4 - Kartlegging av gytefelt og oppvekstområder
Bærekraftig forvaltning av marine ressurser forutsetter ikke bare regulering av uttaket, men også beskyttelse av bestemte habitattyper og områder der artene lever. For mange fiskeriressurser, befinner disse nøkkelområdene seg i kystnære strøk med til dels stor menneskelig påvirkning. Dette gjelder også for kysttorsk hvor menneskelige aktiviteter, som for eksempel etablering av akvakulturanlegg, vil kunne føre til fysiske og økologiske endringer av gytefelt og oppvekstområder som vil kunne påvirke både lokale bestander og større bestandskomplekser.
Gjennom «Nasjonalt program for kartlegging av marine naturtyper» har Havforskningsinstituttet kartlagt gytefelt for kysttorsk langs hele Norskekysten
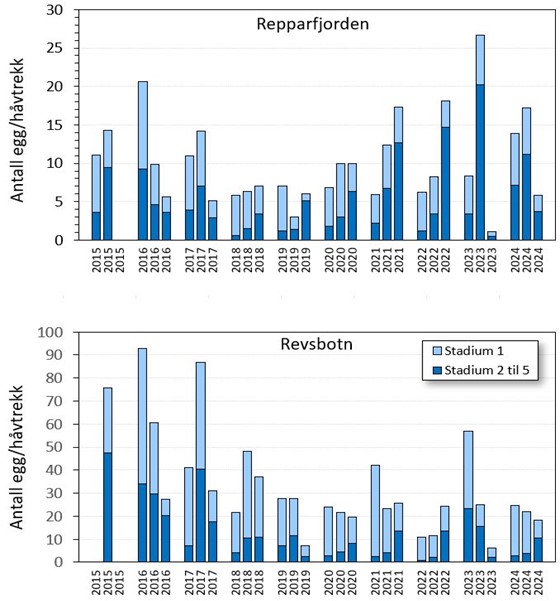
En viktig begrensning i denne kartleggingen er at de fleste områdene kun er undersøkt en gang i en gytesesong, og bare et begrenset antall av gytefeltene er undersøkt i flere gytesesonger. To gytefelt i Vest-Finnmark (Repparfjorden og Revsbotn) har imidlertid vært gjenstand for en grundigere overvåkning med tre besøk i gytesesongene (april-mai) fra 2015 til 2024
Havforskningsinstituttets kartlegging av gytefelt ble primært gjennomført inne i fjorder og på indre deler av kysten. Som følge av dette er flere områder i ytre strøk, blant annet svært viktige gyteområder som Lofoten, Vesterålen og Senja, utelatt (figur 2). For disse områdene representer den intervjubaserte gytefeltkartleggingen gjort av Fiskeridirektoratet den best tilgengelige kunnskapen. Selv om det ofte er god overenstemmelse mellom informasjon gitt av fiskerne og data fra feltinnsamling av egg med tilhørende oseanografisk modellering, er det i enkelte tilfeller avvik mellom disse to metodene. For eksempel kan intervjubaserte gytefelt reflektere gode fiskeplasser for gytemoden fisk og ikke nødvendigvis områder hvor fisken faktisk gyter. Alternativt, kan intervjubasert undersøkelser gi historisk informasjon som er vanskelig å skaffe gjennom feltundersøkelser. Alle kartlagte gytefelt er tilgjengelig gjennom Fiskeridirektoratets kartløsning Yggdrasil under “Kystnære fiskeridata”. Her viser kartlaget “Gytefelt Torsk MB” gytefelt kartlagt gjennom «Nasjonalt program for kartlegging av marine naturtyper», og kartlaget “Gyteområder torsk” viser gyteområder basert på Fiskeridirektoratets intervjuundersøkelser.
I motsetning til gytefelt, er ikke oppvekstområder for kysttorsk kartlagt. En av grunnen til dette er at torsk oppholder seg i et bredt spekter av habitater gjennom livet, og viktigheten av ulike områder varierer både med alder og sesong også for de yngre livsstadiene
5 - Produksjonsområde 1 – 4, Svenskegrensen til Stad, forvaltningsområde sør for 62°N
5.1 Lakseoppdrett
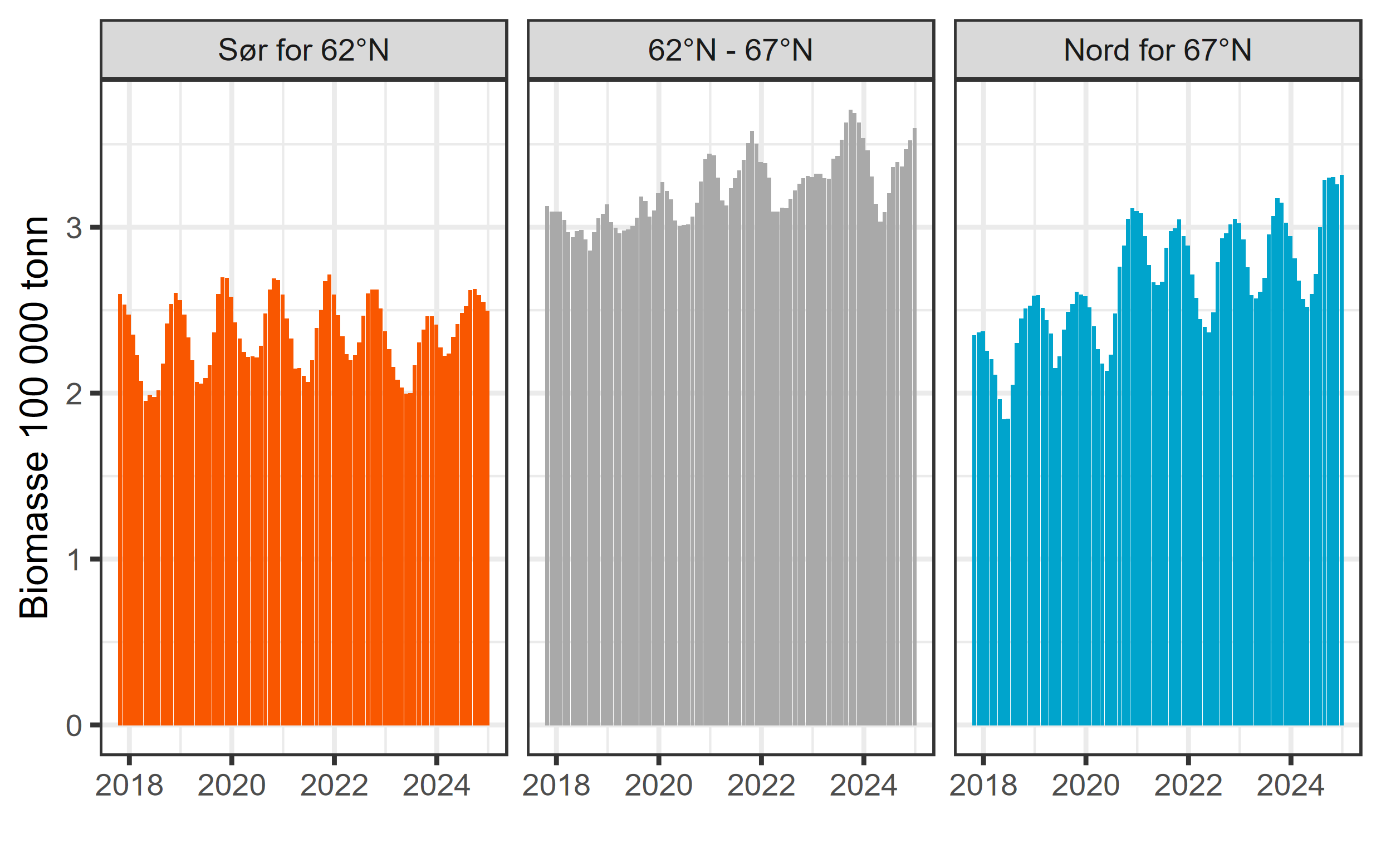
Fra 2018 til 2024 har den gjennomsnittlig månedlige biomassen av oppdrettslaks i produksjonsområdene sør for Stad vært stabil, med en årlig snittproduksjon på rundt 235 000 tonn (figur 4). I produksjonsområdene som overlapper med forvaltningsområdet for kysttorsk sør for 62°N er det stor variasjon i volum og tetthet. Høyest produksjon av laks og regnbueørret forekommer i PO4 og PO3 (91 000 – 97 000 tonn) og høyest tetthet forekommer i PO2 og PO3, med henholdsvis 23 og 27 tonn biomasse per km2 (tabell 1). Til sammenligning er det lite lakseoppdrett i PO 1, hvor tilnærmet all produksjon forekommer vest for Lindesnes. Basert på vurdering av dødelighet på utgående postsmolt laks for årene 2022 og 2023
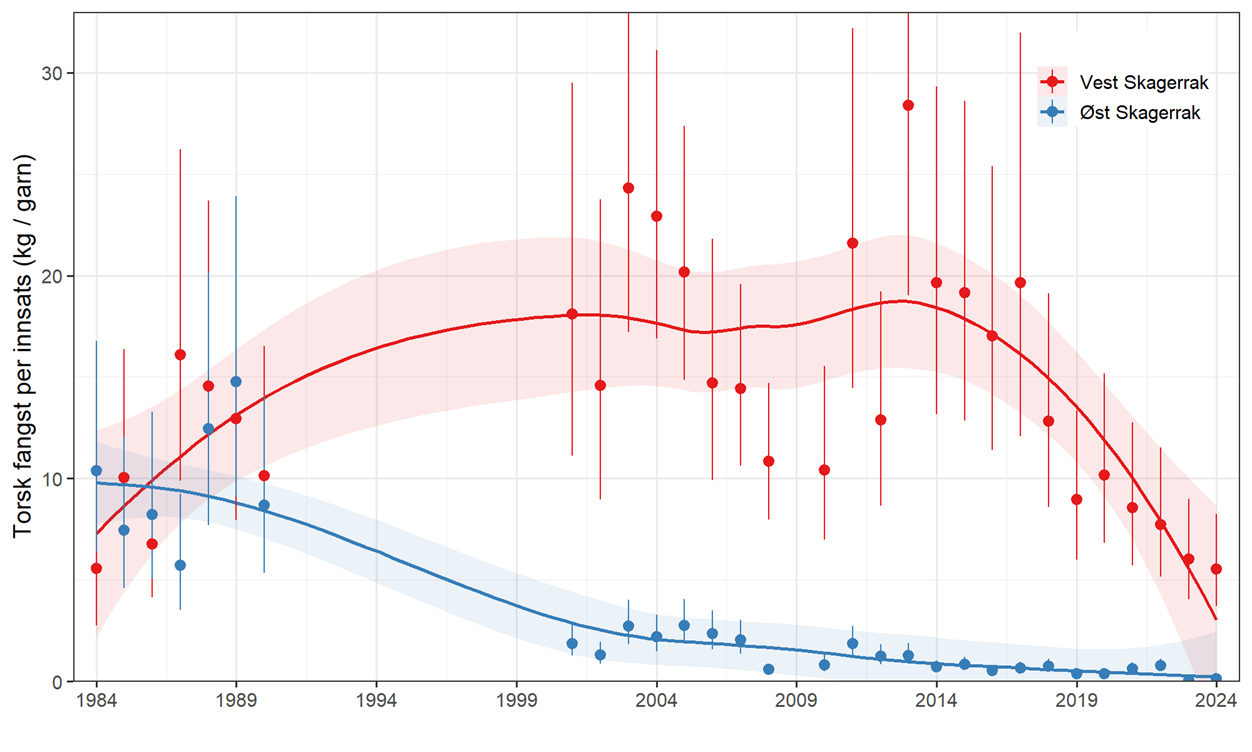
5.2. Status kysttorsk
Det finnes ikke en formell bestandsvurdering for kysttorsk sør for 62°N. Relevante data som kan informere om status ble imidlertid publisert i
5.3. Overlapp mellom oppdrettslokaliteter og gytefelt
For kystområdene inkludert i PO1 – PO4 er det en viss overlapp mellom viktige gytefelt for kysttorsk og oppdrettslokaliteter for laks og regnbueørret. Dette gjelder for eksempel Førdefjorden og fjordene rundt Osterøy, hvor det er en rekke oppdrettslokaliteter i regionalt viktige gytefelt.
6 - Produksjonsområde 5 – 8, Stad til Bodø, forvaltningsområde 62°N – 67°N
6.1. Lakseoppdrett
Fra 2018 til 2024 har den gjennomsnittlig månedlige biomassen av oppdrettslaks i produksjonsområdene fra Stad til Bodø økt med 10,9 %, fra ca. 300 000 tonn til litt i overkant av 333 000 tonn (figur 4), noe som tilsvarer en årlig vekst på litt under 2 %. Her er produksjonsvolumet desidert størst i PO6, som med sine 136 000 tonn stående biomasse representer det største volumet av alle produksjonsområdene (tabell 1). Tettheten av oppdrettslaks varierer mellom 12 og 13 tonn biomasse per km2 for de tre produksjonsområdene sør for Helgeland (PO5 – PO7, Tabell 1). Basert på vurdering av dødelighet på utgående postsmolt laks for årene 2022 og 2023 (Vollset mfl. 2023) vedtok regjeringen i 2024 ingen endringer i produksjonskapasiteten i PO5 – PO8.
6.2. Status kysttorsk
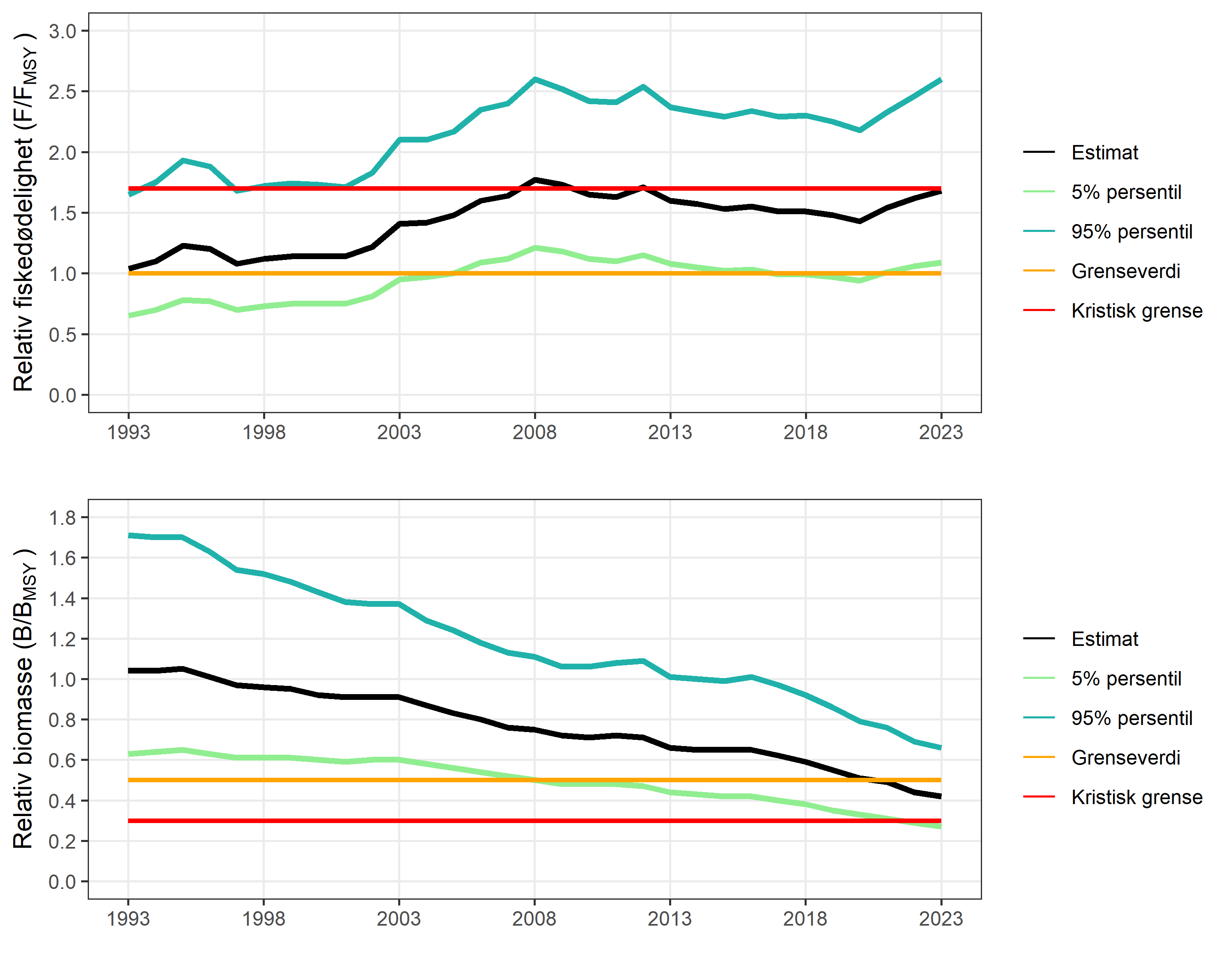
Bestandsvurderingen for kysttorsk 62°N – 67°N gjøres ved en produksjonsmodell
Videre har både kommersielle fangster og tetthetsindikatorer fra Havforskningsinstituttets overvåkningstokt vist en tydelig nedgang det siste tiåret. Det største problemet med den nåværende vurderingen av bestandsstatus for kysttorsk 62°N – 67°N er den høye usikkerheten rundt fangstene i turist- og fritidsfiske. Dette er spesielt problematisk da dette fisket sannsynligvis utgjør mer enn halvparten (ca. 60 %) av de totale fangstene. Det er allikevel tydelig at fangsten basert på nåværende fiske (7 378 tonn) er langt over bærekraftige nivåer når ICES sitt råd er på 1 926 tonn samlet for kommersielt fiske, turist- og fritidsfiske
6.3. Overlapp mellom oppdrettslokaliteter og gytefelt
For kystområdene inkludert i PO5 – PO8 forekommer det overlapp mellom viktige gytefelt for kysttorsk og lakseoppdrett. Dette gjelder for eksempel det nasjonalt viktige gytefeltet Nordfjorden – Beiarkjeften, hvor den samlede oppdrettskapasiteten i området er 36 000 tonn, inkludert 15 000 på selve gytefeltet
7 - Produksjonsområde 9 – 13, Vestfjorden til Øst-Finnmark, forvaltningsområde nord for 67°N
7.1. Lakseoppdrett
Fra 2018 til 2023 har den gjennomsnittlig månedlige biomassen av oppdrettslaks i produksjonsområdene nord for Bodø økt med 33 % fra ca. 222 000 tonn til ca. 294 000 tonn (figur 4), noe som tilsvarer en årlig vekst på ca. 5 %. I disse produksjonsområdene er det en betydelig stående biomasse i PO9, PO10 og PO12, hvor tettheten av laks (tonn biomasse per km2) er desidert høyest i PO10 (tabell 1). Basert på vurdering av dødelighet på utgående postsmolt laks for årene 2022 og 2023 (Vollset mfl. 2023) vedtok regjeringen i 2024 at alle produksjonsområdene på denne kyststrekningen kunne øke produksjonskapasiteten med inntil 6 %. Samlet sett representerer forvaltningsområdet for kysttorsk nord for 67°N den delen av kysten hvor det forventes størst vekst av lakseoppdrett i årene fremover.
7.2. Status kysttorsk nord for 67°N
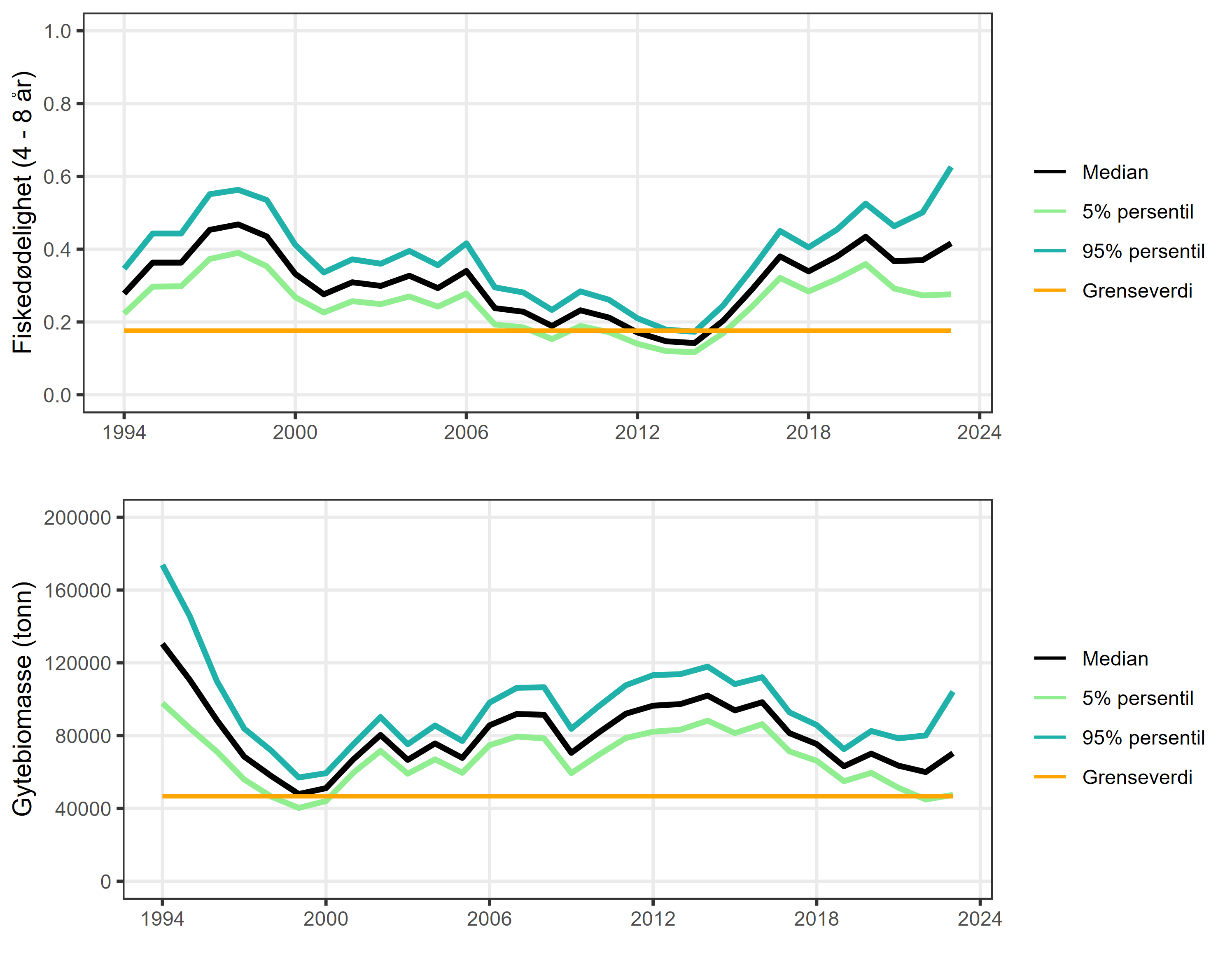
Datagrunnlaget for bestandsvurdering av kysttorsk nord for 67°N er bedre enn for kysttorsk i området 62°N – 67°N og ICES sin bestandsvurdering og kvoteråd gis basert på en aldersstrukturert bestandsmodell
Siden midten av 1990-tallet har fiskedødeligheten for kysttorsk nord for 67°N hovedsakelig vært langt over anbefalt nivå, og etter en periode med lavere dødelighet i 2011-2015 som følge av lavere fangster og påfølgende vekst i bestanden, har fiskedødeligheten igjen økt kraftig det siste tiåret (figur 7). Denne overbeskatningen reflekteres i gytebestanden, som i 2023 ble estimert til å være 70 330 tonn, noe som representerer en nedgang på 46 % siden starten av tidsserien (figur 7). I tillegg har andelen større/eldre fisk i bestanden blitt betydelig redusert siden 2015
7.3. Overlapp mellom oppdrettslokaliteter og gytefelt
En stor del av produksjonen i disse produksjonsområdene overlapper ikke med områder Havforskningsinstituttet har undersøkt i gytefeltkartleggingen for kysttorsk (figur 2). For disse områdene, som blant annet inkluderer Lofoten, Vesterålen og vestsiden av Senja, stammer tilgjengelig kunnskap fra intervjuer med fiskere. Til tross for at det er en viss usikkerhet knyttet til det samlede geografiske overlappet mellom lakseoppdrett og viktige gyteområder for kysttorsk nord for 67 °N, er det flere tilfeller hvor lakseoppdrett forekommer enten på, eller i nærheten av, svært viktige gytefelt. To eksempler på dette er Kvænangen og Revsbotn. I Kvænangen er det en samlet oppdrettskapasitet på 46 000 tonn, inkludert 24 000 tonn som er innenfor et regionalt viktig gytefelt til tross for at deler av fjorden er klassifisert som nasjonal laksefjord (Fall mfl. 2024). I Revsbotn er det to oppdrettsanlegg plassert innenfor et nasjonalt viktig gytefelt, med en samlet oppdrettskapasitet på 11 000 tonn (Fall mfl. 2024).
8 - Risikokilder for negative effekter av lakseoppdrett på ville torskebestander
Oppdrettsanlegg fungerer som fiskeansamlingsinnretninger ved at de fysiske strukturene tilbyr ly og habitat for ulike organismer, og ved økt tilgjengelighet av mat, hovedsakelig gjennom spillfôr
Tidligere har det blitt beskrevet av fiskere at torsk unngår områder med aktive oppdrettsanlegg
8.1. Endring i gytevandring
Vandringsadferden til torsk kan deles inn i fire hovedkategorier: 1) stasjonære individer som oppholder seg i samme begrensede område gjennom hele livet, 2) presise tilbakevandrere som vender tilbake til et spesifikt område flere ganger, 3) upresise tilbakevandrere som vender tilbake til et større geografisk område i løpet av livet og 4) spredere som tilsynelatende beveger seg i et tilfeldig mønster
For å kunne beskrive hvorvidt vandringsmønsteret til kysttorsk påvirkes av tilstedeværelsen av lakseoppdrett er det viktig å definere hva som menes med nettopp dette. Her definerer vi vandringsmønster som bevegelser relatert til gyteområder og ikke bevegelser mellom ulike beiteområder. Effektene av endring i beiteadferd og/eller beiteområder som følge av lakseoppdrett i åpne merder beskrives i detalj i kapitel 8.2. Feilærnæring. Gitt premisset om at akvakulturvirksomhet ikke konsekvent frastøter torsk kan lakseoppdrett påvirke kysttorskens vandringsmønster ved at tilstedeværelsen av oppdrettsanlegg fører til en så sterk tiltrekning av torsken ikke vandrer tilbake til det påtenkte gytefeltet. I tillegg kan oppdrettsanlegg plasseres på gytefelt og dermed hindrer fisken i å gyte her. Begge tilfeller kan føre til at torsken gyter i et mindre gunstig område med eksempelvis lavere retensjon av egg. Videre kan også endringer i vandringsmønster mellom gytefelt ha en negativ effekt på bestandsrektrutteringen. I en nylig publisert studie ble det vist at store hunntorsk benyttet seg av flere gytefelt i samme gyteperiode
Telemetristudier gjennomført rundt Smøla indikerte at torsk fanget og merket på lokale gyteplasser, i liten grad virket å gyte ved lakseoppdrettsanlegg i nærheten av disse gyteplassene, men kunne tilbringe mye tid ved anleggene etter endt gyting
Torsk er vist å samle seg på gyteplasser, hvor hannene oppholder seg i små territorier over lengre perioder
8.2. Feilernæring
Torsk er en generalist som endrer diett gjennom livsløpet. Generelt sett består diettene til torsk under 20 cm hovedsakelig av krill og andre små pelagiske byttedyr, med en økende viktighet av bunndyr og større byttefisk med økende størrelse
Endring i fettsyresammensetning
Siden 1990 har andelen marine ingredienser i oppdrettsfôret minket betraktelig og i 2020 bestod over 70 % av fôret av plantematerialer
Per nå er det lite kunnskap om konsekvensene av en slik feilernæring og undesøkelser gjort i laboratorier har vist at torsk tolererer en plantebasert diett og kan opprettholde vekst så lenge fisken får nok marine omega-3 fettsyrer
8.3. Fremmedstoffer
Miljøgifter og tungmetaller i laksefôr
Miljøgifter
Tidligere, da laksefôr hovedsakelig bestod av fiskeolje og fiskemel fra pelagisk fisk kunne fôret inneholde relativt høye nivåer av persistente organiske miljøgifter (POP-er)
Plantebaserte fôringredienser kan ha rester av sprøytemidler fra landbruk
I dag er glyfosat (Roundup produktene) det mest brukte plantevernmiddelet både globalt og i Norge; en rolle virkestoffet har hatt siden midten av 1990-tallet da glyfosattolerante genmodifiserte planter, særlig soya, kom på markedet
Tungmetaller
Av tungmetallene er det knyttet størst bekymring til kvikksølv, ettersom det kan hindre utvikling og forårsake nevrologiske skader i både mennesker og dyr. I likhet med andre tungmetaller og POP-er, oppkonsentreres kvikksølv i dyr på toppen av næringskjeden. Skiftet fra fiskebasert til plantebasert fôr har redusert nivåene av uønskede tungmetaller i oppdrettslaksen betraktelig
Et annet tungmetall som har fått en del fokus i risikovurderingen av lakseoppdrett er kobber. Kobber forekommer naturlig i marine miljøer og er et viktig metall for enkelte enzymreaksjoner, men kan være giftig dersom konsentrasjonen blir for høy. Utslipp av kobber fra fiskeoppdrett kan forekomme via spillfȏr og ekskrementer, men de høyeste konsentrasjoner kommer fra impregnering av nøter der det brukes for å forhindre begroing. Det er påvist forhøyede kobbernivåer i sedimentene rundt anlegg som ligger i områder med lite til moderat strøm og der det har vært oppdrett over lang tid
Miljøgifter og tungmetaller brukt som antigromiddel
Kobber sammen med andre tungmetall kan i tilstrekkelig høye konsentrasjoner hemme klekkeenzymet hos fiskeegg og med det påvirke rekruttering
Avlusningsmidler
Avlusningsmidlene som brukes av oppdrettsindustrien kan deles inn i to grupper, de som brukes til badebehandling og de som administreres til fisken via fôret. Siden toppåret i 2016, har det vært en årlig nedgang i bruk av legemidler mot lakselus. Denne reduksjonen er forårsaket av at oppdrettere har tatt i bruk ikke-medikamentelle metoder som varmt vann, ferskvann og mekanisk fjerning av lakselus.
I 2023, ble det brukt totalt 939 kg fôravlusningsmidler. Dette inkluderte 865 kg flubenzuroner og 74 kg emamektin-benzoat, bedre kjent ved legemiddelnavnet Slice. Flurbenzuroner hemmer syntesen av kitin og er derfor et effektive avlusningsmidler på alle stadier av lakselus som gjennomgår skallskifte, men også dødelig for andre organismer som er avhengig av å produsere kitin i løpet av livssyklusen. I 2017 innførte Fiskeridirektoratet nye regler for å hindre uakseptabel bruk av kitinhemmere, hvor det blant annet ble presisert at slike legemidler ikke skal brukes innenfor 1000 m fra rekefelt. Undersøkelser av flurbenzuroner i fisk fanget nært oppdrettsanlegg har påvist generelt lave konsentrasjoner, med unntak av hos enkelte sei som sannsynligvis hadde spist spillfôr
Emamektin benzoat (emamektin), forårsaker hyperpolarisering av nerveceller og fører til død av alle utviklingsstadier av lakselus. Stoffets er svært perisent i sediment og kan ha en halveringstid på over flere år under spesifikke miljøforhold
Torsk som oppholder seg nært lakseoppdrett kan i tillegg til å bli indirekte eksponert for skadelige kjemiske stoffer via spillfȏr og beiting på oppdrettspåvirkede byttedyr (se kapittel 8.3 Miljøgifter og tungmetaller i laksefôr) også utsettes for slike stoffer direkte via bruk av avlusningsmidler. Av badebehandlingene er hydrogenperoksid det desidert mest brukte middelet i antall kilo, men forbruket er blitt redusert med 96 % fra toppåret 2015. I 2023 ble det totalt brukt 1 571 tonn hydrogenperoksid som avlusningsmiddel
Studier som har undersøkt effekten av hydrogenperoksid på fisk, er hovedsakelig gjort på laksefisk, ved konsentrasjoner brukt i behandling
Azametifos er svært vannløselig og har dermed lav sannsynlighet for å binde seg til organisk materiale. Etter behandling vil stoffet hovedsakelig spres i miljøet via overflatestrømmer. Modelleringsstudier har vist at konsentrasjonen av azametifos rundt oppdrettsanlegg i løpet av 24 timer reduseres fra 100 µg/l til 0,2 µg/l i strømfattige områder og til 0,02 µg/l i områder med mye strøm
8.4. Endring i sykdomsforekomst og smitte
I lakseoppdrett kan det forekomme sykdom forårsaket av både parasitter, virus og bakterier. Smittespredning vil påvirkes av mange ulike forhold, og vil variere med agens. Antallet og omfanget av utbrudd, dvs. mengden syk fisk som skiller ut smittestoff over tid, vil bestemme smittepresset på villfisk i omgivelsene. Agensets overlevelse i miljøet vil være viktig for spredningspotensialet, og vil påvirkes av miljøforhold som sollys (UV), temperatur, strøm og salinitet.
Mottakelige verter er en forutsetning for at smitte skal overføres fra oppdrettsfisk til villfisk. Smitte fra oppdrettslaks til villtorsk kan skje direkte, men også indirekte ved at andre mottagelige arter i miljøet overfører sykdom fra oppdrettslaks til torsk. Ansamlinger av villfisk rundt oppdrettsanlegg vil kunne utsettes for smitte om det er et pågående utbrudd på oppdrettslokaliteten og øker dermed sannsynligheten for smittespredning. I dagens lakseoppdrett er det fiskelus, bendelorm, encellede gjelleparasitter, ulike virus og bakterielle sårinfeksjoner som dominerer. De fleste av disse agensene er verts-spesifikke, og har derfor liten evne til å smitte ubeslektede arter som torsk. Vi vil her omtale de agens og sykdommer som forekommer i lakseoppdrett med søkelys på de organismen som kan smitte villtorsk.
Parasitter
Fiskelus (Caligidae) utgjør en stor utfordring for den globale akvakulturindustrien. Disse parasittiske krepsdyrene smitter direkte, enten ved at voksne lus bytter vertsindivid eller ved planktoniske larver som spres i vannet. I Norge finnes to vanlige arter fiskelus i åpne laksemerder: lakselus (Lepeophtheirus salmonis) og skottelus (Caligus elongatus). Lakselus forekommer bare på laksefisk, mens skottelus er lite artsspesifikk og kan forekomme hos over 80 marine fiskearter, inklusiv lakse- og torskefisk
Genetiske undersøkelser har identifisert to varianter av skottelus langs Norskekysten, med forskjellig vertstilfang
Av andre parasitter kan den encellede amøben Paramoeba perurans, som forårsaker amøbegjellesykdom (AGD) gi store velferdsproblemer for laks i oppdrett. Amøben er ikke vertsspesifikk og kan infisere og forårsake sykdom også hos rensefisk
Trichodina spp. er ciliater som angriper hud og gjeller og kan forårsake skader og dødelighet hos både torsk og laks i oppdrett
Virussykdommer
De mest alvorlige virussykdommene i lakseoppdrett er forårsakes av virus som er laksefisk-spesifikke. Dette inkluderer blant annet salmonid alfavirus (SAV) som kan forårsake pankreas sykdom (PD), infeksiøs lakeanemi virus (ILAV) som kan forårsake infeksiøs lakseanemi og PRV1 som kan forårsake hjerte og skjelettmuskelbetennelse (HSMB). Ingen av disse virusene er påvist hos torsk eller annen torskefisk
Oppdrettslaks plages av poxvirusinfeksjoner i gjellene, gjerne sammen med andre gjelleinfeksjoner. Smitten skjer primært i ferskvann, men kan også forekomme i sjø. Nylig er det påvist poxvirus også på oppdrettstorsk, men dette dreier seg om et eget, lite kjent virus (cod gill poxvirus, CGPV)
Et virus med lavere artsspesifisitet er infeksiøs pankreas nekrose virus (IPNV). Sykdommen infeksiøs pankreas nekrose (IPN) var i mange år en stor utfordring for oppdrettsnæringen inntil man startet å bruke en mer resistent laks. I 2023 ble viruset påvist på 43 lokaliteter med laks, noen representerer en dobling fra året før
Et annet virus som kan smitte mellom marine fiskearter er viral hemoragisk septikemi virus (VHSV). Dette er et virus med bredt vertsspekter, med flere varianter (genotyper) i både fersk- og saltvann
Bakterielle sykdommer
Laksefisk i oppdrett er i dag godt beskyttet mot bakterier som tidligere forårsaket alvorlige sykdommer gjennom vaksinering. Det er derfor få utbrudd av vibriose (forårsaket av Vibrio anguillarum), kaldtvannsvibriose (Aliivibrio salmonicida) eller furunkulose (Aeromonas salmonicida subsp. salmonicida) i oppdrett av laksefisk. Følgelig utøves det ikke noe relevant smittepress av disse bakteriene på villfisk. Det finnes varianter (serotyper) av V. anguillarum og underarter av Aeromonas salmonicida som er mer vanlige å finne hos torsk, men disse forekommer ikke hos laks i oppdrett. Det ansees derfor som lite sannsynlig at vibriose- og furunkulose vil forekomme hos villtorsk som følge av smitte fra lakseoppdrett.
Sårproblematikk hos oppdrettsfisk kan være utfordrende til tider og skaper både velferdsutfordringer og dødelighet. Moritella viscosa, som forårsaker klassisk vintersår, og ulike varianter av Tenacibaculum spp. isoleres ofte fra laksefisk med sårskader. Fra oppdrettstorsk med sår er det blitt påvist både både M. viscosa
Pasteurellose er et problem for rognkjeks og laks i oppdrett. Det er to ulike varianter av bakterien, Pasteurella spp., som forårsaker sykdom hos de ulike artene
Yersiniose (Yersinia ruckeri) har vært en utfordring i lakseoppdrett i deler av Norge. Bakterien smitter hovedsakelig i ferskvann, men smitte i sjø kan forekomme, og på Island er det registrert utbrutt av yersiniose hos oppdrettstorsk
Branchiomonas cysticola er en bakterie som er vanlig i forbindelse med gjellebetennelse og sykdommen epiteliocystis hos oppdrettslaks. Nylig er det påvist Branchiomonas varianter i marine fisk, inklusivt i torsk med gjellesykdom
9 - Referanser
Aas TS, Åsgård T, Ytrestøyl T (2022) Utilization of feed resources in the production of Atlantic salmon (Salmo salar) in Norway: An update for 2020. Aquaculture Reports 26: 101316.
Aglen A, Nedreaas A, Knutsen E, Kleiven H, Johannessen AR, Jørgensen T, Olsen SH, Knutsen O (2016) Kunnskapsstatus kysttorsk i sør (Svenskegrensa-Stadt) 2016. Fisken og havet 2016–4: 48 s.
Arechavala-Lopez P, Sæther BS, Marhuenda-Egea F, Sanchez-Jerez P, Uglem I (2015) Assessing the influence of salmon farming through total lipids, fatty acids, and trace elements in the liver and muscle of wild saithe Pollachius virens. Marine and Coastal Fisheries 7: 59–67.
Bannister RJ, Johnsen IA, Hansen PK, Kutti T, Asplin L (2016) Near- and far-field dispersal modelling of organic waste from Atlantic salmon aquaculture in fjord systems. ICES Journal of Marine Science 73: 2408–2419.
Barrett LT, Swearer SE, Harboe T, Karlsen Ø, Meier S, Dempster T (2018) Limited evidence for differential reproductive fitness of wild Atlantic cod in areas of high and low salmon farming density. Aquaculture Environment Interactions 10: 369–383.
Barrett LT, Swearer SE, Dempster T (2019) Impacts of marine and freshwater aquaculture on wildlife: a global meta-analysis. Reviews in Aquaculture 11: 1022–1044.
Barth JMI, Villegas-Ríos D, Freitas C, Moland E, Star B, André C, Knutsen H, Bradbury I, Dierking J, Petereit C, Righton D, Metcalfe J, Jakobsen KS, Olsen EM, Jentoft S (2019) Disentangling structural genomic and behavioural barriers in a sea of connectivity. Molecular Ecololgy 28: 1394–1411.
Berntssen MHG, Julshamn K, Lundebye AK (2010) Chemical contaminants in aquafeeds and Atlantic salmon (Salmo salar) following the use of traditional- versus alternative feed ingredients. Chemosphere 78: 637–646.
Bjørn PA, Uglem I, Kerwath S, Sæther BS, Nilsen R (2009) Spatiotemporal distribution of Atlantic cod (Gadus morhua L.) with intact and blocked olfactory sense during the spawning season in a Norwegian fjord with intensive salmon farming. Aquaculture 286: 36–44.
Bøhn T, Millstone E (2019) The introduction of thousands of tonnes of glyphosate in the food chain—An evaluation of glyphosate tolerant soybeans. Foods 8: 669.
Bøhn T, Strøm JF, Sanchez-Jerez P, Keeley NB, Johansen T, Gjelland K, Sandlund N, Sæther BS, Sætra I, Olsen EM, Skjæraasen JE, Meier S, van der Meeren T, Bjørn PA (2024) Ecological interactions between farmed Atlantic salmon and wild Atlantic cod populations in Norway: A review of risk sources and knowledge gaps. Reviews in Aquaculture 16: 1333–1350.
Breistein B, Dahle G, Johansen T, Besnier F, Quintela M, Jorde PE, Knutsen H, Westgaard JI, Nedreaas K, Farestveit E, Glover KA (2022) Geographic variation in gene flow from a genetically distinct migratory ecotype drives population genetic structure of coastal Atlantic cod (Gadus morhua L.). Evolutionary Applications 15: 1162–1176.
Bustnes JO, Lie E, Herzke D, Dempster T, Bjørn PA, Nygård T, Uglem I (2010) Salmon farms as a source of organohalogenated contaminants in wild fish. Environmental Science and Technology 44: 8736–8743.
Bustnes J, Nygård T, Dempster T, Ciesielski T, Jensen B, Bjørn P, Uglem I (2011) Do salmon farms increase the concentration of mercury and other elements in wild fish? Journal of Environmental Monitoring 13: 1687–1694.
Callier MD, Byron CJ, Bengtson DA, Cranford PJ, Cross SF, Focken U, Jansen HM, Kamermans P, Kiessling A, Landry T, O’Beirn F, Petersson E, Rheault RB, Strand Ø, Sundell K, Svåsand T, Wikfors GH, McKindsey CW (2018) Attraction and repulsion of mobile wild organisms to finfish and shellfish aquaculture: a review. Reviews in Aquaculture 10: 924–949.
Colquhoun DJ, Hovland H, Hellberg H, Haug T, Nilsen H (2004) Moritella viscosa isolated from farmed Atlantic cod (Gadus morhua). Bulletin of the European Association of Fish Pathologists 24: 109.
Dahle G, Quintela M, Johansen T, Westgaard JI, Besnier F, Aglen A, Jørstad KE, Glover KA (2018) Analysis of coastal cod (Gadus morhua L.) sampled on spawning sites reveals a genetic gradient throughout Norway’s coastline. BMC Genetics 19: 42.
Dale OB, Ørpetveit I, Lyngstad TM, Kahns S, Skall HF, Olesen NJ, Dannevig BH (2009) Outbreak of viral haemorrhagic septicaemia (VHS) in seawater-farmed rainbow trout in Norway caused by VHS virus Genotype III. Disease of Aquatic Organisms 85: 93–103.
Dean MJ, Hoffman WS, Zemeckis DR, Armstrong MP (2014) Fine-scale diel and gender-based patterns in behaviour of Atlantic cod (Gadus morhua) on a spawning ground in the Western Gulf of Maine. ICES Journal of Marine Science 71: 1474–1489.
Dempster T, Sanchez-Jerez P, Fernandez-Jover D, Bayle-Sempere J, Nilsen R, Bjørn PA, Uglem I (2011) Proxy measures of fitness suggest coastal fish farms can act as population sources and not ecological traps for wild gadoid fish. PLoS One 6: e15646.
Dempster T, Sanchez-Jerez P, Uglem I, Bjørn PA (2010) Species-specific patterns of aggregation of wild fish around fish farms. Estuarine, Coastal and Shelf Science 86: 271–275.
Dempster T, Uglem I, Sanchez-Jerez P, Fernandez-Jover D, Bayle-Sempere J, Nilsen R, Bjørn PA (2009) Coastal salmon farms attract large and persistent aggregations of wild fish: An ecosystem effect. Marine Ecology Progress Series 385:1–14.
Dunlop K, Staby A, van der Meeren T, Keeley N, Olsen EM, Bannister R, Skjæraasen JE (2022) Habitat associations of juvenile Atlantic cod (Gadus morhua L.) and sympatric demersal fish communities within shallow inshore nursery grounds. Estuarine, Coastal and Shelf Science 279: 108111.
Dunlop K, Strammer I, Keeley N (2024) Attraction and avoidance of wild demersal fish and crustaceans to open-net aquaculture pens resolved by baited and towed underwater camera surveys. Frontiers in Marine Science 11.
Espeland SH, Albretsen J, Nedreaas K, Sannaes H, Bodvin T, Moy F (2013) Kartlegging av gytefelt gytefelt for kysttorsk. Fisken og havet 2013–1: 43 s.
Fall J, Nedreaas K, Ono K, Otterå H, Gundersen S (2024) Kartlegging av menneskelig aktivitet på utvalgte gytefelt for kysttorsk nord for 62°N. Rapport fra havforskningen 2024–9: 174 s.
Fernandez-Jover D, Martinez-Rubio L, Sanchez-Jerez P, Bayle-Sempere JT, Lopez Jimenez JA, Martínez Lopez FJ, Bjørn PA, Uglem I, Dempster T (2011) Waste feed from coastal fish farms: A trophic subsidy with compositional side-effects for wild gadoids. Estuarine, Coastal and Shelf Science 91: 559–568.
Fourdain L, Arechavala-Lopez P, Uglem I, Sæther BS, Sanchez-Jerez P (2022) Spatiotemporal variations in trace element compositions in pollock populations under the influence of coastal Norwegian salmon farms. Marine and Coastal Fisheries 14: e10193.
Gjessing MC, Tengs T, Nilsen H, Mohammad S, Weli SC (2024) The first report of cod gill poxvirus in gills of Atlantic cod (Gadus morhua L.) suffering from cardiorespiratory disease. Journal of Fish Diseases e14078.
González-Irusta JM, Wright PJ (2016) Spawning grounds of Atlantic cod (Gadus morhua) in the North Sea. ICES Journal of Marine Science 73: 304–315.
Grefsrud ES, Andersen LB, Grøsvik BE, Hansen PK, Husa V, Karlsen Ø, Madhun AS, Samuelsen O, Sandlund N, Solberg MF, Stien LH (2025) Risikorapport norsk fiskeoppdrett 2025 - produksjonsdødelighet hos oppdrettsfisk og miljøeffekter av norsk fiskeoppdrett. Rapport fra havforskningen 2025.
Gudmundsdottir BK, Gudmundsdottir S, Gudmundsdottir S, Magnadottir B (2014) Yersiniosis in Atlantic cod, Gadus morhua (L.), characterization of the infective strain and host reactions. Journal of Fish Diseases 37: 511–519.
Gulla S, Colquhoun DJ, Olsen AB, Spilsberg B, Lagesen K, Åkesson CP, Strøm S, Manji F, Birkbeck TH, Nilsen HK (2023) Phylogeography and host specificity of Pasteurellaceae pathogenic to sea-farmed fish in the north-east Atlantic. Frontiers in Microbiology 14.
Hansen AC, Hemre GI (2013) Effects of replacing fish meal and oil with plant resources in on-growing diets for Atlantic cod Gadus morhua L. Aquaculture Nutrition 19: 641–650.
Hansen P, Kutti T, Husa V, Keeley N, Dunlop K (2022) Miljøpåvirkning på bunn som følge av partikulærte organiske utslipp fra fiskeoppdrett. I Risikorapport norsk fiskeoppdrett 2022 – kunnskapsstatus. Rapport fra havforskningen 2022–13.
Haugland GT, Olsen AB, Rønneseth A, Andersen L (2017) Lumpfish (Cyclopterus lumpus L.) develop amoebic gill disease (AGD) after experimental challenge with Paramoeba perurans and can transfer amoebae to Atlantic salmon (Salmo salar L.). Aquaculture 478: 48–55.
Hemmingsen W, MacKenzie K, Sagerup K, Remen M, Bloch-Hansen K, Imsland AKD (2020) Caligus elongatus and other sea lice of the genus Caligus as parasites of farmed salmonids: A review. Aquaculture 522: 735160.
Henriksson S, Pereyra RT, Sodeland M, Ortega-Martinez O, Knutsen H, Wennhage H, André C (2023) Mixed origin of juvenile Atlantic cod (Gadus morhua) along the Swedish west coast. ICES Journal of Marine Science 80: 145–157.
Heuch PA, Øines Ø, Knutsen JA, Schram TA (2007) Infection of wild fishes by the parasitic copepod Caligus elongatus on the south east coast of Norway. Disease of Aquatic Organisms 77: 149–158.
Heuch PA, Jansen PA, Hansen H, Sterud E, MacKenzie K, Haugen P, Hemmingsen H (2011) Parasite faunas of farmed cod and adjacent wild cod populations. Aquaculture Environment Interactions 2: 1–13.
Hites RA, Foran JA, Carpenter DO, Hamilton MC, Knuth BA, Schwager SJ (2004) Global assessment of organic contaminants in farmed salmon. Science 303: 226–229.
Holt RE, Bogstad B, Durant JM, Dolgov A V, Ottersen G (2019) Barents Sea cod (Gadus morhua) diet composition: long-term interannual, seasonal, and ontogenetic patterns. ICES Journal of Marine Science 76: 1641–1652.
ICES (2016) Technical Guidelines - Definitions of stock status. ICES Technical Guidelines. ICES Technical Guidelines 2016.
ICES (2021) Benchmark Workshop for Barents Sea and Faroese Stocks (WKBARFAR 2021). ICES Scientific Reports 3: 205 s.
ICES (2022a) Norwegian request for evaluation of management of Norwegian coastal cod north of 67° N. I Report of the ICES Advisory Committee, 2022. ICES Advice 2022, sr.2022.08.
ICES (2022b) Workshop on the evaluation of northern Norwegian coastal cod harvest control rules (WKNCCHCR). ICES Scientific Reports 4: 115 s.
ICES (2024a) Arctic Fisheries Working Group (AFWG). ICES Scientific Reports 6: 375 s.
ICES (2024b) Cod (Gadus morhua) in Subarea 2 between 62°N and 67°N (Norwegian Sea), southern Norwegian coastal cod. I Report of the ICES Advisory Committee, 2024. ICES Advice 2024, cod.27.1-2coastN.
ICES (2024c) Cod (Gadus morhua) in subareas 1 and 2 north of 67°N (Norwegian Sea and Barents Sea), northern Norwegian coastal cod. I Report of the ICES Advisory Committee, 2024. ICES Advice 2024, cod.27.1-2coastN.
Jensen I, Seppola M, Steiro K, Sandaker E, Mennen S, Sommer AI (2009). Susceptibility of Atlantic cod Gadus morhua juveniles to different routes of experimental challenge with infectious pancreatic necrosis virus (IPNV). Diseases of Aquatic Organisms 85: 105-113.
Johansen T, Westgaard JI, Seliussen BB, Nedreaas K, Dahle G, Glover KA, Kvalsund R, Aglen A (2018) ‘Real-time’ genetic monitoring of a commercial fishery on the doorstep of an MPA reveals unique insights into the interaction between coastal and migratory forms of the Atlantic cod. ICES Journal of Marine Science 75: 1093–1104.
Johansen T, Besnier F, Quintela M, Jorde PE, Glover KA, Westgaard JI, Dahle G, Lien S, Kent MP (2020) Genomic analysis reveals neutral and adaptive patterns that challenge the current management regime for East Atlantic cod Gadus morhua L. Evolutionary Applications 13: 2673–2688.
Karlsbakk E, Isaksen E, Hamre L (2009) Hva vet vi om parasitter og oppdrett av torsk? Fisken og havet 2009 – 2: 4 s.
Khan RA (1991) Mortality in Atlantic salmon (Salmo salar) associated with trichodinid ciliates. Journal of Wildlife Diseases 27: 153–155.
Khan RA (2004) Disease outbreaks and mass mortality in cultured Atlantic cod, Gadus morhua L., associated with Trichodina murmanica (Ciliophora). Journal of Fish Diseases 27: 181–184.
King AM (2023) The sea louse Caligus elongatus (Caligidae). Hosts susceptibility to the two genotypes. Masteroppgave, Universitetet i Bergen, 48 s.
Knutsen H, Jorde PE, Hutchings JA, Hemmer-Hansen J, Grønkjær P, Jørgensen KEM, André C, Sodeland M, Albretsen J, Olsen EM (2018) Stable coexistence of genetically divergent Atlantic cod ecotypes at multiple spatial scales. Evolutionary Applications 11:1527–1539.
Kristensen ML, Olsen EM, Moland E, Knutsen H, Grønkjær P, Koed A, Källo K, Aarestrup K (2021) Disparate movement behavior and feeding ecology in sympatric ecotypes of Atlantic cod. Ecology and Evolution 11: 11477–11490.
Link J, Garrison L (2002) Trophic ecology of Atlantic cod Gadus morhua on the northeast US continental shelf. Marine Ecology Progress Series 227: 109–123.
Lopes AR, Moraes JS, Martins C de MG (2022) Effects of the herbicide glyphosate on fish from embryos to adults: a review addressing behavior patterns and mechanisms behind them. Aquatic Toxicology 251: 106281.
Lorenzen E, Olesen NJ, Strøm A, Evensen Ø (1995) Outbreaks of IPN in reared fry of Atlantic cod (Gadus morhua). European Association of Fish Pathologists, Seventh international conference "Diseases of Fish and Shellfish": 38 s.
Lundebye AK, Lock EJ, Rasinger JD, Nøstbakken OJ, Hannisdal R, Karlsbakk E, Wennevik V, Madhun AS, Madsen L, Graff IE, Ørnsrud R (2017) Lower levels of Persistent Organic Pollutants, metals and the marine omega 3-fatty acid DHA in farmed compared to wild Atlantic salmon (Salmo salar). Environmental Research 155: 49–59.
Lundebye A-K, Lie KK, Storesund J, Sele V (2024) Program for overvåking av fiskefôr - Årsrapport for prøver innsamlet i 2023. Rapport fra havforskningen 2024–28: 42 s.
Maurstad A, Dale T, Bjørn PA (2007) You wouldn’t spawn in a septic tank, would you? Human Ecology 35: 601–610.
Meier S, van der Meeren T, Skjæraasen JE, Bannister RJ, Rasinger JD, Karlsen Ø (2023) Terrestrial fatty acids from feed oil in feed for farmed salmonids are transferred to the liver, gonads, and muscle of wild Atlantic cod (Gadus morhua). ICES Journal of Marine Science 80: 1143–1154.
Miyazaki J, Bauer-Panskus A, Bøhn T, Reichenbecher W, Then C (2019) Insufficient risk assessment of herbicide-tolerant genetically engineered soybeans intended for import into the EU. Environmental Science Europe 31: 92.
Mohammadisefat P, Zorriehzahra MJ, Adel M, Chamjangali ZA, Jabbari M, Eftekhari A, Farzipour H, Jazi SY (2023) Viral hemorrhagic septicemia virus (VHSV), past, present and future: a review. International Aquatic Research 15: 191–203.
Moland E, Synnes A-E, Naustvoll L-J, Brandt CF, Norderhaug KM, Thormar J, Biuw M, Jorde PE, Dahle G, Jelmert A, Bosgraaf S, Olsen EM, Deininger A, Haga A (2021) Krafttak for kysttorsken - Kunnskap for stedstilpasset gjenoppbygging av bestander, naturtyper og økosystem i Færder- og Ytre Hvaler nasjonalparker. Rapport fra havforskningen 2021–2: 56 s.
Muller EB, Lin S, Nisbet RM (2015) Quantitative adverse outcome pathway analysis of hatching in zebrafish with CuO nanoparticles. Environmental Science Technology 49: 11817–11824.
Nácher-Mestre J, Serrano R, Portoles T, Berntssen M, Perez-Sanchez J, Hernández F (2014) Screening of pesticides and polycyclic aromatic hydrocarbons in feeds and fish tissues by gas chromatography coupled to high-resolution mass spectrometry using atmospheric pressure chemical ionization. Journal of Agricultural and Food Chemistry 62: 2165–2174.
Neilson JD, Perry RI, Scott JS, Valerio P (1987) Interactions of caligid ectoparasites and juvenile gadids on Georges Bank. Marine Ecology Progress Series 39: 221–232.
Nickel AK, Campana SE, Ólafsdóttir GÁ (2024) Temperature and body size affect movement of juvenile Atlantic cod (Gadus morhua) and saithe (Pollachius virens) at nearshore nurseries. Journal of Fish Biology. 1–16.
Norberg B, Kleppe L, Andersson E, Thorsen A, Rosenlund G, Hamre K (2017) Effects of dietary arachidonic acid on the reproductive physiology of female Atlantic cod (Gadus morhua L.). General and Comp Endocrinology 250: 21–35.
Olsen EM, Karlsen Ø, Skjaeraasen JE (2023) Large females connect Atlantic cod spawning sites. Science 382: 1181–1184.
Olsvik PA, Samuelsen OB, Erdal A, Holmelid B, Lunestad BT (2013) Toxicological assessment of the anti-salmon lice drug diflubenzuron on Atlantic cod Gadus morhua. Diseases of Aquatic Organisms 105: 27–43.
Olsvik PA, Larsen AK, Berntssen MHG, Goksøyr A, Karlsen OA, Yadetie F, Sanden M, Kristensen T (2019) Effects of agricultural pesticides in aquafeeds on wild fish feeding on leftover pellets near fish farms. Frontiers in Genetics 10: 794.
Pedersen L (2013) Levels of persistent organic pollutants (POPs) and physiological and biochemical changes in farm associated wild fish caught in Masfjorden. Masteroppgave, Universitetet i Bergen, 65 s.
Pedersen MW, Berg CW (2017) A stochastic surplus production model in continuous time. Fish and Fisheries 18: 226–243.
Persson HL (2021) The sea louse Caligus elongatus (Caligidae). Genetic variation and host use by its two genotypes. Masteroppgave, Universitetet i Bergen, 71 s.
Pickova J, Dutta PC, Larsson P-O, Kiessling A (1997) Early embryonic cleavage pattern, hatching success, and egg-lipid fatty acid composition: comparison between two cod (Gadus morhua) stocks. Canadian Journal of Fisheries and Aquatic Sciences 54: 2410–2416.
Regjeringen (2023a) https://www.regjeringen.no/no/aktuelt/innforing-av-tiltak-for-vern-av-kysttorsk-og-havdeling/id2975703/
Regjeringen (2023b) https://www.regjeringen.no/no/aktuelt/ytterligere-tiltak-for-a-bygge-opp-kysttorsken-i-nord/id3016511/
Robichaud D, Rose GA (2004) Migratory behaviour and range in Atlantic cod: inference from a century of tagging. Fish and Fisheries 5: 185–214.
Røjbek MC, Støttrup JG, Jacobsen C, Tomkiewicz J, Nielsen A, Trippel EA (2014) Effects of dietary fatty acids on the production and quality of eggs and larvae of Atlantic cod (Gadus morhua L.). Aquaculture Nutrition 20: 654–666.
Roy W, Sutherland I, Rodger H, Varma K (2000) Tolerance of Atlantic salmon, Salmo salar L., and rainbow trout, Oncorhynchus mykiss Walbaum, to emamectin benzoate, a new orally administered treatment for sea lice. Aquaculture 184: 19–29.
Sæther BS, Bjørn PA, Dale T (2007) Behavioural responses in wild cod (Gadus morhua L.) exposed to fish holding water. Aquaculture 262: 260–267.
Salze G, Tocher DR, Roy WJ, Robertson DA (2005) Egg quality determinants in cod (Gadus morhua L.): egg performance and lipids in eggs from farmed and wild broodstock. Aquaculture Research 36: 1488–1499.
Samuelsen OB (2010) A single-dose pharmacokinetic study of emamectin benzoate in cod, Gadus morhua L., held in sea water at 9 °c. Journal of Fish Diseases 33: 137–142.
Samuelsen O, Hannisdal R, Parsons AE, Escobar R, Agnalt A-L, Sofie Grefsrud E (2024) Kunnskapsstauts - Legemindler i fiskeoppdrett. Rapport fra havforskningen 2024–25: 105 s.
Samuelsen OB, Lunestad BT, Hannisdal R, Bannister R, Olsen S, Tjensvoll T, Farestveit E, Ervik A (2015) Distribution and persistence of the anti sea-lice drug teflubenzuron in wild fauna and sediments around a salmon farm, following a standard treatment. Science of the Total Environment 508: 115–121.
Sanchez-Jerez P, Fernandez-Jover D, Uglem I, Arechavala-Lopez P, Dempster T, Bayle-Sempere J, Perez C, Izquierdo D, Bjørn P-A, Nilsen R (2011) Coastal fish farms as fish aggregation devices (FADs). I Artificial reefs in fisheries management, s. 187–208.
Sanchez-Jerez P, Atalah J, Sætra IM, Bøhn T, Saether B-S, Johansen T, Keeley N, van der Meeren T, Bjørn PA (2024) Comparative study of fatty acid composition of muscles of Atlantic cod (Gadus morhua Linnaeus, 1758) with natural diet and feeding near salmon farms. Aquaculture Journal 4: 246–254.
Sandlund N, Johansen R, Fiksdal IU, Einen ACB, Modahl I, Gjerset B, Bergh Ø (2021) Susceptibility and pathology in juvenile Atlantic cod Gadus morhua to a marine viral haemorrhagic septicaemia virus isolated from diseased rainbow trout Oncorhynchus mykiss. Animals 11: ani11123523.
Sele V, Silva M, Hamre K, Skjærven K, Espe M, Liland N, Lie K, Berntssen M, Lundebye A-K (2023) Program for overvåking av fiskefôr - Årsrapport for prøver innsamlet i 2022. Rapport fra havforskningen 2023–36: 38 s.
Skaar ICA (2021) Oppvekstområder for kysttorsk. Masteroppgave, Universitetet i Oslo. 77 s.
Skjæraasen JE, Nash RDM, Kennedy J, Thorsen A, Nilsen T, Kjesbu OS (2010) Liver energy, atresia and oocyte stage influence fecundity regulation in Northeast Arctic cod. Marine Ecology Progress Series 404: 173–183.
Skjæraasen JE, Meager JJ, Karlsen Ø, Hutchings JA, Fernö A (2011) Extreme spawning-site fidelity in Atlantic cod. ICES Journal of Marine Science 68: 1472–1477.
Skjæraasen JE, Karlsen Ø, Langangen Ø, van der Meeren T, Keeley NB, Myksvoll MS, Dahle G, Moland E, Nilsen R, Schrøder KME, Bannister RJ, Olsen EM (2021) Impact of salmon farming on Atlantic cod spatio-temporal reproductive dynamics. Aquaculture Environment Interactions 13: 399–412.
Skjæraasen JE, Karlsen, Langangen, Meier S, Dunlop KM, van der Meeren T, Keeley NB, Myksvoll MS, Dahle G, Moland E, Nilsen R, Schrøder KME, Bannister RJ, Olsen EM (2022) Attraction of cod Gadus morhua from coastal spawning grounds to salmon farms. Aquaculture Environment Interactions 14: 229–242.
Snow M, Cunningham CO, Bricknell IR (2000) Susceptibility of juvenile Atlantic cod Gadus morhua to viral haemorrhagic septicaemia virus isolated from wild-caught Atlantic cod. Diseases of Aquatic Organims 41: 225–229.
Snow M, King JA, Garden A, Raynard RS (2005) Experimental susceptibility of Atlantic cod, Gadus morhua (L.), and Atlantic halibut, Hippoglossus hippoglossus (L.), to different genotypes of viral haemorrhagic septicaemia virus. Journal of Fish Diseases 28: 737–742.
Sommerset I, Wiik-Nielsen J, Moldal T, Oliveira V, Svendsen J, Haukaas A, Brun E (2023) Fiskehelserapporten 2023. Veterinærinstituttets rapportserie nr. 8a/2024: 274 s.
Strøm JF, Bøhn T, Skjæraasen JE, Gjelland KØ, Karlsen Ø, Johansen T, Hanebrekke T, Bjørn PA, Olsen EM (2023) Movement diversity and partial sympatry of coastal and Northeast Arctic cod ecotypes at high latitudes. Journal of Animal Ecology 92: 1966–1978.
Uglem I, Karlsen Ø, Sanchez-Jerez P, Sæther BS (2014) Impacts of wild fishes attracted to open-cage salmonid farms in Norway. Aquaculture Environment Interactions 6: 91–103.
Urquhart K, Bowden TJm Buckett BE, Garcia J, Fryer RJ, Ellis AE (2009) Experimental study of the susceptibility of Atlatic cod, Gadus morhua (L.), to infection with an IPNV strain pathogenic for Atlatic salmon, Salmo salar L. Journal of Fish Diseases 32: 447–456.
van der Meeren T (2020) Eggundersøkelser i Repparfjorden og Revsbotn i april 2019. Rapport fra havforskningen 2020–14: 40 s.
Vollset K, NIlsen F, Ellingsen I, Karlsen Ø, Paterson RA, Qviller L, Skardhamar J, Stige L, Ugedal O, Lien V (2023) Produksjonsområdebasert vurdering av lakselusindusert villfiskdødelighet i 2023. Rapport fra ekspertgruppe for vurdering av lusepåvirkning: 181 s.
Wiik-Nielsen CR, Løvoll M, Sandlund N, Faller R, Wiik-Nielsen J, Bang Jensen B (2012) First detection of piscine reovirus (PRV) in marine fish species. Diseases of Aquatic Organisms 97: 255–258.
Wroblewski JS, Hiscock HW, Bradbury IR (1999) Fecundity of Atlantic cod (Gadus morhua) farmed for stock enhancement in Newfoundland bays. Aquaculture 171: 163–180.
Øines Ø, Hech PA (2007). Caligus elongatus Nordmann genotypes on wild and farmed fish. Journal of Fish Diseases 30: 81 - 91.
