The background for this report was that the government wanted to carry out a risk analysis for Norwegian sea areas of direct and indirect effects of climate change on marine ecosystems under different emission scenarios. The risk analysis was to be carried out as part of the management plan work for the three management plan areas: North Sea-Skagerrak, Norwegian Sea and Barents Sea-Lofoten. The assignment from the Norwegian Environment Agency to the Marine Research Institute consisted of one part for modeling and one part for risk analysis of selected key species within plankton, fish and shellfish. The modeling includes dynamic downscaling of three different emission scenarios from a global climate model, as well as ecosystem modeling for the same downscaled scenarios. The results from these model studies, together with expert assessments of how modeled changes in climate will affect various stocks in the North Sea, the Norwegian Sea and the Barents Sea, make up the risk analysis. Based on modeled changes in physical and biogeochemical variables as well as the knowledge of 13 different populations' habitats and response to climate variations, we have weighted the climate impacts and the directions these have in future climate scenarios. The results show that it is the current stocks of herring, cod and Calanus finmarchicus in the North Sea as well as polar cod in the Barents Sea that will be most negatively affected by climate change. Stocks that can migrate north into our oceans or stocks that are near the middle of the preferred temperature range such as Northeast Arctic mackerel, Norwegian spring-spawning herring, Northeast Arctic cod are the winners in a warmer climate in the future. The knowledge base for how much and how different species respond to external influences will change over time, and the analysis should therefore be repeated when new knowledge becomes available.
Risikoanalyse for de norske havområdene om direkte og indirekte virkninger av klimaendringer på marine økosystemer under ulike utslippsscenarier
— Risikorapport om hav og klima
Rapportserie:
Rapport fra havforskningen 2022-41
ISSN: 1893-4536
Kunnskapsstatus til risikorapport
Publisert: 30.11.2022
Oppdatert: 30.11.2025
Prosjektnr: 15765
Oppdragsgiver(e): Miljødirektoratet
Godkjent av:
Programleder(e):
Frode Vikebø
English summary
Sammendrag
Bakgrunn for denne rapporten var at regjeringen ønsket å gjennomføre en risikoanalyse for norske havområder av direkte og indirekte virkninger av klimaendringer på marine økosystemer under ulike utslippsscenarier. Risikoanalysen skulle gjennomføres som en del av forvaltningsplanarbeidet for de tre forvaltningsplanområdene: Nordsjøen-Skagerrak, Norskehavet og Barentshavet-Lofoten. Oppdraget fra Miljødirektoratet til Havforskningsinstituttet bestod i én del for modellering og én del for risikoanalyse av utvalgte nøkkelarter innen plankton, fisk og skalldyr. Modelleringen inkluderer dynamisk nedskalering av tre ulike utslippsscenarier fra en global klimamodell, samt økosystemmodellering for de samme nedskalerte scenariene. Resultatene fra disse modellstudiene sammen med ekspertvurderinger om hvordan modellerte endringer i klima vil påvirke ulike bestander i Nordsjøen, Norskehavet og Barentshavet utgjør risikoanalysen. Basert på modellerte endringer i fysiske og biogeokjemiske variabler samt kunnskapen om 13 forskjellige bestanders habitater og respons til klimavariasjoner, har vi vektet klimapåvirkningene og retningene disse har i fremtidige klimascenarier. Resultatene viser at det er dagens bestander av sild, torsk, og raudåte i Nordsjøen samt polartorsk i Barentshavet som vil bli mest negativt påvirket av klimaendringene. Bestander som kan migrere nordover og inn i våre havområder eller bestander som befinner seg nær midten av det foretrukne temperaturintervallet slik som nordøstatlantisk makrell, norsk vårgytende sild, nordøstarktisk torsk er de som er vinnerne i et fremtidig varmere klima. Kunnskapsgrunnlaget for hvor mye og hvordan ulike arter responderer på ytre påvirkninger vil endre seg med tiden, og analysen bør derfor gjentas når ny kunnskap blir tilgjengelig.
1 - Bakgrunn
Bakgrunn for denne rapporten var at regjeringen ønsket å gjennomføre en risikoanalyse for de norske havområdene av direkte og indirekte virkninger av klimaendringer på marine økosystemer under ulike utslippsscenarier (Meld. St. 20, 2019-20). Risikoanalysen skulle gjennomføres som en del av forvaltningsplanarbeidet, og dekke forvaltningsplanområdene Nordsjøen-Skagerrak, Norskehavet og Barentshavet-Lofoten. Oppdraget fra Miljødirektoratet til Havforskningsinstituttet bestod i én del for modellering og én del for risikoanalyse. Modelleringen inkluderer nedskalering av tre scenarier fra en global klimamodell til norske havområder, samt økosystemmodellering relatert til de samme scenariene og områdene. I analysen har vi brukt beregninger av retningseffekter som funksjon av klimaeksponeringer. Retningseffektene representerer rollen til klimapåvirkninger og sensitivitetsattributter som uttrykker livshistorie-basert tilpasningsevne. Metoden er på basert på tidligere studier av Hare et al. (2016) and Kjesbu et al. (2021). Resultatene fra disse modellene sammen med ekspertvurderinger om hvordan modellerte endringer i klima vil påvirke ulike bestander i Nordsjøen, Norskehavet og Barentshavet utgjør risikoanalysen. Utbredelseskart for nøkkelartene innen plankton, fisk og skalldyr vi har sett på i denne analysen er vist i Figur 1.
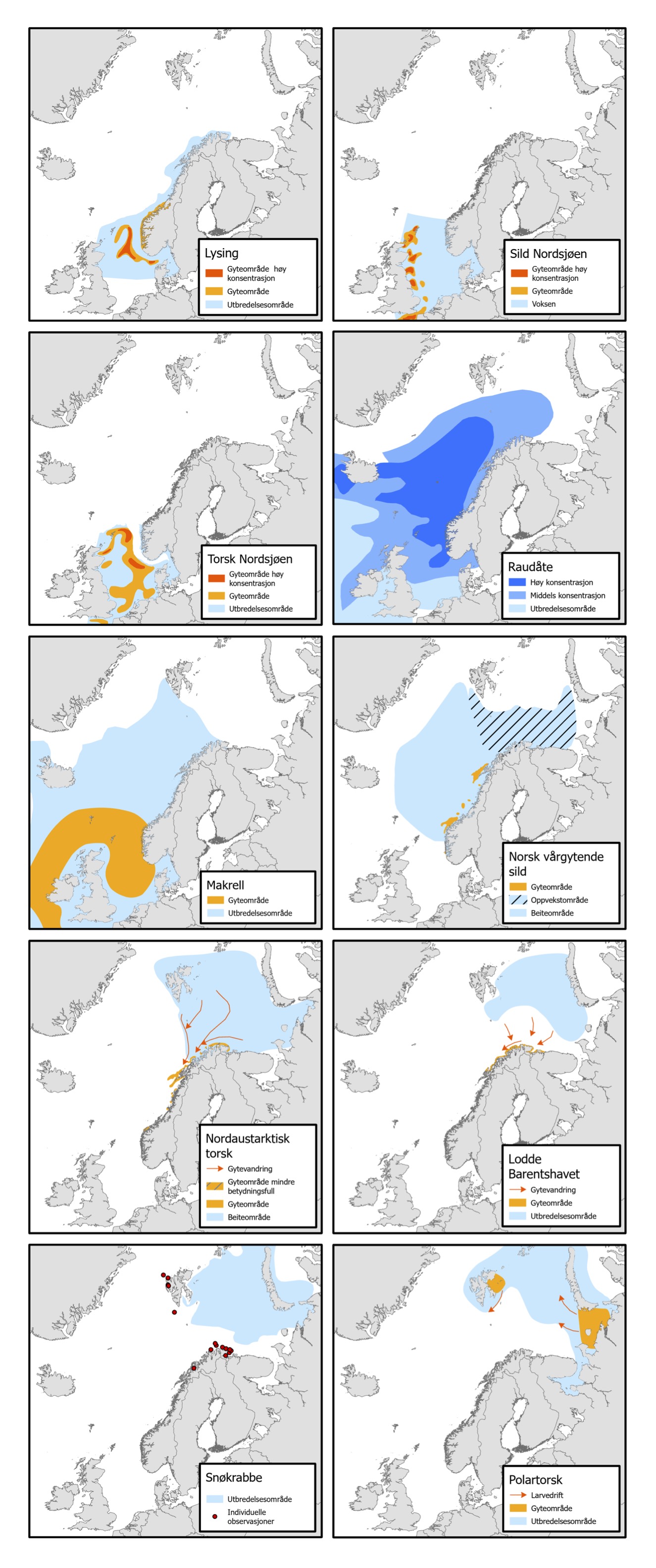
Kapittel 2 gir en introduksjon i sammenhengen mellom fysikk og biologi i det marine økosystem. Metode for analysen, inklusiv beskrivelse av sensitivitetsattributter for utvalgte bestander er gitt i kapittel 3. Resultatene er beskrevet i kapittel 4, før de diskuteres og konkluderes i kapittel 5 og 6.
2 - Introduksjon
Havklimaet i Norskehavet og Barentshavet er i stor grad bestemt av innstrømning av atlantisk vann (Østerhus et al., 2005; Skagseth et al., 2011). Både volumet og egenskapene til dette varme og salte vannet er viktig, og det eksisterer komplekse forhold mellom hav og atmosfære, både når det gjelder sirkulasjon og varmeutveksling. Ifølge Atlantisk Multidekadisk Oscillasjon (AMO)-indeksen (Sutton and Hodson, 2005) var vannet i Atlanterhavet relativt kaldt for rundt 100 år siden; relativt varmt i perioden 1930-1960 og kaldt i 1970-1980. Etter 1981 har det vært en oppvarming som nå ser ut til å ha kulminert. I tillegg til innstrømning av atlantisk vann er havklimaet langs norskekysten avhengig av regionale vindforhold og ferskvannsavrenning. Atlanterhavsvannet blir gradvis kjøligere og mindre salt på vei nordover på grunn av blanding med kyststrømmen og arktisk vann, samt nedbør og varmetap til atmosfæren. Varmetransporten langs norskekysten og den vertikale varmefluksen i Barentshavet er del av den såkalte Atlantic Meridional Overturning Circulation (AMOC), hvor varme og salte vannmasser transporteres nordover i nærheten av overflaten, blir avkjølt, for så å synke ned og bli transportert sørover i dypet. En økning i overflatetemperatur som følge av global oppvarming og en reduksjon i saltholdighet på grunn av smeltende is, kan føre til økt vertikal stabilitet, noe som vil påvirke mange økosystemprosesser (Lien and Ådlandsvik, 2014). Alternativt, hvis det økte ferskvannet fra smeltende is transporteres ut av det aktuelle området, kan den vertikale stabiliteten reduseres og påvirke økosystemprosessene på motsatt vis (Hordoir et al., 2022). Lenger nedstrøms i Nord-Atlanteren vil mer stabile vannmasser kunne gi en svakere AMOC i løpet av det 21. århundre (IPCC, 2013). Noen studier tyder på at AMOC allerede er redusert i Nord-Atlanteren, men så langt viser direkte observasjoner ingen tegn til reduksjon i grenen av Atlanterhavsstrømmen inn i De nordiske hav.
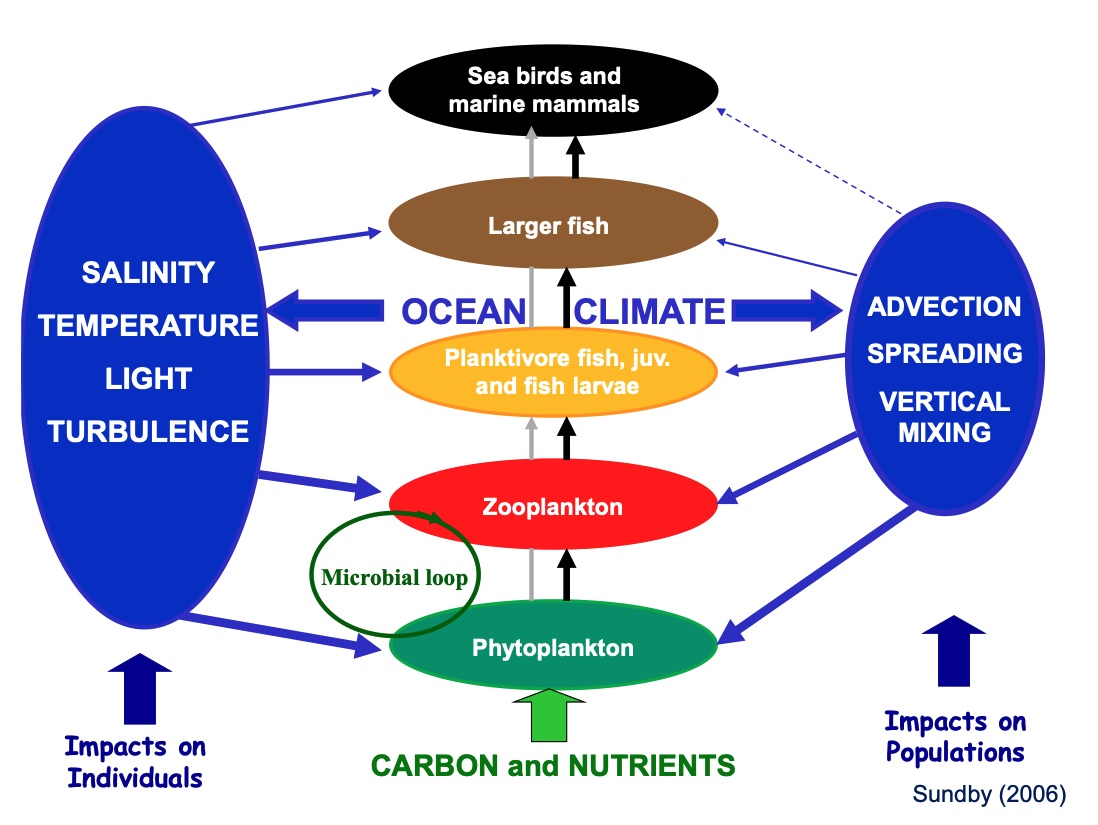
Klimaendringer påvirker marine fiskebestander både direkte gjennom endringene i havfysikken og indirekte gjennom havfysikkens påvirkning på produktiviteten på de ulike nivåene i næringsnettet (Sundby, 2000; Moloney et al., 2011). En illustrasjon av disse sammenhengene er vist i Figur 2. I denne analysen bruker vi en blanding av modellresultater (blå, grønne og røde felt i figuren) og ekspertvurderinger (brune felt) til å si noe om hvordan fremtidige klimaendringer vil kunne påvirke 13 ulike bestander i norske havområder. Endringer i modellerte klimapåvirkningvariabler som temperatur, isutbredelse, oksygeninnhold, pH, primær og -sekundærproduksjon, og kunnskap om hvor sensitive de ulike bestandene er til endringer i disse, utgjør grunnlaget for ekspertvurderingene av den samlede effekt på hver enkelt bestand (Kjesbu et al., 2021). Sensitiviteten til de ulike klimapåvirkningvariablene uttrykkes ved en vekting av betydningen disse variablene antas å ha på en skala fra 1 til 10, samt utviklingsretningen i tidsseriene. Disse verdiene og de tilhørende akkumulerte retningseffektene oppsummeres til slutt i tabeller for hver bestand.
2.1 - Temperatureffekter
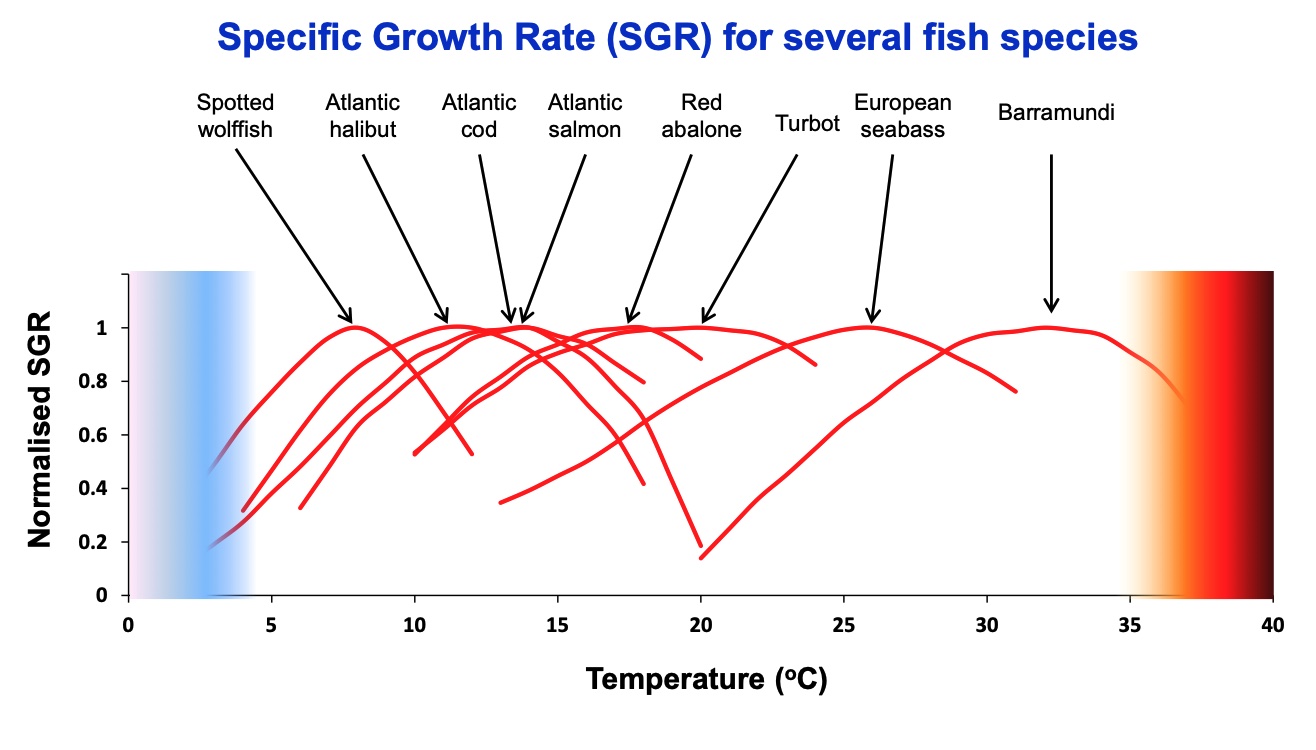
Marin fisk er ektoterme organismer, dvs. vekselvarme organismer som inntar tilnærmet samme temperatur som omgivelsene. Slike organismer er tilpasset et definert temperaturspenn hvor livsprosessene bryter sammen når omgivelsestemperaturen blir høyere eller lavere. Temperaturspennet for en gitt fiskeart rekker typisk over et temperaturintervall på mellom 7 og 15 oC med optimale forhold midt i temperaturspennet og med avtagende toleranse mot øvre og nedre skranke for overlevelse. På global skala varierer havtemperaturen i overflatelagene fra omtrent 30 oC ved ekvator til -2 oC i polare områder. På denne måten fordeler fiskeartene seg over de ulike termiske regimene i verdenshavene som i store trekk gir en sonal fordeling, fra tropiske arter som tolererer temperaturer fra omtrent 30 til 20 oC i ekvatoriale strøk til arktiske arter som er tilpasset temperaturer ned mot -2 oC. Mellom disse yttergrensene finner vi subtropiske arter, tempererte arter og boreale arter. Grensene mellom disse fem kategoriene er selvsagt omtrentlige; fiskeartene fordeler seg kontinuerlig over hele temperaturspekteret. Figur 3 viser et eksempel på laboratoriemålte temperaturavhengige veksthastigheter for noen fiskearter. Årsmiddeltemperaturen i fiskeriområdene fra den sørlige Nordsjøen (50o N) til den nordlige delen av Barentshavet (82o N) varierer fra omtrent 11 oC i sør til omtrent -1 oC i nord (Sundby, 2000). Dette betyr at norske fiskeriområder i det alt vesentlige er tilpasset boreale arter med innslag av tempererte arter i det aller sørligste interesseområdet og med arktiske arter i den nordlige delen av Barentshavet. De aller fleste kommersielt utnyttede fiskebestandene i våre farvann kan derfor betegnes som boreale og arktisk-boreale arter med innslag av tempererte arter i sør slik som lysing og med arktiske arter i nord slik som polartorsk. Som følge av menneskeskapte klimaendringer med temperaturøkning fra ekvator til polområdene kombinert med de klokkeformede temperaturtilpasningene for de marine fiskeartene (Figur 3) skaper dette en generell forskyvning av artene mot polområdene. Det har allerede skjedd under de relativt beskjedne temperaturendringene gjennom de siste 50 årene (Poloczanska et al., 2013). Generelt blir de mest utsatte artene de som finnes i de tropiske og polare områdene hvor ytterkantene av temperaturtilpasning for marine organismer finnes. Mellom disse områdene er det mulighet for meridional forskyvning av utbredelsesområdene etter hvert som temperaturen øker (Cheung et al., 2009, 2013). For hver enkelt art vil følsomheten for temperaturendring være avhengig av hvor i klokkefordelingen arten befinner seg. Med økende temperatur vil den negative virkningen av temperaturendring være størst langs det sørligste utbredelsesområdet hvor temperaturen blir for høy til å overleve, og utbredelsesområdet vil forskyves mot nord. Den mest positive virkningen av temperaturendring er langs det nordligste utbredelsesområdet hvor arten kan okkupere nye områder som tidligere var for kalde til å leve i. Minst følsomhet for temperaturendring finnes i det sentrale utbredelsesområdet hvor spesifikk veksthastighet har liten eller ingen endring med temperaturen.
Der er flere ulike tilnærmingsmetoder for å estimere hvordan en fiskebestand responderer i form av geografisk forflytning på den kombinerte virkningen av klimaendringer og den klokkeformede temperaturtilpasningen. Den enkleste metoden er beskrevet i Cheung et al. (2008) eksemplifisert med fordeling og utbredelse av fangster av Larimichthys polyactis (small yellow croaker) i forhold til temperaturfordelingen i Gulehavet og omkringliggende områder i det nordvestlige Stillehavet. Virkningen av endret klima blir så beregnet ved at fordelingen av fisken blir forflyttet i henhold til klimaendringene slik at omgivelsestemperaturen blir den samme som før klimaendringen. Svakheten i denne metoden ligger i at det også er andre variabler enn temperatur som fører til forflytning av fiskebestander, eksempelvis endringer i fordeling av sentrale byttedyr. I våre fiskeriområder er mengde og fordeling av raudåte en slik art, og Sundby (2000) foreslo at endringer i rekruttering til atlantiske fiskebestander var knyttet til endringer i regionale forekomster av raudåte. På denne måten ville det forventes at klimaendringene fører til bestandssvikt i torskebestanden i Nordsjøen på grunn av forflytning av raudåte mot nord, mens det kunne forventes bestandsøkning av Nordøstarktisk torsk i Barentshavet. Kjesbu et al. som undersøkte denne prosessen nærmere fant støtte for dette synet for nedgangen i, og endret fordeling av, torskebestanden i Nordsjøen. Samtidig viste også Kjesbu et al. at nedgangen i, og kollapsen av, torskebestandene i den sørligste delen av Irskesjøen og Den engelske kanal var bestemt av en annen prosess, nemlig kritisk høye temperaturer for gonademodningen. Laboratorieeksperimenter viste at gonademodning og gyting for torsk stoppet opp når temperaturen oversteg 9,6 oC, og denne kritiske temperaturen stemmer overens med forflytningen av 9.6o isotermen mot nord i dette sørligste utbredelsesområdet for Atlantisk torsk. Dette resultatet viser hvor viktig det er å ha kunnskap om hvordan fisken responderer på temperaturendringer under kontrollerte laboratorieforhold. Otterlei et al. (1999) gjennomførte vekstforsøk på larver og pelagisk yngel av torsk og fant optimal veksthastighet ved omtrent 14 oC. Andre vekstforsøk i laboratorium viser at torsken først kollapser ved 16-17 oC, altså ved betydelig høyere temperatur enn kritisk gytetemperatur (Kjesbu et al.). Det må her påpekes at det ikke nødvendigvis er noen motsetning mellom så ulike temperaturgrenser for moden fisk og yngel, siden modningen for gytefisken skjer gjennom vinteren i dypet under mye lavere temperaturer, mens yngelen vokser gjennom sommeren i overflatelagene med betydelig høyere omgivelsestemperatur. Det er rimelig å anta at fisken for de ulike livsfasene gjennom evolusjon er tilpasset de naturlige sesongmessige temperatursvingningene. Det viser hvor viktig det er å ha kontroll med både sommer- og vintertemperaturer når man skal vurdere virkningene av klimaendringer på fiskebestandene.
Det er svært få fiskearter hvor det finnes så mye grunnleggende kunnskap som for Atlantisk torsk, og laboratorieeksperimenter som beskrevet over hører med til sjeldenhetene. Man må imidlertid tolke laboratorieresultatene med varsomhet når man skal overføre slik kunnskap til naturen. Derfor er metoden som beskrevet av (Cheung et al., 2008) med å se på fordelingen av en fiskebestand i forhold til temperaturfeltet i de naturlige omgivelsene et godt supplement, og for de fleste fiskebestander er denne metoden det eneste kunnskapsgrunnlaget. Men som nevnt må en da også ha i tankene at forskyvning av en fiskebestand også kan være forårsaket av andre klimadrivere, både fysiske og biotiske faktorer. Alle metoder for temperturrespons tar imidlertid utgangspunkt i det grunnleggende når det gjelder temperaturendringer for ektoterme bestander, at alle bestander har sin klokkeformede temperaturtilpasning. Dette skiller temperaturresponsen fra de øvrige klimadriverne hvor responsene i ulik grad er proporsjonale med endringene i klimadriveren.
2.2 - Oksygeneffekter
I motsetning til i atmosfæren hvor 21 % av gassene er oksygen uansett hvor vi befinner oss på jordkloden, varierer oksygenkonsentrasjonen i betydelig grad i havet, fra en metningsprosent på over 110 % i enkelte overflateområder til ned mot null og helt anoksiske forhold i dypet i de store østlige oppstrømningsområdene, i dypet av terskelhav som Østersjøen og Svartehavet, samt i dypet av norske terskelfjorder. Som en følge av slike store oksygenvariasjoner er organismene i havet tilpasset svært ulike nivåer av metningskonsentrasjoner av oksygen. Men til liks med i atmosfæren spiller også partialtrykket en viktig rolle for tilførselen av oksygen til organismene. Det betyr at i store havdyp klarer organismene lavere konsentrasjoner av oksygen, fordi partialtrykket er mye større enn ved havoverflaten (Hofmann et al., 2011), ikke ulikt at også partialtrykket i atmosfæren også påvirker oksygenopptaket til landjordens organismer. Mens de fleste organismene i havet har en klokkeformet temperaturrespons når det gjelder vekst og trivsel, er responsen til endringer i oksygen jevnt avtakende fra 100 % metningskonsentrasjon ned mot tålegrensen hvor dødeligheten i populasjonen blir total. På grunn av de ulike tilpasningene for organismer i ulike økosystemer er tålegrensen ganske variabel for ulike arter. En av de aller mest ekstreme fiskeartene er gobiden Sufflogobius bibarbatus i Benguelastrømmen. Den er fullt reaktiv i oksygenkonsentrasjoner på mindre enn 0,007 ml l-1 selv etter 7-9 timer (Salvanes et al., 2011). Også hestemakrell (Trachurus trachurus capensis) og Kapp-lysingen (Merluccius capensis) kan i disse farvannene tåle svært lave oksygenkonsentrasjoner (ned mot 0,5 ml l-1) (Salvanes et al., 2015), men altså ikke så ekstremt lave konsentrasjoner som gobidene. Til sammenligning vil Atlantisk torsk (Gadus morhua L.) ikke tåle oksygenkonsentrasjoner under omtrent 30 % oksygenmetning (Plante et al., 1998) som tilsvarer i overkant av 2 ml l-1 i våre farvann, mens svømmeaktiviteten for torsk faller drastisk under 60 % oksygenmetning (Schlesinger and Ramankutty, 1994) som tilsvarer omtrent 4,4 ml l-1 i våre farvann.
2.3 - Forsuringseffekter
Vitenskapen om virkningene av havforsuring på organismene i havet er svært ung. De første vitenskapelige artiklene kom så seint som i 2005, men allerede i 2013 var antallet publiserte arbeider per år om emnet passert 600 (Browman, 2016). Mens de aller første arbeidene viste svært bekymringsfulle effekter av havforsuring, viser vitenskapen i dag betydelig mer sammensatte resultater, både negative, nøytrale og positive virkninger av havforsuring. Det er primært organismer som danner kalkskall som klart vil bli negativt påvirket av havforsuring, altså bunndyr som skjell og koraller, samt kalkdannende planktonarter slik som vingesnegl (dyreplankton) og kalkalgen Emiliana huxleii (planteplankton). Av artene som er omfattet av denne analysen er det imidlertid ingen kalkdannende arter. Skallet i de to artene raudåte og snøkrabbe, består ikke av kalsiumkarbonat, men av kitin, et celluloselignende stoff. Riktignok er det vist at kraftig grad av forsuring har en betydning under skallskifte for store krepsdyr som hummer (Agnalt et al., 2013), men det er ikke påvist effekter av sterke forsuringsscenarier hverken på raudåte (Runge et al., 2016) eller på Calanus glacialis (Bailey et al., 2016). For fiskearter som de øvrige artene omfattet av denne analysen er forskningen på virkningene av forsuring divergerende. Vi må derfor konkludere med at det ennå er for tidlig å kunne konkludere entydig når det gjelder virkninger av forsuring på organismene i havet som ikke er kalkdannende, men forskningen fram til nå gir ikke klare holdepunkter for sterke effekter av havforsuring.
2.4 - Vindeffekter
Effekter på marine organismer og økosystemer som følge av vindendringer under globale klimaendringer har hatt overraskende liten oppmerksomhet i det internasjonale forskningsmiljøet. Vindindusert turbulens i blandingslaget har imidlertid betydelige effekter på alle planktonorganismer fra planteplankton, til dyreplankton og fiskeplankton. Nå er riktignok vind og vindindusert turbulens i blandingslaget integrert i planktonmodellering på alle nivåer, og de mekanistiske sammenhengene med vind ligger derfor i større eller mindre grad skjult og blir sjelden analysert separat. I tillegg er globale klimamodeller fremdeles beheftet med større usikkerhet på framtidige prognoser for hvordan vinden vil utvikle seg på regional skala. Det er allikevel viktig å gå gjennom resonnementene for hvordan endringer i vind påvirker marine planktonsystemer. For planteplanktonproduksjonen er næringssalttilførselen fra dypet styrt av vindindusert vertikalblanding, mens stabiliseringen av blandingslaget som forårsaker oppstarten på våroppblomstringen på våre breddegrader forutsetter liten vindblanding (Sverdrup, 1953). På denne måten har vindblandingen motsatte virkninger for en optimal primærproduksjon. Dette reflekteres i en global studie for hvordan vindendringer påvirker primærproduksjonen: Kahru et al. (2010) viste at på lave breddegrader, dvs. i de subtropiske økosystemene, hvor vinden er svak og den vertikale lagdelingen er høy, så vil vindstyrke høyere enn gjennomsnittet medvirke til høyere primærproduksjon, mens på høye breddegrader med stor vindaktivitet og god gjennomblanding, slik som i våre farvann, er det vindstyrker lavere enn gjennomsnittet som medvirker til høyere primærproduksjon. Vertikalfordelingen av dyreplankton viser svingninger på døgnbasis som er responser på døgnets lyssyklus ved at dyreplanktonet er nærmest overflatelagene i den mørke tiden av døgnet og dypere nede når det er dagslys. Men det er vist at mesozooplankton responderer med å falle ut at overflatelagene når vinden blir for sterk (f.eks. Ellertsen et al. (1984) og under slike forhold forsvinner mønsteret med døgnvandring.
Det finnes imidlertid fremdeles begrenset med forskning på om slike prosesser har noen virkning på populasjonsnivå og på produktiviteten, og derfor er det heller ikke mulig å fastslå om dette kan ha betydning for utviklingen av dyreplanktonbestander under framtidige klimaendringer. Vindens virkning på fiskeplankton er derimot i stor grad undersøkt både på egg og larver. Vertikalfordelingen av fiskeegg er styrt av balansen mellom oppdriftskreftene og vertikal turbulens (Sundby, 1983), og mens vertikalfordelingen av pelagiske fiskeegg blir primært styrt av vindvariasjonene blir vertikalfordelingen av epipelagiske fiskeegg styrt av de interne oppdriftskreftene i fiskeegget (Sundby, 1991). På global skala finnes det et utall av lokale og regionale tilpasninger til økosystemene når det gjelder gyteadferd og vertikalfordeling (Sundby and Kristiansen, 2015). Ett annet aspekt av vindvirkning på fiskeplankton er at den vindinduserte småskalaturbulensen påvirker kontaktraten mellom planktonorganismer generelt (Rothschild and Osborn, 1988) og i særdeleshet på næringsopptaket for fiskelarver (Sundby and Fossum, 1990) og pelagisk fiskeyngel (Sundby, 1995). Responsen i form av næringsopptak på turbulensen får imidlertid negative effekter når den overstiger et optimalt nivå (MacKenzie et al., 1994). Virkningen av turbulens på næringsopptaket er i dag standard inkludert i individbaserte modeller (Fiksen et al., 1998), og er således også en del av økosystemmodeller for transport, spredning, vekst og overlevelse av fiskeegg, fiskelarver og pelagisk yngel (Kristiansen et al., 2011).
2.5 - Effekter av primærproduksjon og sekundærproduksjon på fisk
På global skala er det vist at det er sammenheng mellom høy primærproduksjon, høy sekundærproduksjon og høy produksjon av fisk. Eksempelvis leverer de tre store høyproduktive økosystem-biomene bestående av de fire store østlige oppstrømnings-systemene, de nordlige våroppblomstringssystemene og verdens kystøkosystemer 80 % av verdens fiskefangster, men de utgjør kun 20 % av klodens havareal (Hoegh-Guldberg et al., 2014). De store subtropiske gyrene i de tre verdenshavene som utgjør 40 % av klodens havområder, og er å regne som havets ørkener når det gjelder primærproduksjon, leverer kun 8 % av verdens fiskefangster. På regionalt og lokalt økosystemnivå er derimot sammenhengene mellom primærproduksjon og fiskeproduksjon mer uklar. Friedland et al. (2012) som undersøkte 52 regionale økosystemer (large marine ecosystems) fant lav korrelasjon mellom primærproduksjon og utkommet i form av fiskeri. Derimot ble det funnet høyere korrelasjon med utkommet av fiskeri når forholdet mellom primær- og sekundærproduksjonen ble inkludert. Det kan være mange faktorer som bidrar til variasjoner i forholdet mellom planktonproduksjonen og produksjonen av fisk på ulike høyere trofiske nivåer. For det første er ulike marine økosystemer ulikt sammensatt over trofiske nivåer. I enkelte økosystemer, slik som i de store østlige oppstrømningssystemene dominerer pelagiske bestander på nivå 3 i fiskeproduksjonen (f.eks. sardin, ansjos, makrell og sild). Dette vil gi mye høyere avkastning i form av fiskeri enn i områder hvor fiskebestander på nivå 4 utgjør en større andel av fiskeri (f.eks. lysing og annen bunnfisk). For det andre vil også strukturen i dyreplanktonsamfunnet påvirke næringsforholdene for fisk. I våre egne farvann har raudåte en sentral funksjon i å overføre energi fra planteplankton til fisk. I tillegg til å være viktigste næring for voksen pelagisk fisk (sild, makrell og kolmule), har den nøkkelrollen som næring for de fleste fiskearter i larve- og yngelstadiet (Sundby, 2000). Med sin særegne tilpasning til våroppblomstringssystemet med overvintring i dypet i den mørke årstiden og med oppvandring til planteproduksjonslaget vår og sommer er den en svært effektiv beiter på planteplanktonet. Overvintringsdynamikken med deponering av store fettreserver gjør raudåte til en meget kaloririk næringskilde for organismene høyere opp i næringsnettet. Dette bidrar til å opprettholde store bestander av fisk selv om primærproduksjonen i disse områdene er mye lavere enn i de store østlige oppstrømningssystemene. Det er altså store variasjoner i de trofiske overføringskoeffisientene mellom ulike marine økosystemer. Det må imidlertid antas at variasjoner i planktonproduksjonen i ett og samme økosystem bidrar til tilsvarende variasjoner i produksjonen av fisk på høyere trofiske nivåer forutsatt at strukturen i økosystemet opprettholdes, altså at det ikke skjer større endringer i artssammensetning. I så fall vil vi kunne anta en sterkere grad av proporsjonalitet i tid mellom sekundærproduksjon og fiskeproduksjon i ett og samme økosystem, i hvert fall når det gjelder den langsiktige trenden (Stock et al., 2017). Vi vil derfor i de følgende klimascenariene forutsette at de langsiktige endringene i sekundærproduksjonen i de enkelte økosystemene vil forplante seg til høyere trofiske nivåer og gi tilsvarende endringer i totalproduksjonen av fisk.
3 - Metode
Innstrømning av atlantisk vann til Nordsjøen og Barentshavet er ikke spesielt godt simulert i globale klimamodeller (Langehaug et al., 2013, 2019; Madonna and Sandø, 2022). Spørsmålet om, eller i hvilken grad, dette kan «repareres» ved hjelp av regional klimamodellering er ikke entydig, men noen modellresultater indikerer en betydelig forbedring av hydrografi og havisutbredelse i Barentshavet (Sandø et al., 2014; Hordoir et al., 2022). For fremtidens klima viser sammenligning av nedskaleringer fra to forskjellige globale modeller konsistente resultater for temperatur, mens resultatene for saltholdighet avviker mye (Sandø et al., 2014). Dette indikerer at urealistiske trekk fra de globale modellene kan overføres til de regionale modellresultatene, og dermed øke usikkerheten. Å kjøre regionale modeller med randbetingelser basert på en kombinasjon av klimatologi fra observasjoner og trender fra de globale modellene vil redusere problemer med modellskjevheter (biaser). I denne analysen har vi nedskalert scenarier fra den norske jordsystemmodellen Norwegian Earth System Model (NorESM2-MM, Bentsen et al., 2013; Seland et al., 2020) med den regionale havmodellen NEMO-NAA10km (Hordoir et al., 2022). For å undersøke hvordan klimaendringer påvirker de lavere trofiske nivåene i de norske havområdene, ble fysikken fra NEMO-NAA10km brukt som drivkrefter inn i NORWEGIAN ECOlogical Model-systemet End-To-End (NORWECOM.E2E) (Aksnes et al., 1995; Skogen et al., 1995; Skogen and Søiland, 1998).
3.1 - Beskrivelse av regional havmodell
NEMO-NAA10km er en ny regional havmodelleringskonfigurasjon for Nord-Atlanteren og Polhavet basert på NEMO, versjon 3.6 (Madec and the NEMO system team., 2015), og videreutviklet ved Havforskningsinstituttet (Hordoir et al., 2022). Modellen har en horisontal oppløsning på omtrent 10 km og inkluderer Nord-Atlanteren fra 39o N, hele Polhavet og videre et stykke inn i Stillehavet for å sikre en riktig representasjon av strømmen gjennom Beringstredet. Polhavet er svært lagdelt, og det meste av lagdelingen er halin (dominert av saltforskjeller). Videre er regionen i økende grad påvirket av ferskvannstilførsel og store klimaendringer. De siste tiårene har den nordlige delen av Barentshavet blitt atlantifisert, noe som betyr at den sesongmessige lagdelingen i økende grad drives av termiske effekter, mens saltvannseffekter blir mindre viktige (Lind et al., 2018). NEMO-NAA10km er satt opp med spesielt fokus på å reprodusere og analysere disse effektene, og det legges spesiell vekt på en god representasjon av den rom-tidsmessige utviklingen av temperatur og saltholdighet (Hordoir et al., 2022). Målet med denne konfigurasjonen er å ha et verktøy for å studere utviklingen av havet i et klima i endring med fokus på termohaline prosesser. Modellen kjøres derfor uten noen form for relaksering av saltholdighet. For modellering av sjøis er NEMO koblet til sjøis-modellen LIM3 (Vancoppenolle et al., 2009).
3.2 - Beskrivelse av økosystemmodell
NORWECOM.E2E (Aksnes et al., 1995; Skogen et al., 1995; Skogen and Søiland, 1998) er et koblet fysisk-biogeokjemisk modellsystem som brukes til å studere primærproduksjon, sekundærproduksjon, næringsbudsjetter og spredning av partikler som fiskelarver og forurensning. Primærproduksjonen i denne analysen utgjør summen av flagellater og diatomeer som begge er vertikalintegrert i vannkolonnen. Tilsvarende er sekundærproduksjonen den vertikalintegrerte summen av mikro- og mesozooplankton. Modellen er tidligere validert ved sammenligning med feltdata i De nordiske hav og Barentshavet (Skogen et al., 2007; Hjøllo et al., 2012; Skaret et al., 2014). I denne analysen ble modellen kjørt i frakoblet modus ved å bruke 5-dagers middelverdier for de fysiske havfeltene (hastigheter, saltholdighet, temperatur, havoverflatehøyde og sjøis) fra NEMO-NAA10km nedskaleringene sammen med atmosfæriske felt fra NorESM2-MM. Det horisontale gridet som ble brukt i denne modellen er identisk med et underdomene til det originale NEMO-NAA10km-gridet. Mer detaljer om klimarelaterte endringer på planktonproduksjonen i Barentshavet basert på denne økosystemmodellen finnes i Sandø et al. (2021).
NoBa Atlantis er en ‘hele verden’ modell, som inneholder 53 arter og dekker De nordiske hav og Barentshavet med 60 polygoner med opp til 7 dybdelag (Hansen et al., 2019a). ‘hele verden’-modeller inneholder ‘alt’ fra fysikk til menneskelig påvirkning, som f.eks. gjennom fiskerier, forurensning eller støy. NoBa inkluderer aldersoppløste komponenter for nøkkelarter i disse områdene, og hver av artene flytter seg rundt i området avhengig av gytemigrasjon og tilgang på mat. Vi har kjørt NoBa Atlantis ved å bruke tre forskjellige klimascenarier (gjennom temperatur, salt, is og sirkulasjon). For hvert av disse har vi valgt to forskjellige høstningscenarier, ett hvor de fiskes tilsvarende maksimalt bærekraftig nivå (Fmsy) og ett hvor vi har inkludert høstningsregler for de tre viktigste pelagiske bestandene (sild, makrell, kolmule). Maksimalt bærekraftig nivå er regnet ut i modellsystemet, men ligger nært nivåene som ICES-arbeidsgruppene gir (Hansen et al., 2019b). Grunnet måten høstningsreglene er satt opp i NoBa Atlantis, har de pelagiske bestandene de samme referansepunktene, og høstes dermed etter en vanlig hockeykølleregel (ICES, 2021). Hver av artene har en temperatursensitivitet som påvirker gyting, hvilke polygoner de kan oppholde seg i, vekst og konsumpsjon.
3.3 - Fremskrivninger
For å kunne si noe om mulige fremtidige klimaendringer har vi valgt å se på ulike scenarietyper, eller såkalte Shared Socioeconomic Pathways (SSP). Disse scenariene brukes av beslutningstakere og planleggere for å analysere fremtidige situasjoner der utfallene er usikre. De er laget for å undersøke hvordan det globale samfunnet, befolkningsvekst, utviklingsteknologier og økonomi kan endre seg i løpet av det neste århundret, og dermed også klimagassutslippene. SSP1-narrativet beskriver en verden av bærekraftsfokusert vekst og likhet, som tar den grønne veien. SSP2 er midt-på-veien-scenariet der trender stort sett følger deres historiske mønstre, mens SSP5 beskriver en verden med rask og ubegrenset vekst i økonomisk produksjon og energibruk. Meinshausen et al. (2020) beskriver i detalj disse SSP-enes klimagasskonsentrasjoner og deres utvidelser til 2500, med forskjellige kilder til menneskeskapte utslippsscenarier, og deres relative betydning når det gjelder strålingspådriv. SSP1-2.6, SSP2-4.5 og SSP5-8.5 følger ganske divergerende kurver med hensyn til utslipp og strålingspådriv, med tilsvarende topper på svært forskjellige tidspunkt, og det er disse scenariene vi har valgt å studere i denne analysen. Desimaltallene i scenarietypene beskriver det ekstra strålingspådrivet i 2100 sammenlignet med den førindustrielle grunnlinjen, nemlig 2,6, 4,5 og 8,5 Wm−2.
3.4 - Korttids variabilitet og langtidsendringer
Projiserte endringer i tabeller og figurer i Kapittel 4 er basert på en funksjon som finner koeffisientene til et polynom som passer best til dataene i tidsserien ved minste kvadraters metode. Standardavvikene (SD) er lagt til for å illustrere variasjonen til de årlige tidsseriene som varierer betydelig fra region til region. På denne måten kan den relative betydningen av den naturlige variabiliteten skilles fra endringen som skyldes det menneskeskapte signalet.
3.5 - Sensitivitetsattributter, klimaeksponeringer og retningseffekter
Beskrivelsen av sensitivitetsattributtene bygger på Hare et al. (2016) og Kjesbu et al. (2021). Generelt inkluderer sensitivitetsattributter faktorer som habitatspesifisitet, byttedyrspesifisitet, artsinteraksjon, voksenmobilitet, spredning av tidlige livsstadier, overlevelse ved tidlige livsstadier, kompleksitet i reproduksjonsstrategi, gytesyklus, følsomhet for temperatur, følsomhet for havforsuring, populasjonssvekst, bestandsstørrelse og status, og andre stressfaktorer. De mest relevante av disse sensitivitetsattributtene med hensyn på modellanalyse er byttedyrspesifisitet og følsomhet for temperatur, oksygeninnhold og havforsuring. Disse er derfor beskrevet for bestandene vi studerer her, mens resten er beskrevet i detalj for totalt 39 fiskeriressurser i Kjesbu et al. (2021). Klimaeksponeringene består av temperatur ved overflaten, 100 m og bunn, haviskonsentrasjon (-), oksygen (ml l−1), pH (-), årlig netto primærproduksjon ( NPP; gCm−2) og årlig gross sekundærproduksjon (GSP; gCm−2), og deres endringer og standardavvik (SD) er oppført i Tabell 2-12. Sensitivitetsattributtene blir så brukt ved vekting av klimaeksponeringene i Tabell 13-25. Retningseffektene angir i hvilken retning bestandene blir påvirket av klimaendringene, og de akkumulerte retningseffektene for hver enkelt bestand er summen av alle vektede klimaeksponeringer multiplisert med tilhørende retningseffekt (Tabell 13-25). I ekspertvurderingene for de ulike bestandene har vi betraktet de ulike sensivitetsattributtene i forhold til bestandenes grad av følsomhet (Kjesbu et al., 2021).
3.5.1 - Habitatsspesifisitet
Beskriver, på en relativ skala, om bestanden er en habitatgeneralist eller en habitatspesialist, og gir informasjon om typen og overfloden av nøkkelhabitater.
• Lav: Bestanden er en habitatgeneralist og/eller utnytter svært vanlige abiotiske habitater. Forekomster av bestanden er dokumentert i ulike habitater. Også inkludert i denne kategorien er bestander som er begrenset til ett abiotisk habitat som er utbredt og vanlig (f.eks. store strekninger med sandbunn eller pelagiske farvann over et stort område).
• Høy: Bestanden er en spesialist som er begrenset til et spesifikt og uvanlig biologisk habitat.
3.5.2 - Byttedyrspesifisitet
Beskriver, på en relativ skala, om bestanden er en byttedyrgeneralist eller en byttedyrspesialist.
• Lav: Bestanden kan spise en rekke byttedyrtyper avhengig av hva som er tilgjengelig.
• Høy: Bestanden er en spesialist. Bestanden er avhengig av én byttedyrtype og kan ikke bytte til alternativer dersom det foretrukne byttet ikke er tilgjengelig.
3.5.3 - Artsinteraksjon
Beskriver, på en relativ skala, i hvilken grad bestanden påvirkes av interspesifikk interaksjon.
• Lav: Bestanden er lite påvirket av konkurranse om samme byttedyr og predasjon fra andre fiskebestander som befinner seg i hovedbeiteområdet.
• Høy: Bestanden er svært sterkt påvirket av beiteaktiviteten til konkurrerende bestander og predatorer i samme område. I tilfeller med høy forekomst av andre konkurrenter eller predatorer, kan bestanden bli betydelig redusert i både antall og den enkelte fisk kan lide på grunn av mangel på energireserver.
3.5.4 - Voksenmobilitet
Beskriver bestandens evne til å flytte til et nytt sted hvis deres nåværende plassering endres og ikke lenger er gunstig for vekst og/eller overlevelse.
• Lav: Ikke stedsavhengig. Bestanden er svært mobil og ikke-stedsavhengig.
• Høy: Ikke-mobil. Bestanden har fastsittende voksne.
3.5.5 - Spredning av tidlige livsstadier
Beskriver bestandens evne til å etablere nye habitater når/hvis deres nåværende habitat blir mindre egnet.
• Lav: Svært spredte egg og larver. Varighet av planktonegg og larver er større enn 8 uker og/eller larver er spredt >100 km fra gyteplasser.
• Høy: Minimal larvespredning. Bentiske egg og larver eller få eller ingen planktoniske tidlige livsstadier.
3.5.6 - Tidlig livshistorie og overlevelse
Beskriver den relative betydningen av krav til tidlig livshistorie for en bestand.
• Lavt: Kravene til larver er minimale. Bestanden har generelle krav til larvestadiet som er relativt motstandsdyktige mot miljøendringer.
• Høy: Larver har flere spesifikke krav. Bestanden har spesifikke kjente biologiske og fysiske krav for larveoverlevelse.
3.5.7 - Kompleksitet i reproduksjonsstrategi
Beskriver hvor kompleks bestandens reproduksjonsstrategi er og hvor avhengig reproduktiv suksess er av spesifikke miljøforhold.
• Lav: Enkel reproduktiv strategi. Bestanden inneholder ikke mer enn én egenskap som antyder kompleksitet i reproduktiv strategi.
• Høy: Veldig kompleks reproduktiv strategi. Bestanden har fire eller flere egenskaper som tyder på kompleksitet i reproduktiv strategi.
3.5.8 - Gytesyklus
Sier noe om varigheten av gytesyklusen for bestanden kan begrense bestandens evne til å reprodusere seg hvis forholdene forstyrres av klimaendringer.
• Lav: Bestander som gyter kontinuerlig gjennom året uten en definert gytesesong vil lite sannsynlig lide av gytesvikt. Eksempel: en bestand som gyter daglig eller månedlig.
• Høy: Én gytebegivenhet per år. Bestander som krever svært spesifikke miljømessige/sosiale signaler for å sette i gang gyting og som bare gyter én gang per år har størst sannsynlighet for å bli påvirket av klimaendringer. Eksempel: gytesesongen inntreffer en gang per år over en kort tidsperiode.
3.5.9 - Temperatursensitivitet
Beskriver informasjon om aktuell omgivelsestemperatur eller distribusjon av arten som en proxy for dens følsomhet for temperatur.
• Lav: Stort temperaturområde. Bestander forekommer i et bredt temperaturområde (>15 oC), eller finnes i 3 eller flere temperatursoner (Spalding et al., 2007).
• Høy: Svært begrenset temperaturområde. Arter forekommer i et smalt temperaturområde (<5 oC), eller finnes innenfor en temperatursone og har en begrenset dybdefordeling (dvs. dybdeområdet er <100 m).
3.5.10 - Sensitivitet til havforsuring
Beskriver informasjon om havforsuringsnivåer som for tiden oppleves av bestanden (med spesielt fokus på egg og larver – tidlige livsstadier – som det mest sårbare livsstadiet) og den relative alvorlighetsgraden av forsuring, predikert som en proxy for dens følsomhet.
• Lav: Bestanden og dens tidlige livsstadier opplever allerede høye nivåer av forsuring og habitatet er spådd å oppleve lignende nivåer av forsuring i fremtiden, eller forskning har vist at arten er robust.
• Høy: Bestanden, spesielt dens tidlige livsstadier, har opplevd lave nivåer av forsuring tidligere, men finnes i områder som vil få høye nivåer i fremtiden (over globalt gjennomsnitt) eller forskning har vist at arten er spesielt sårbar.
3.5.11 - Sensitivitet til reduksjon i oksygeninnhold
Beskriver informasjon om oksygeninnhold som for tiden oppleves av bestanden og den relative alvorlighetsgraden av reduksjon i oksygeninnhold, predikert som en proxy for dens følsomhet.
• Lav: Bestanden og dens tidlige livsstadier opplever allerede lave nivåer av oksygen og habitatet er spådd å oppleve lignende nivåer av oksygen i fremtiden, eller forskning har vist at arten er robust.
• Høy: Bestanden har opplevd lave nivåer av oksygen tidligere, men finnes i områder som vil få enda lavere nivåer i fremtiden, eller forskning har vist at arten er spesielt sårbar.
3.6 - Utvalgte sensitivitetsattributter for ulike bestander
Selv om de fleste sensitivitetsattributtene er tatt hensyn til i den totale vurderingen der man vekter de ulike klimaeksponeringene, er det kun de attributtene som er spesielt relevant for de modellerte klimaeksponeringene som er beskrevet for artene her. Mer utfyllende beskrivelser for de andre attributtene er beskrevet i Kjesbu et al. (2021). Denne analysen er basert på modellerte variabler som temperatur, sjøisdekke, oksygen, pH, primær- og sekundærproduksjon. De fire førstnevnte er variabler som relativt spesifikt gir grunnlag for beskrivelse av bestandenes habitat i rom og tid i ulike livsstadier, mens den modellerte primær- og sekundærproduksjonen gir resultater i rom og tid for den biologiske produksjonen på de laveste trofiske nivåene. Den modellerte primærproduksjon av diatomeer og flagellater og sekundærproduksjonen av mikro- og mesozooplankton gir i liten grad beskrivelse av spesifikke arter som inngår i byttedyrspesifisiteten for de ulike bestandene i følgende avsnitt. Den modellerte biologiske produksjonen er altså kun et bilde på produksjon som utgjør mat for enkelte planktonspisende bestander på ulike livsstadier, som i sin tur er mat for bestander på enda høyere trofiske nivåer. Beskrivelsen av byttedyrsspesifisiteten i de følgende avsnitt er likevel tatt med som en støtte i ekspertvurderingene.
3.6.1 - Nordsjøtorsk (Gadus Morhua)
Byttedyrspesifisitet: Som i andre habitater for atlantisk torsk, er voksen nordsjøtorsk en toppredator i økosystemet. Sammenlignet med de andre store gadoidene i Nordsjøen, dvs. hyse, sei og hvitting, har torsk et mye mer variert kosthold med et bredt spekter av fisk, inkludert kannibalisme (Kjesbu et al., 2021). Også under ungstadiene er torskens diett relativt variert. De tidlige stadiene har imidlertid vist seg å være avhengige av spesielle vårgytende kopepodearter (Rothschild, 1998), mest raudåte, men også høye forekomster av Paracalanus og Pseudocalanus.
Temperatursensitivitet: Atlantisk torsk er fordelt over et bredt temperaturområde fra 0 til 18 oC med en optimal veksthastighet på rundt 13 oC (Sundby, 2000). Gyting og modning krever imidlertid temperaturer under 10 oC (Meeren and Ivannikov, 2006). For tiden har den sørligste delen av Nordsjøen temperaturgrenser for vellykket gyting, mens en fortsatt oppvarming av havet antas å begrense torskens reproduksjon i dette området i fremtiden. Det antas at gytesesongen er synkronisert med våroppblomstringen (Brander, 1994). Det er et åpent spørsmål om torsk vil være i stand til å flytte gytesesongen i den nordlige Nordsjøen fra vårgyting til mer utstrakt gytetid dersom klimaendringer vil resultere i flere helårsgytede copepoder som Calanus helgolandicus, dvs. forutsatt at slike arter fortsetter å være rikelig i den nordlige Nordsjøen under klimaendringer. Imidlertid er dette sannsynligvis begrenset av den sesongmessige lyssyklusen som ikke vil endre seg med klimaendringer (Sundby et al., 2016).
Sensitivitet til forsuring: Havforsuring vil først skje i dypere lag, og det pelagiske overflatelaget vil være mindre påvirket av havforsuring. Det antas imidlertid at de tidlige larvestadiene er mer sårbare for havforsuring enn de voksne, antagelig på grunn av uutviklede gjeller uten ioneregulerende kapasitet (Frommel et al., 2013). Eksperimenter med torskelarver fra Østersjøen og Barentshavet viser økt dødelighet av begge bestandene under IPCC RCP8.5-scenarioet (sammenlignet med atmosfærisk CO2 på 1100 ppm ved slutten av det 21. århundre) (Stiasny et al., 2016), selv om ingen signifikante påvirkninger på de baltiske torskelarvene er sett (Frommel et al., 2013) da Østersjøen er naturlig utsatt for havforsuringssvingninger innenfor lav saltholdighet og suboksiske forhold. Baltiske torskelarver indikerer høy tilpasningsevne til havforsuring. Nordsjøtorsken forventes å vise samme grad av sårbarhet som Barentshavstorsken. Det ble også observert at norske kysttorskelarver fikk vevsskade under høy havforsuring (Frommel et al., 2012). Dessuten ser høy havforsuring ut til å påvirke otolittforkalkning i Barentshavets torskelarver (Maneja et al., 2013). RCP8.5- scenariet ser altså ut til å kunne være ødeleggende for torskebestanden i Nordsjøen, men det er mindre klart hvordan det mer realistiske IPCC-scenarioet RCP4.5 vil påvirke torskelarver.
3.6.2 - Raudåte (Calanus finmarchicus)
Byttedyrspesifisitet: Arten lever av både mikrozooplankton som ciliater (flimmerdyr), og planteplankton som diatomeer og flagellater, og utgjør en viktig kobling mellom planteplanktonet og de høyere trofiske nivåene i næringskjeden (Aksnes and Blindheim, 1996).
Temperatursensitivitet: Raudåte er en arktisk-boreal kopepode med overvintringsstrategi hvor den deponerer store mengder fett i den korte beiteperioden under våroppblomstringen. Med disse energilagrene overlever den på store dyp i vinterhalvåret. De to store overvintringsområdene finnes i Norskehavsdypet og i den Subarktiske gyren sør for Grønland og øst for Newfoundland. Omgivelsestemperaturen for raudåte, representert ved årsmiddeltemperaturen i 100 m dyp, varierer fra omtrent 0.5 til 14 oC og med største forekomst fra 4 til 6 oC (Sundby (2000), Figur 6). Temperaturfordelingen er asymmetrisk, 55 % av hele biomassen finnes mellom 2 og 6 oC. Sirkulasjonsmønsteret i Nord-Atlanteren er også en viktig faktor i å strukturere fordelingen (Sundby (2000), Figur 5) som følge av livssyklusdynamikken med overvintring i de to dypområdene og transport med hovedstrømmene gjennom den pelagiske vår og sommerfasen. Dette kan være forklaringen på den asymmetriske temperaturfordelingen, mens yttergrensene for temperatur (0.5 til 14 oC) trolig i større grad reflekterer de biologiske yttergrensene. Eksperimentelle laboratoriestudier viser imidlertid at raudåte kan overleve opp mot 20 oC (Hirche, 1987). Det må påpekes at disse eksperimentene gjaldt kun korttidseksponeringer, første over et tidsrom på 24 timer, det andre opp til 3 døgn, og dekker således kun akutt dødelighet og ikke kritiske temperaturgrenser for vekst, levedyktighet og reproduksjon som populasjon i sin helhet.
Sensitivitet til oksygen: Kaartvedt et al. (2021) fant at den nære slektning av raudåte, Calanus helgolandicus, ble funnet overvintrende i Oslofjorden ved oksygenkonsentrasjoner ned mot 0,2-0,3 ml l-1 ved 8 oC. Marshall et al. (1935) fant at oksygenforbruket for raudåte var uendret ned til oksygenkonsentrasjoner på omtrent 4 ml l-1. Med denne bakgrunn antas det at raudåte i den aktive pelagiske fasen vil være relativt upåvirket av oksygenvariasjoner ned mot 4 ml l-1 og at den tåler lavere oksygenkonsentrasjoner i overvintringsfasen i dypet, kanskje ned mot verdier som funnet for Calanus helgolandicus i Oslofjorden på godt under 1 ml l-1(Kaartvedt et al., 2021). Så lave oksygenkonsentrasjoner vil kunne forekomme for overvintrende raudåte i terskelfjorder på Vestlandet.
Sensitivitet til forsuring: Det er ikke påvist negative effekter av forsuring på raudåte (Bailey et al., 2016). Selv ikke under RCP8.5-scenariet er det påvist negative effekter i slutten av århundret (Runge et al., 2016). Dette må allikevel anses som foreløpige resultater, siden eksperimentelle undersøkelser over forsuring krever gjentatte undersøkelser, og denne forskningen er ennå i en tidlig fase.
3.6.3 - Lysing (Merluccius merluccius)
Byttedyrspesifisitet: I Nordsjøen, Norskehavet og Skagerrak lever voksen lysing av brisling, makrell, kolmule, voksen sild, sei, hvitting, reker og ungtorsk, mens ungfisk av lysing foretrekker mikrozooplankton, i det minste om sommeren (Cormon et al., 2014; Werner, 2015).
Temperatursensitivitet: På grunn av sin generelt dype utbredelse er voksen lysing mindre sårbar for høye sommertemperaturer så vel som lave vintertemperaturer som forekommer i overflatelagene. Artens vide breddegradsområde indikerer også dens brede temperaturtoleranse (Dulvy et al., 2008). På den annen side, med sin nordligste utbredelse nær polarsirkelen kan den ha nådd sin nordligste utbredelse i henhold til hypotesen om at det er en grense for hvor langt tempererte arter kan avansere mot polene på grunn av den sesongdominerte våroppblomstringsdynamikken på høye breddegrader (Sundby et al., 2016). Feltundersøkelser av egg og larver langs kontinentalsokkelen sørvest for de britiske øyer viste høyeste forekomster av egg og larver i vann med temperatur på 12-13 oC (Alvarez et al., 2004). Tilsvarende fant Guevara-Fletcher et al. (2017) ved laboratorieeksperimenter optimal veksthastighet for lysinglarver ved 12.7 oC. Høyeste omgivelsestemperatur fant Alvarez et al. (2004) ved 17 oC, og Coombs and Mitchell (1982) fant høy dødelighet på egg over 18 oC i laboratoriet. Den laveste temperaturgrensen er ikke så godt undersøkt, men Coombs and Mitchell (1982), som inkuberte egg fra 5.3 til 23.2 oC, fant ingen signifikante forskjeller i dødelighet mellom 5.3 og 15.6 oC, men altså en nær 100 % dødelighet når temperaturen oversteg 18 oC.
Sensitivitet til oksygen: Lysing har en ekstrem tilpasning til lave oksygenverdier. Dette har nok sammenheng med at lysing er den vanligste bunnfiskarten i de 4 store østlige oppstrømningssystemene (Benguela, Kanari-, Humboldt-, og California-strømmen) som alle har store områder med lave oksygenverdier og til dels anoksiske forhold. Vi snakker altså om en økologisk tilpasning over millioner av år. I Benguela-strømmen ble levende lysing-egg normalt funnet over de anoksiske dypområdene ved oksygenverdier ned mot 0.3 ml l-1 (Sundby et al., 2001). Også den voksne lysingen har stort potensiale til å klare seg i svært lave oksygenverdier (Salvanes et al., 2015). Derfor vil ikke lavere oksygenverdier være noen begrensende faktor for utviklingen av lysingbestandene i norske farvann, heller ikke i norske terskelfjordsystemer som kan forventes å få forlengete perioder med anoksisk dypvann under fremtidige klimaendringer. Under slike fjordforhold vil trolig lysingen ha en fordel framfor andre arter.
Sensitivitet til forsuring: Gjennom tilpasningen til lave oksygenverdier i de store østlige oppstrømningssystemene må det òg forventes at lysing er tilpasset de betydelig lavere pH-verdiene i slike områder. Vi antar derfor at også lysing er mer robust mot framtidig forsuring enn fiskearter flest.
3.6.4 - Nordøstatlantisk makrell (Scomber scombrus)
Byttedyrspesifisitet: Makrell kan livnære seg på en hel rekke byttedyrtyper avhengig av tilgjengelighet (Langøy et al., 2012). Makrell har en bred nisje i både antall byttedyrarter og byttedyrstørrelsesgrupper som spenner fra mikrozooplankton til fiskelarver og yngel. De kan også vise kannibalistisk beiteatferd. Bestanden er derfor en utpreget byttedyrgeneralist (Langøy et al., 2012). Tidligere studier har vist klar tetthetsavhengig vekstrate for makrell. Mattilgjengelighet er derfor kjent for å påvirke veksthastighet og tilstand (vekt og lengde ved alder) betydelig (Olafsdottir et al., 2015).
Temperatursensitivitet: Makrell er svært robust mot endringer i temperaturen på grunn av deres brede utbredelse og uttalte mulighet for vertikal migrasjon og svømming (Olafsdottir et al., 2015). Basert på kartlegginger av eggfordelinger i gyteområdene vest for de britiske øyer fra 1990-tallet ble det funnet at optimal gytetemperatur var ved 13 oC som var i området vest og nordvest for Irland (Brunel et al., 2018). Høyest temperatur for egg var ved omtrent 18 oC som var i området ned mot Biscaya og nordvestkysten av Spania, dvs. Galicia. Makrellegg ble funnet så langt nord som i den sørlige delen av Norskehavet og nordvestover mot Island etter 2010. Egg ble funnet ved temperaturer ned mot 6 oC. Ut ifra denne fordeling kan det være grunn til å tro at gyting også kan forekomme i temperaturer lavere enn 6 oC. I Nordsjøen ble egg funnet i temperaturer fra 8 til 15-16 oC (van Damme et al., 2011), og de høyeste eggkonsentrasjonene ble funnet i vann ved 13 – 14 oC. Atlantiske makrellegg, kunstig befruktet fra gyteklar makrell fanget i Biscayabukten, ble utviklet i laboratoriet ved 5 forskjellige temperaturer fra 8.6 til 17.8 oC (Mendiola et al., 2006). Gjennomsnittlig dødelighet var høyest ved 8.6 og 17.8 oC, mens minimum dødelighet var ved 11.1 oC.
Sensitivitet til oksygen: Det er svært lite informasjon om oksygenforbruk hos atlantisk makrell. Men som en hurtigsvømmende fisk er oksygenforbruket gjennomgående høyt og på linje med atlantisk laks (Lucas et al., 1993). Dessuten, siden makrell ikke har svømmeblære er den avhengig av å kunne svømme kontinuerlig, og den har trolig ikke samme egenskaper til å pumpe vann over gjellene med gjellelokkene slik som eksempelvis torsk og steinbit når de er i ro med lavt energiforbruk. Det er derfor grunn til å anta at oksygenbehovet vil være høyere hos atlantisk makrell enn for øvrige fisk.
Sensitivitet til forsuring: Det finnes ikke informasjon om virkningen av havforsuring på atlantisk makrell. Det er ikke å forvente at forsuring vil ha spesielle effekter på makrell forskjellig fra øvrige vertebrater.
3.6.5 - Nordsjøsild og norsk vårgytende sild (Clupea harengus)
Byttedyrspesifisitet: Etter gyting vandrer norsk vårgytende sild inn i Norskehavet for å beite. Hovedbyttedyrarten om sommeren er kopepoden raudåte (Dalpadado et al., 2000). Hovedbeiteområdene er frontområdene mellom det varme atlantiske og det kalde arktiske vannet, i den sentrale og vestlige delen av Norskehavet, men noen ganger strekker det seg inn i arktiske farvann der norsk vårgytende sild lever av Calanus hyperboreus (Broms et al., 2012). I september-november trekker silden nordøstover til de viktigste overvintringsområdene utenfor kysten og i fjordene i Nord-Norge. Gytetrekket sørover starter i januar.
Temperatursensitivitet: De atlantiske sildebestandene finnes fordelt på begge sider av Nord-Atlanteren. På vestsiden er de fordelt fra Bay of Fundy til Gulf of St. Lawrence hvor årsmiddeltemperaturen i overflaten varierer fra 10 oC i sør til 4 oC i nord. Langs de europeiske kystene er sildebestandene fordelt over et betydelig større område fra sørligste delen av Nordsjøen til kystområdene langs Troms i nord. Her varierer årsmiddeltemperaturen fra 12 oC i sør til i underkant av 4 oC i nord (dos Santos Schmidt et al., 2021). Bestanden av norsk vårgytende sild er fordelt i et årsmiddeltemperaturområde varierende fra opp mot 9 oC til under 4 oC for den umodne delen av bestanden i det østlige Barentshavet. Bestanden av nordsjøsild er fordelt med en årsmiddeltemperatur fra 11 oC i den sørlige Nordsjøen til 7 oC i den nordlige delen av Nordsjøen. Dette innebærer at komponentene av nordsjøsild i sør lever nær den sørligste og øvre temperaturgrensen (12 oC) for atlantiske sildebestander, mens norsk vårgytende sild lever over et bredt temperaturintervall fra 9 oC og ned til laveste observerte temperatur for atlantiske sildebestander på under 4 oC.
Sensitivitet til oksygen: Sild har generelt svært høy toleranse for lave oksygenkonsentrasjoner. Domenici et al. (2002) fant ingen endringer i adferd ned til 30 % oksygenmetning. Responsen til sildestimer når metningskonsentrasjonen kommer ned mot 25 % oksygenmetning er at stimen blir mindre tett, altså at den sprer seg utover for å redusere ytterligere reduksjon i oksygenkonsentrasjon som følge av stimens totale oksygenforbruk.
Sensitivitet til forsuring: Det er ingen klare konklusjoner på virkninger av havforsuring på sild. Franke and Clemmesen (2011) fant ingen effekt av forsuring på sildelarver, og Maneja et al. (2015) som undersøkte større fisk fant ingen effekt av forsuring på adferd eller næringsaktivitet. Derimot fant Frommel et al. (2014) lavere vekst og organskader på sildelarver under høye forsuringsscenarier.
3.6.6 - Nordøstarktisk torsk (Gadus morhua)
Byttedyrspesifisitet: Dietten til nordøstarktisk torsk endres med alderen. Den direkte virkningen av høye konsentrasjoner av kopepoder og krill på torskens næringsvalg regnes å være viktig i den pelagiske fasen fram til bunnslåing på høsten (Vikebø et al., 2005, 2007; Kristiansen et al., 2011). Eldre individer er for det meste piscivore, inkludert eksempler på kannibalistisk atferd på foregående årsklasser (Holt et al., 2019), men lodde er foretrukket (Bogstad et al., 2000).
Temperatursensitivitet: Svært få fiskearter er undersøkt så detaljert med hensyn til temperatur som atlantisk torsk. Den generelle klokkeformede temperaturavhengigheten for ektoterme organismer som vanligvis er beskrevet utifra den geografiske utbredelsen av arten i forhold til omgivelsestemperaturen kjenner man i større detalj for atlantisk torsk. Dette fordi det også er gjennomført omfattende temperaturavhengige laboratoriestudier av torsk i ulike livsfaser. Av disse framgår det at temperaturtilpasningen er tildels svært ulik for de ulike livsstadiene. Kjesbu et al. viste at gonademodningen for gytebestanden stopper helt opp når temperaturen overstiger 9,6 oC. Dette er betydelig lavere enn optimal temperatur for spesifikk veksthastighet for larver og pelagisk yngel. Otterlei et al. (1999) som undersøkte spesifikk veksthastighet for torsk fant 14 oC som optimal temperatur. Björnsson et al. (2001) undersøkte i større detalj temperaturavhengig vekst (% vekst per dag) for en rekke størrelsesgrupper av torsk fra larver (2 gram) til ungfisk (2213 gram) i laboratoriet hvor fisken ble foret ad libitum. Optimal veksthastighet avtok fra 17 oC for yngel på 2 gram til 8,5 oC for ungfisk på 2,2 kg. Det er interessant å merke seg at det mest markante fallet skjedde fra 29 gram, da optimal veksthastighet var ved omtrent 13,5 oC, til 109 gram da optimal veksthastighet var falt til 10 oC (se Björnsson et al. (2001), Figur 1) . Dette vektspennet sammenfaller omtrent med størrelsen når fisken går fra pelagisk yngel til bunnslåing som 0-gruppe fisk, altså omkring sesongmessig maksimaltemperatur på 10- 12 oC i overflatelagene (august-september) og ned til omtrent 6 oC i 150 m dyp. Det synes altså at larver og pelagisk yngel som lever i de øvre lagene fra våren og utover gjennom sommeren er tilpasset de høyere temperaturene som finnes der, mens ved bunnslåing i september-oktober når fisken har nådd en våtvekt på nærmere 100 g faller optimal veksttemperatur mot nærmere naturlig omgivelsestemperatur i dypet. Som konklusjon er det derfor viktig å sammenligne korrekt omgivelsestemperatur for de ulike stadiene i fiskens livssyklus (se Sundby (2000), Figur 3).
Oksygenrepons: Atlantisk torsk kan overleve oksygenkonsentrasjoner på en metningsprosent ned mot 25 – 30 % (Plante et al., 1998), men under 20 % oksygenmetning overlever ingen individer. En oksygenmetning på over 35 % er nødvendig for å unngå begynnende dødelighet på individer. Svømmeaktiviteten begynner imidlertid å reduseres ved metningskonsentrasjoner under omtrent 50 % (Schlesinger and Ramankutty, 1994). Reduksjon i næringsopptak og spesifikk veksthastighet inntrer allerede ved oksygenmetningsprosent på under 100 % (Thorarensen et al., 2017), men den metabolske aktiviteten er fremdeles på omtrent 90 % av den maksimale når oksygenmetningen er 75 % (Chabot and Claireaux, 2008). Ut ifra dette kan vi oppsummere begrensede effekter på torskens liv så lenge oksygenmetningsmetningskonsentrasjonen ikke kommer under 75 %, men en må anta betydelige effekter når metningsprosenten kommer under 50 % og altså stor dødelighet under 30 % oksygenmetning.
Sensitivitet til forsuring: Det er ikke avklart i sin helhet hvordan havforsuring påvirker atlantisk torsk. Frommel et al. (2013) fant ingen effekt av forsuring på torskelarver fra Østersjøtorsk. På den andre siden, Stiasny et al. (2016) undersøkte vekst og dødelighet for torskelarver fra nordøstarktisk torsk under laboratorieforhold som tilsvarte RCP8.5-scenariet ved år 2100. Det ble funnet en dobling av dødeligheten under slike forhold. Også Voss et al. (2019) fant at torskelarver fra Østersjøen ble negativt påvirket av forsuring.
3.6.7 - Lodde i Barentshavet (Mallatus villosus)
Byttedyrspesifisitet: Raudåte dominerer dietten til liten lodde mens større makroplankton; spesielt euphausiidene Thysanoessa inermis (Euphausiidae) og T. raschii og de to amfipodene Themisto libellula (Hyperiidae) og T. abyssorum dominerer dietten til de større individene (Gjøsæter, 1998).
Temperatursensitivitet: Utbredelse og migrasjon av voksen lodde er rapportert å være begrenset av temperatur eller temperaturinduserte endringer i planktonfordelingen. Den spesifikke temperaturtoleransen til lodde er ikke undersøkt, men observasjoner fra Newfoundland, islandske og norske farvann tyder på at de termiske toleransene for 2 år gammel lodde og eldre er relativt brede under beiting med en typisk nedre grense på rundt -1 oC (Gjøsæter and Loeng, 1987). Likevel okkuperer lodde det kalde vannet og kan beite og vandre langs fronter mellom kalde arktiske og varmere atlantiske vannmasser (Vilhjálmsson, 2002). Selv om denne arktisk-boreale arten har utviklet seg til å leve i kanten av arktiske farvann for å utnytte dagens beitemuligheter, krever lodde høyere temperaturer for vellykket reproduksjon. Modning er rapportert å kreve temperaturer på 2-4 oC (Carscadden et al., 1985).
Sensitivitet til forsuring: Lodde er avhengig av dyreplanktoniske krepsdyr for mat i alle livsstadier; kopepod nauplii som larver, kalanoide kopepoder som unge og makrozooplankton, spesielt krill, som voksne (Dalpadado and Mowbray, 2013; Gjøsæter, 1998). Noen krepsdyr er følsomme for havforsuring, og selv om skademekanismene ikke er helt kjente, kan lav pH påvirke både eksoskeletonkalsifisering og intracellulære syrebaserte reguleringer (Kawaguchi et al., 2013).
3.6.8 - Snøkrabbe (Chionoecetes opilio)
Byttedyrspesifisitet: Generelt er snøkrabben en altetende art og lever på en rekke infauna- og epifaunaarter som lever i bløtbunnssubstrat. I tillegg er også rester av fisk kjent for å være byttedyr. De hyppigste byttedyrgruppene er muslinger, små krepsdyr og polychaeter (Kolts et al., 2013).
Temperatursensitivitet: Snøkrabben er karakterisert som en subarktisk art og har et begrenset temperaturområde mellom -1 til 6 oC. Det er vist at når snøkrabben lever i temperaturer nær 6-7 oC, antas de metabolske kostnadene å matche metabolske gevinster (Siikavuopio et al., 2019).
Sensitivitet til forsuring: Snøkrabben er godt tilpasset projiserte havforsuringsnivåer, selv om havforsuringsfølsomheten til yngel fortsatt må undersøkes (Foy et al., 2018).
3.6.9 - Polartorsk (Boreogadus saida)
Byttedyrspesifisitet: Dietten til ung polartorsk består av en rekke Calanus spp. inkludert Calanus glacialis, Calanus hyperboreus og raudåte, og med økning i fiskestørrelse begynner hyperiide arter å dominere i dietten. Eldre polartorsk beiter også på fisk (Hop and Gjøsæter, 2013). En nedgang i arktiske habitater og arktiske byttedyr som Calanus glacialis og Themisto libellula kan ha negative konsekvenser for beiteforholdene. Polartorsk beiter imidlertid også på boreale (Meganyctiphanes norvegica, Euphausiidae) og arktoboreale (Themisto inermis) euphausiider kan derfor til en viss grad kompensere for nedgangen av de arktiske artene (Eriksen et al., 2020a).
Temperatursensitivitet: Polartorsk har frostvæskeproteiner i blodet (Hop and Gjøsæter, 2013) og tåler derfor omgivelsestemperaturer ned til -1,8 oC som gir et temperaturtilfluktssted fra rovdyr. Selv om polartorsk tåler høyere temperaturer, foretrekker den generelt kalde arktiske vannmasser. Størstedelen av polartorsk i Barentshavet finnes ved vanntemperaturer mellom 2,0 og 5,5 oC, mens 0-gruppe er observert i intervallet 0.9–8.0 oC (Eriksen et al., 2015). Imidlertid er tidlige livsstadier og spesielt egg begrenset til kaldt vann med egg som flyter under isen i betydelig tid etter gyting (Eriksen et al., 2020b). Termisk stress på grunn av økte sommer- og høsttemperaturer, spesielt i det sørøstlige Barentshavet, og reduksjon av isdekke resulterer i tap av egnede gytehabitater om vinteren. Dette kan ha en negativ effekt på rekrutteringen, og dermed føre til en ytterligere nedgang av polartorsk i Barentshavet.
Sensitivitet til forsuring: Det antas at arter berørt av havforsuring kan kompensere med økt energibehov. Imidlertid lever arktiske arter i lave temperaturer og har derfor mindre energi tilgjengelig for å håndtere ekstra press enn andre tempererte arter. Dyreplanktonarter som utnyttes av polartorsk påvirkes kun i de tidlige kopepodittstadiene og da hovedsaklig gjennom vekst (Thor et al., 2018). Polartorsk har svekkede svømmeevner under forhøyet pCO2 (1 170 micro atm) (Kunz et al., 2018). Samlet sett er det vitenskapelige grunnlaget gjennom eksperimentelt arbeid foreløpig utilstrekkelig til å forutsi effekter av havforsuring på polartorsk.
4 - Resultater
De fargede polygonene i Figur 4 representerer regionene hvor tidsserier av ulike variabler fra representative vannmasser fra modellsimuleringene er hentet ut. Basert på bestandenes ulike gyte-, oppvekst- og beitehabitat bruker vi tidsserier fra de ulike polygonene til å studere bestandenes klimaekpsponeringer innenfor disse. Sammenholdt med de ulike sensitivitetsattributtene kan vi så gjøre en ekspertvurdering for å komme frem til de akkumulerte retningseffektene.
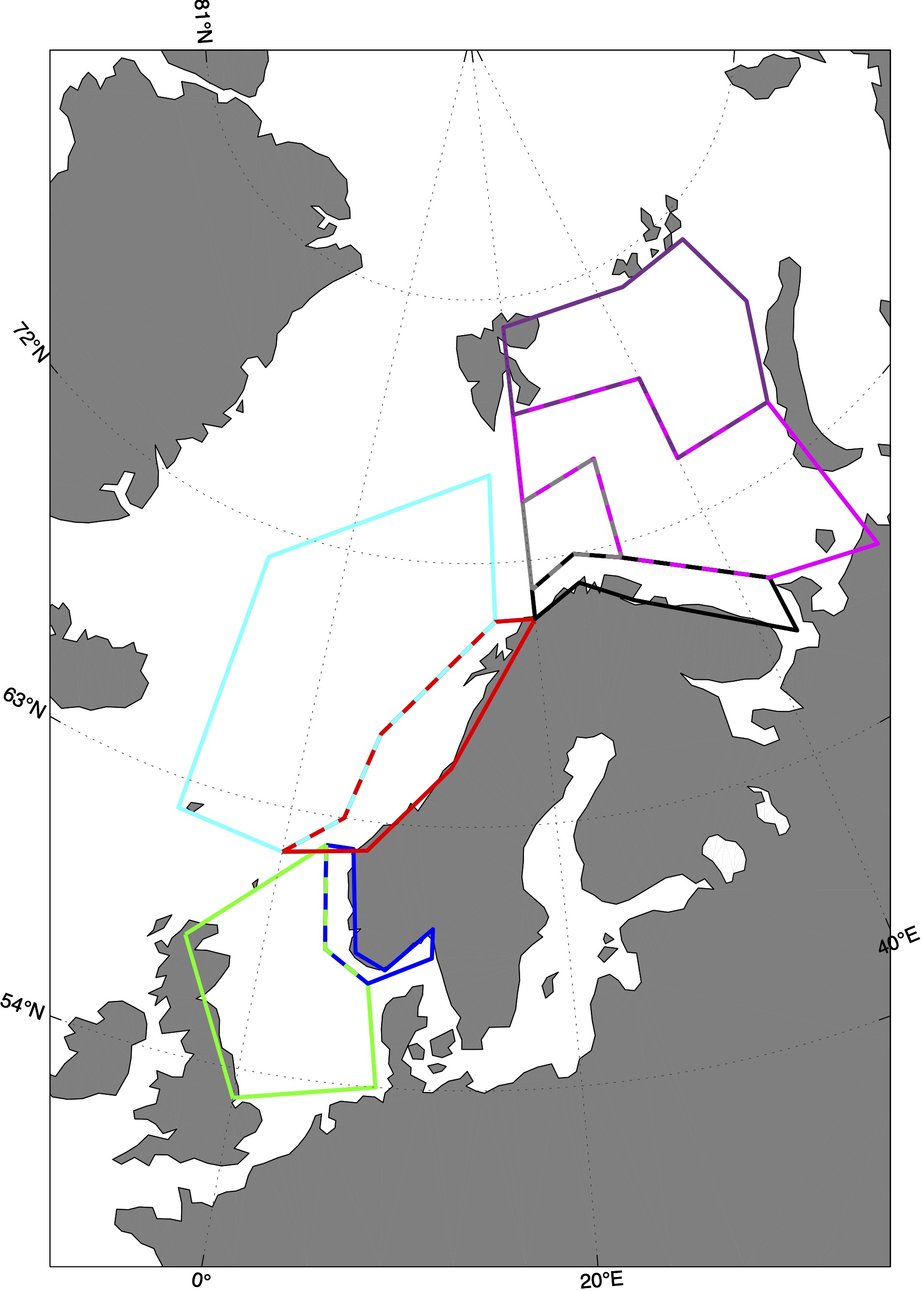
4.1 - Fremskrivninger
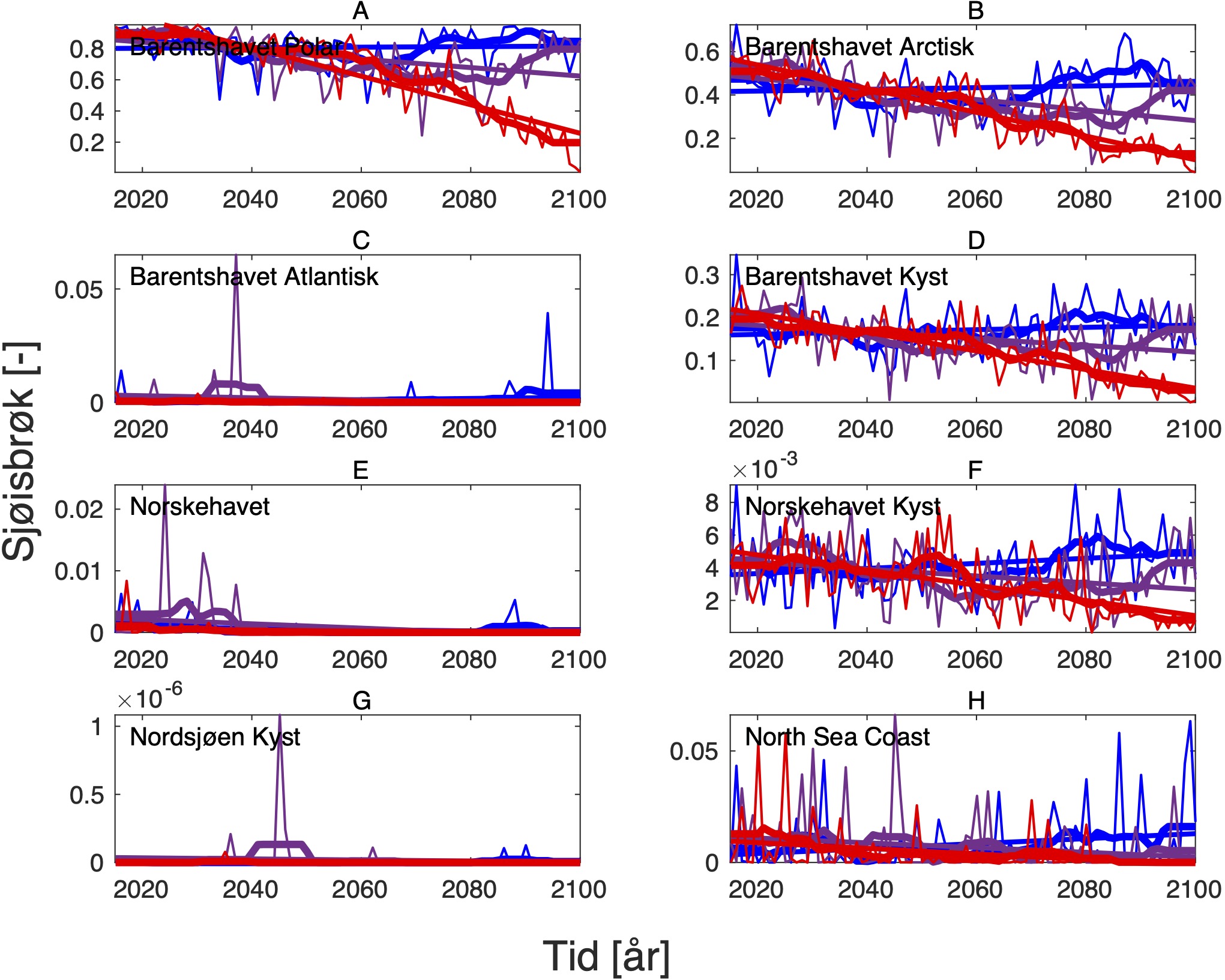
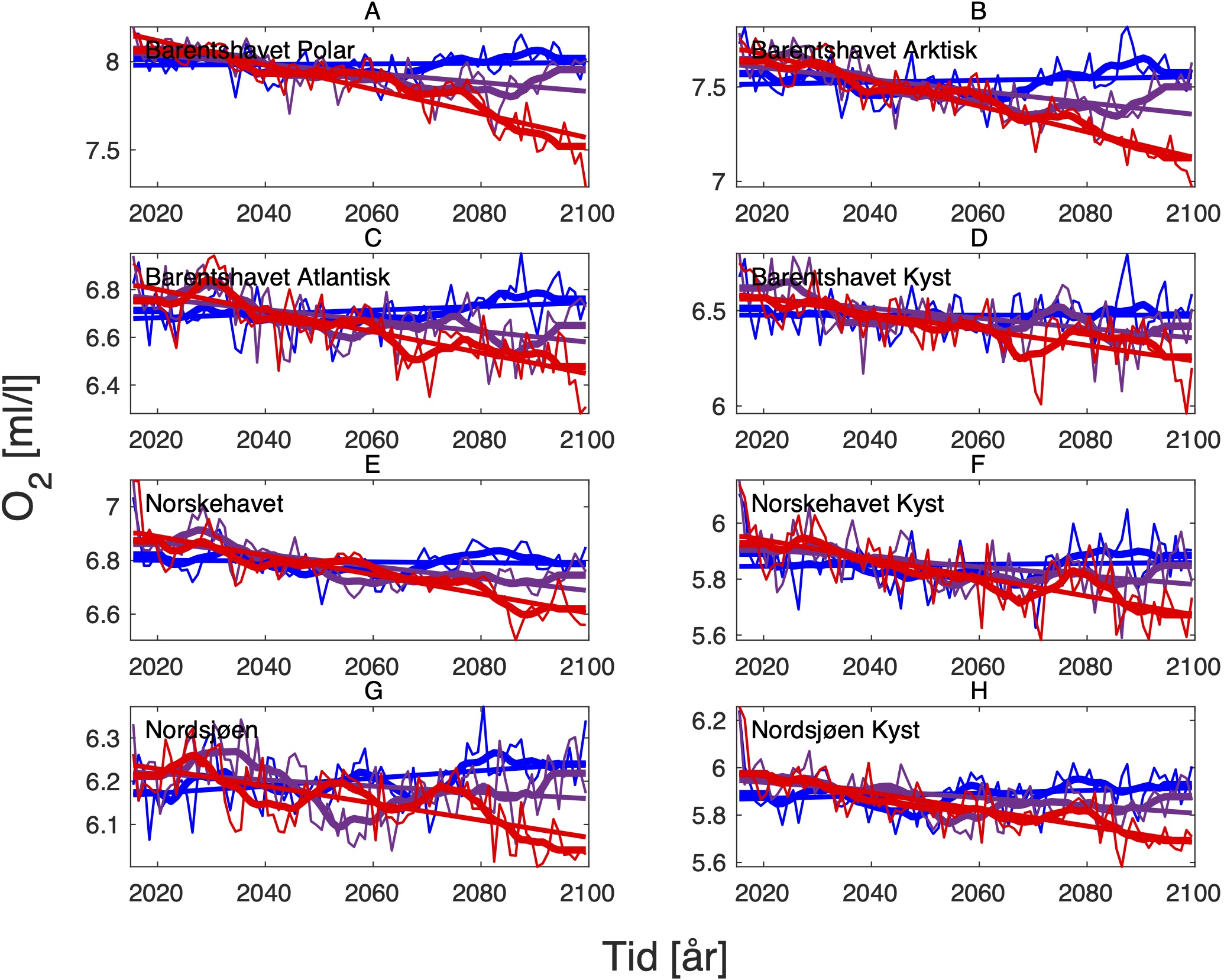
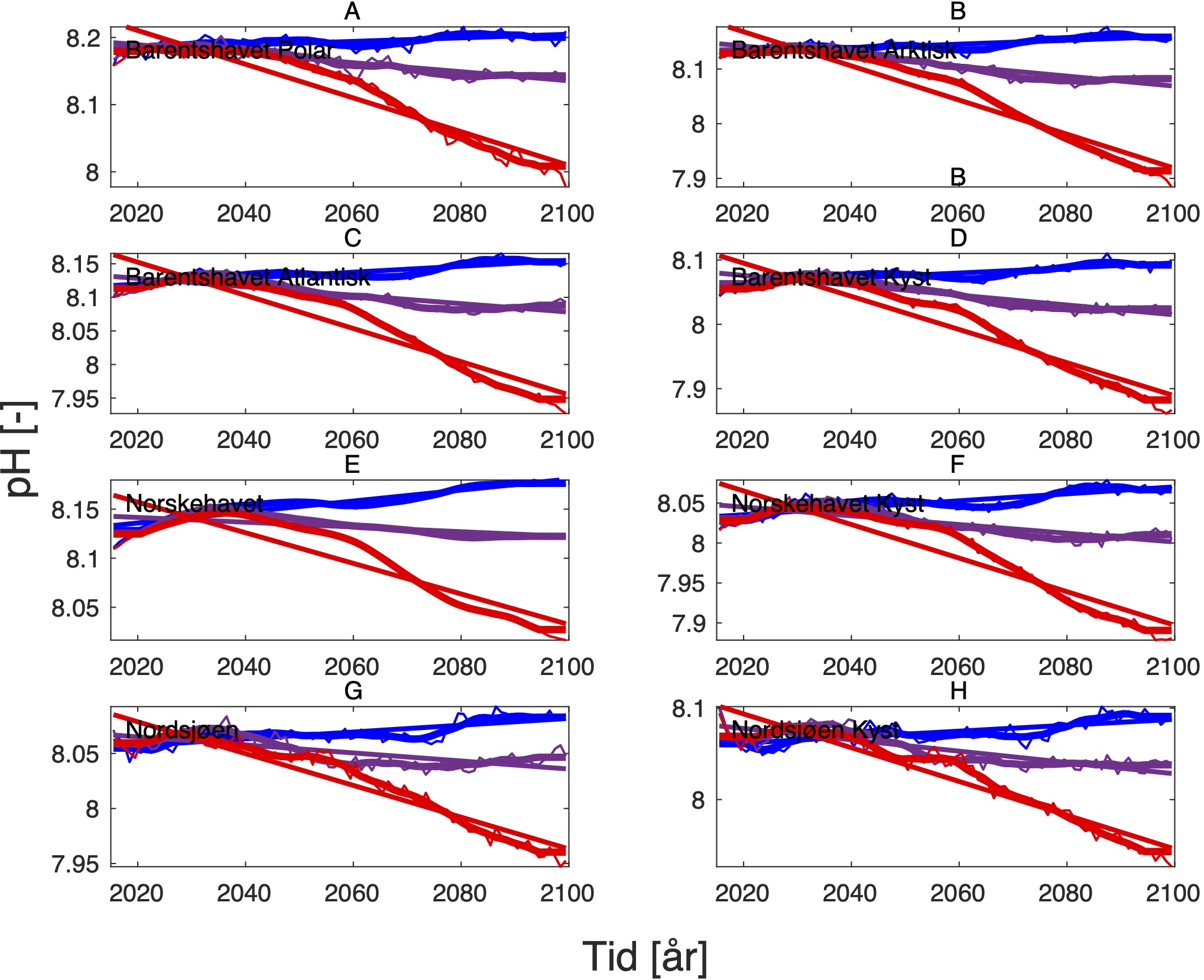
For å hente ut relevant informasjon for retningseffektene har vi, basert på tidsseriene for klimaeksponeringsvariablene i de ulike polygonene i de tre scenariene, laget tabeller med beregnede endringer, standardavvik, samt start- og sluttverdier på trendlinjene (Tabell 1-11) og figurer med tidsserier og trendlinjer (Figur 5-13) og romlige fordeling av endringer osv. (Figur 14-17).
4.2 - Temperatur
For å studere hvordan minimums- og maksimumstemperaturer endrer seg i forhold til dagens klokkeformede temperaturtilpasninger har vi hovedsaklig sett på henholdsvis mars og november måned i ulike dyp. Når det gjelder temperaturer for gonademodning har vi valgt å se på november måned som er representativ for å studere gyteforholdene under global oppvarming til arter som er begrenset av en maksimumstemperatur under gytingen. November måned representerer maksimum temperatur i de intermediære og dypere vannlag der mange av bestandene vi her ser på beiter før de setter kurs for de respektive gyteområdene. Overflatetemperatur i juli er representativ for den tiden da blant annet raudåte beiter ved overflaten, og tilhørende endringer i temperatur er derfor også tatt med for denne måneden.
|
SST |
Endring±SD |
||
|---|---|---|---|
|
|
SSP1-2.6 |
SSP2-4.5 |
SSP5-8.5 |
|
BS Pol |
-0.06±0.16 (-1.6 - -1.7) |
0.38±0.26 (-1.7 - -1.4) |
1.80±0.66 (-2.2 - -0.4) |
|
BS Ark |
-0.28±0.43 (0.0 - -0.3) |
0.94±0.55 (-0.3 - 0.6) |
2.59±0.85 (-0.9 - 1.7) |
|
BS Atl |
-0.40±0.41 (4.2 - 3.8) |
0.77±0.51 (3.8 - 4.6) |
2.59±0.85 (-0.9 - 1.7) |
|
BS K |
-0.42±0.42 (2.2 -1.8) |
0.76±0.54 (1.8 - 2.6) |
2.20±0.75 (1.4 - 3.6) |
|
NH |
0.08±0.29 (5.3 - 5.4) |
0.91±0.47 (5.0 - 5.9) |
1.29±0.46 (4.9 - 6.2) |
|
NH K |
-0.37±0.32 (6.3 - 6.0) |
0.29±0.41 (6.1 - 6.4) |
1.27±0.50 (5.9 - 7.1) |
|
NS |
-0.60±0.50 (6.7 - 6.1) |
0.26±0.59 (6.4 - 6.6) |
1.31±0.62 (6.1 - 7.4) |
|
NS K |
-0.73±0.76 (5.3 - 4.5) |
0.52±0.81 (4.9 - 5.4) |
1.40±0.81 (4.8 - 6.2) |
|
SST |
Endring±SD | ||
|---|---|---|---|
|
|
SSP1-2.6 |
SSP2-4.5 |
SSP5-8.5 |
|
BS Pol |
0.18 ± 0.87 (1.2 - 1.4) |
1.90 ± 0.99 (0.7 - 2.6) |
4.50 ± 1.49 (0.1 - 4.6) |
|
BS Ark |
0.22 ± 0.84 (4.0 - 4.2) |
1.54 ± 0.93 (3.6 - 5.1) |
4.27 ± 1.57 (3.0 - 7.3) |
|
BS Atl |
0.11 ± 0.81 (6.7 - 6.8) |
0.63 ± 0.78 (6.6 - 7.3) |
2.71 ± 1.15 (6.1 - 8.8) |
|
BS K |
0.11 ± 1.02 (7.2 - 7.3) |
0.97 ± 1.05 (7.0 - 8.0) |
3.69 ± 1.56 (6.3 - 10.0) |
|
NH |
-0.21 ± 0.77 (8.8 - 8.6) |
0.95 ± 0.70 (8.3 - 9.3) |
1.64 ± 0.83 (8.1 - 9.8) |
|
NH K |
-0.43 ± 1.37 (11.6 - 11.2) |
1.15 ± 1.24 (10.9 - 12.1) |
1.69 ± 1.35 (10.8 - 12.5) |
|
NS |
-0.25 ± 1.01 (14.0 - 13.8) |
1.04 ± 1.12 (13.6 - 14.6) |
1.72 ± 1.13 (13.8 - 15.5) |
|
NS K |
-0.29 ± 1.36 (14.8 - 14.5) |
1.38 ± 1.52 (14.2 - 15.6) |
2.40 ± 1.52 (14.3 - 16.7) |
|
T100 |
Endring±SD | ||
|---|---|---|---|
|
|
SSP1-2.6 |
SSP2-4.5 |
SSP5-8.5 |
|
BS Pol |
-0.10 ± 0.22 (-1.3 - -1.3) |
0.23 ± 0.27 (-1.4 - -1.1) |
1.59 ± 0.62 (-1.8 - -0.2) |
|
BS Ark |
-0.32 ± 0.47 (0.6 - 0.3) |
1.01 ± 0.59 (0.2 - 1.2) |
2.82 ± 0.92 (-0.4 - 2.4) |
|
BS Atl |
-0.39 ± 0.41 (4.2 - 3.8) |
0.75 ± 0.50 (3.8 - 4.6) |
2.18 ± 0.74 (3.4 - 5.6) |
|
BS K |
-0.48 ± 0.45 (3.1 - 2.7) |
0.88 ± 0.58 (2.6 - 3.5) |
2.32 ± 0.79 (2.3 - 4.6) |
|
NH |
0.06 ± 0.28 (5.3 - 5.3) |
0.92 ± 0.47 (4.9 - 5.9) |
1.28 ± 0.46 (4.8 - 6.1) |
|
NH K |
-0.35 ± 0.30 (6.7 - 6.4) |
0.34 ± 0.40 (6.5 - 6.8) |
1.34 ± 0.51 (6.2 - 7.5) |
|
NS |
-0.55 ± 0.42 (7.2 - 6.7) |
0.14 ± 0.51 (7.0 - 7.1) |
1.09 ± 0.51 (6.7 - 7.8) |
|
NS K |
-0.41 ± 0.42 (7.8 - 7.4) |
0.53 ± 0.53 (7.4 - 7.9) |
1.38 ± 0.56 (7.2 - 8.6) |
|
T100 |
Endring±SD | ||
|---|---|---|---|
|
|
SSP1-2.6 |
SSP2-4.5 |
SSP5-8.5 |
|
BS Pol |
-0.24 ± 0.34 (0.1 - -0.1) |
0.87 ± 0.47 (-0.3 - 0.6) |
2.81 ± 0.92 (-0.8 - 2.0) |
|
BS Ark |
-0.30 ± 0.45 (2.6 - 2.3) |
1.19 ± 0.63 (2.1 - 3.2) |
2.83 ± 0.91 (1.6 - 4.5) |
|
BS Atl |
-0.31 ± 0.33 (5.6 - 5.3) |
0.66 ± 0.45 (5.3 - 5.9) |
1.97 ± 0.69 (4.9 - 6.9) |
|
BS K |
-0.11 ± 0.49 (5.9 - 5.8) |
0.77 ± 0.60 (5.6 - 6.4) |
2.01 ± 0.77 (5.3 - 7.3) |
|
NH |
-0.06 ± 0.27 (6.6 - 6.5) |
0.91 ± 0.46 (6.2 - 7.1) |
1.12 ± 0.43 (6.3 - 7.4) |
|
NH K |
-0.27 ± 0.29 (8.7 - 8.4) |
0.31 ± 0.37 (8.5 - 8.8) |
1.21 ± 0.50 (8.3 - 9.5) |
|
NS |
-0.49 ± 0.33 (10.0 - 9.5) |
0.08 ± 0.36 (9.8 - 9.9) |
0.83 ± 0.40 (9.7 - 10.5) |
|
NS K |
-0.18 ± 0.29 (9.8 - 9.6) |
0.02 ± 0.32 (9.8 - 9.8) |
0.66 ± 0.38 (9.6 - 10.2) |
|
T100 |
Endring±SD | ||
|---|---|---|---|
|
|
SSP1-2.6 |
SSP2-4.5 |
SSP5-8.5 |
|
BS Pol |
-0.26 ± 0.25 (-0.6 - -0.9) |
0.44 ± 0.33 (-0.8 - -0.4) |
1.95 ± 0.68 (-1.3 - 0.7) |
|
BS Ark |
-0.47 ± 0.47 (1.4 - 0.9) |
0.98 ± 0.60 (0.9 - 1.9) |
2.70 ± 0.89 (0.4 - 3.1) |
|
BS Atl |
-0.42 ± 0.35 (4.8 - 4.4) |
0.61 ± 0.46 (4.4 - 5.0) |
1.95 ± 0.67 (4.0 - 6.0) |
|
BS K |
-0.42 ± 0.40 (4.0 - 3.6) |
0.79 ± 0.53 (3.6 - 4.4) |
2.01 ± 0.69 (3.3 - 5.3) |
|
NH |
-0.00 ± 0.24 (6.2 - 6.1) |
0.80 ±0.43 (5.8 - 6.6) |
0.99 ± 0.39 (5.8 - 6.8) |
|
NH K |
-0.34 ± 0.28 (7.6 - 7.2) |
0.25 ± 0.37 (7.4 - 7.6) |
1.19 ± 0.46 (7.1 - 8.3) |
|
NS |
-0.41 ± 0.32 (8.6 - 8.1) |
0.05 ± 0.40 (8.4 - 8.5) |
0.93 ± 0.45 (8.1 - 9.1) |
|
NS K |
-0.34 ± 0.32 (7.8 - 7.5) |
0.25 ± 0.41 (7.6 - 7.9) |
1.19 ± 0.47 (7.3 - 8.5) |
|
TBunn |
Endring±SD | ||
|---|---|---|---|
|
|
SSP1-2.6 |
SSP2-4.5 |
SSP5-8.5 |
|
BS Pol |
-0.07 ± 0.21 (-1.2 - -1.3) |
0.08 ± 0.25 (-1.3 - -1.2) |
1.22 ± 0.54 (-1.6 - -0.4) |
|
BS Ark |
-0.22 ± 0.38 (0.1 - -0.2) |
0.85 ± 0.49 (-0.3 - 0.6) |
2.43 ± 0.80 (-0.8 - 1.7) |
|
BS Atl |
-0.35 ± 0.39 (4.0 - 3.7) |
0.77 ± 0.50 (3.7 - 4.4) |
2.13 ± 0.71 (3.2 - 5.4) |
|
BS K |
-0.39 ± 0.40 (2.4 - 2.0) |
0.80 ± 0.54 (1.9 - 2.7) |
2.23 ± 0.76 (1.6 - 3.8) |
|
NH |
-0.33 ± 0.12 (-0.1 - -0.4) |
0.03 ± 0.10 (-0.2 - -0.2) |
0.00 ± 0.15 (-0.2 - -0.2) |
|
NH K |
-0.39 ± 0.28 (5.8 - 5.4) |
0.30 ± 0.37 (5.6 - 5.9) |
1.16 ± 0.45 (5.4 - 6.5) |
|
NS |
-0.63 ± 0.49 (6.7 - 6.1) |
0.28 ± 0.58 (6.4 - 6.7) |
1.33 ± 0.62 (6.1 - 7.5) |
|
NS K |
-0.48 ± 0.40 (7.5 - 7.0) |
0.46 ± 0.49 (7.1 - 7.6) |
1.40 ± 0.55 (6.9 - 8.3) |
|
TBunn |
Endring±SD | ||
|---|---|---|---|
|
|
SSP1-2.6 |
SSP2-4.5 |
SSP5-8.5 |
|
BS Pol |
-0.20 ± 0.28 (-0.4 - -0.6) |
0.64 ± 0.38 (-0.7 - -0.1) |
2.43 ± 0.81 (-1.2 - 1.2) |
|
BS Ark |
-0.24 ± 0.46 (1.9 - 1.7) |
1.22 ± 0.63 (1.4 - 2.6) |
3.03 ± 0.97 (0.9 - 4.0) |
|
BS Atl |
-0.38 ± 0.31 (4.6 - 4.2) |
0.48 ± 0.40 (4.4 - 4.8) |
1.75 ± 0.61 (4.0 - 5.7) |
|
BS K |
-0.13 ± 0.39 (5.2 - 5.1) |
0.82 ± 0.51 (4.9 - 5.7) |
2.27 ± 0.78 (4.6 - 6.8) |
|
NH |
-0.32 ± 0.12 (-0.1 - -0.4) |
0.07 ± 0.11 (-0.2 - -0.1) |
0.04 ± 0.15 (-0.2 - -0.1) |
|
NH K |
-0.29 ± 0.22 (7.4 - 7.1) |
0.26 ± 0.28 (7.1 - 7.4) |
0.97 ± 0.38 (7.0 - 8.0) |
|
NS |
-0.47 ± 0.44 (10.3 - 9.9) |
0.34 ± 0.46 (10.1 - 10.4) |
1.38 ± 0.58 (9.8 - 11.2) |
|
NS K |
-0.30 ± 0.29 (8.6 - 8.3) |
0.17 ± 0.36 (8.4 - 8.6) |
1.05 ± 0.43 (8.2 - 9.2) |
De tre scenariene viser ganske ulik utvikling i overflatetemperaturen. I tråd med den globale modellen som den regionale modellen er nedskalert fra, har SSP1-2.6-scenarioet svake, negative trender i de fleste regioner, spesielt om vinteren (Tabell 1-7). Disse negative trendene kan være et resultat av naturlig variasjon som påvirker temperaturer på regionale skalaer sterkere enn på global skala. De glattede tidsseriene i Figur 5-8, som representerer variasjoner på dekadisk til multidekadisk tidsskala, indikerer at temperaturen i SSP1-2.6-scenarioet er på vei opp igjen mot slutten av århundret.
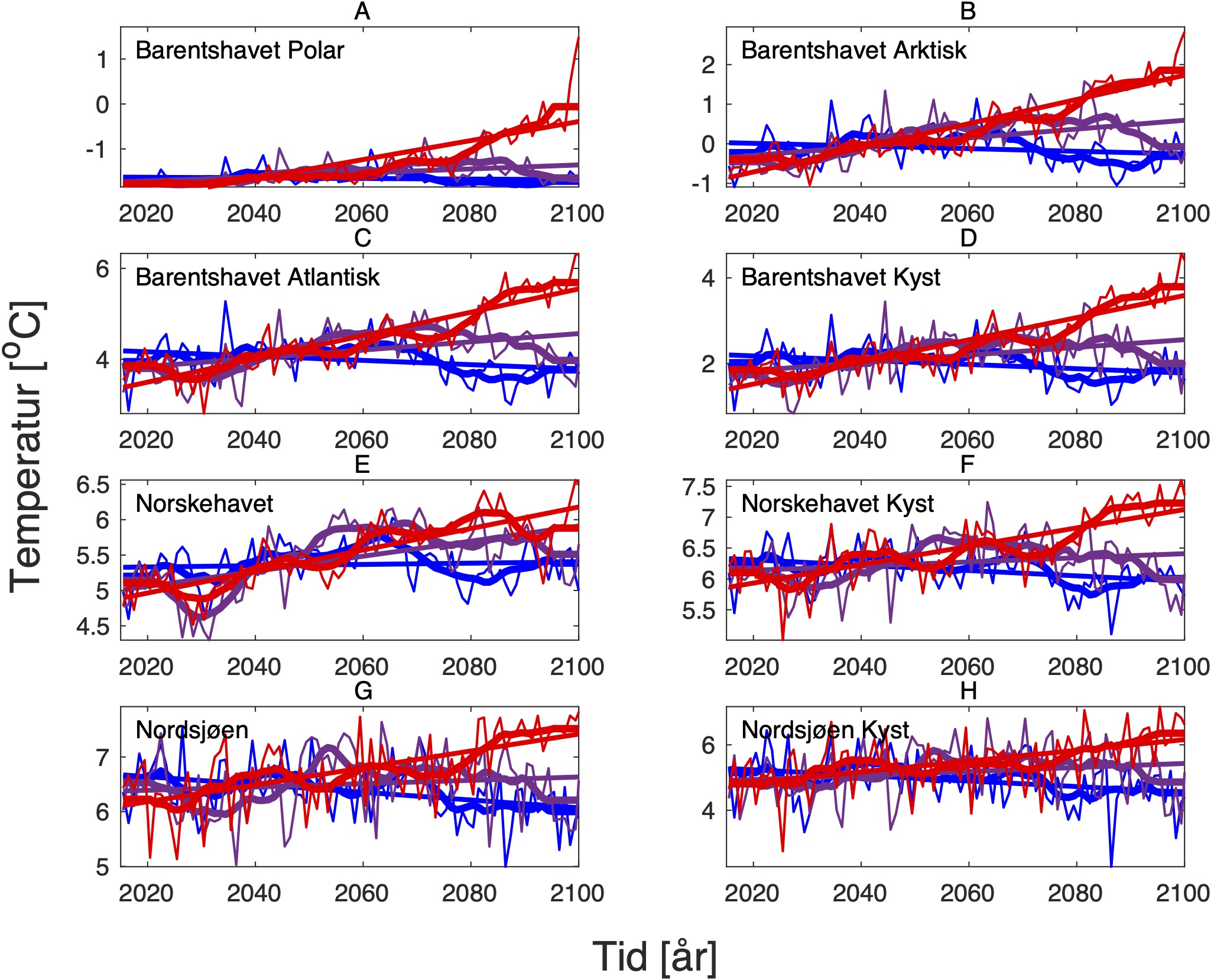
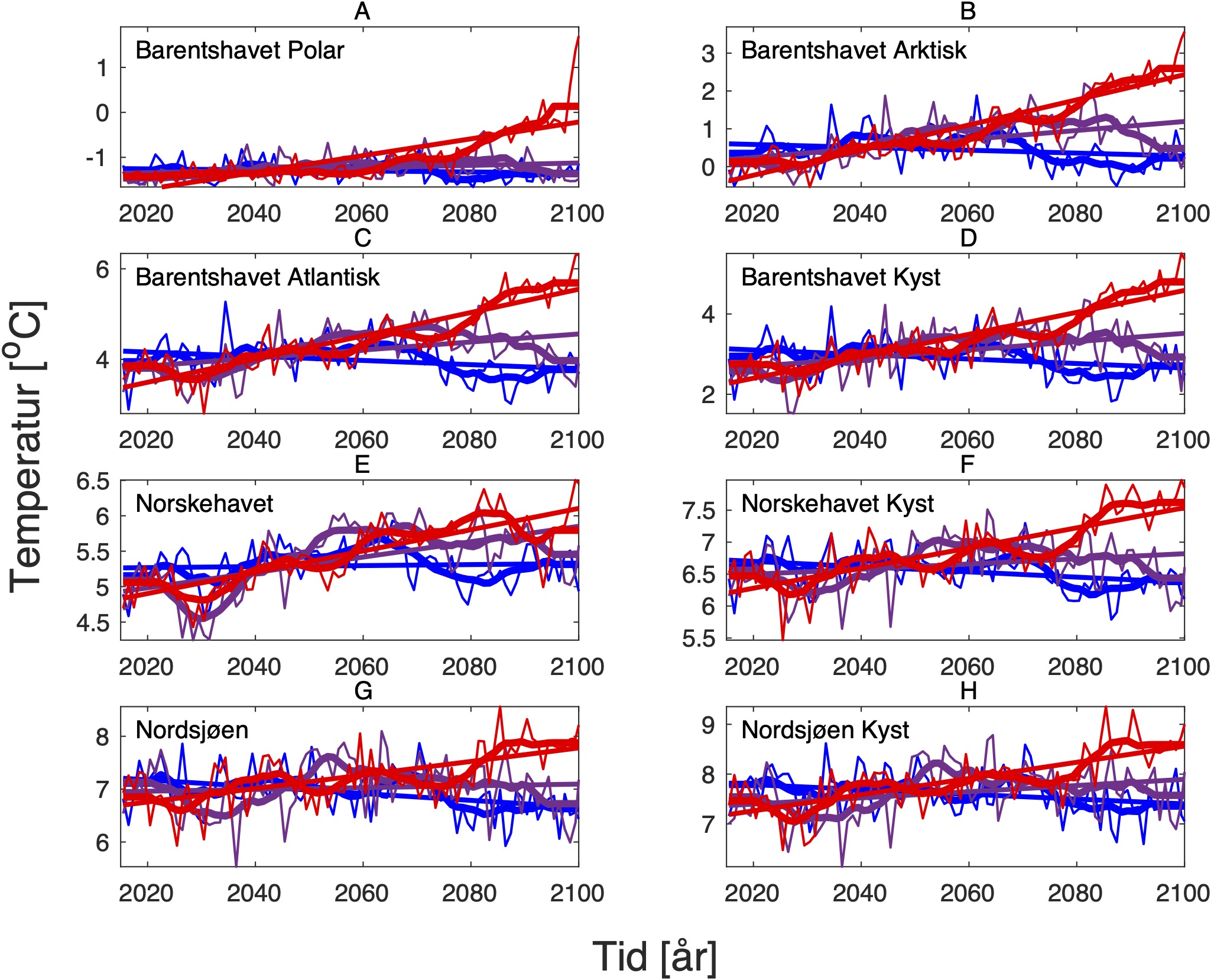
Hadde modellen vært kjørt et par tiår til, ville man trolig fått en positiv trend også i dette scenariet. Man skal derfor være forsiktig med å konkludere med at de negative temperaturtrendene og tilhørende effekter på det marine økosystem vil vare så mye lenger enn til det kommende århundreskiftet. SSP2-4.5-scenarioet viser svake positive trender i alle regioner med unntak av bunntemperaturene i Norskehavet, men også dette scenariet reflekterer sterk langperiodisk (multi-dekadisk) variasjon med maksimale verdier rundt midten av det 21. århundre (Figur 5-8).
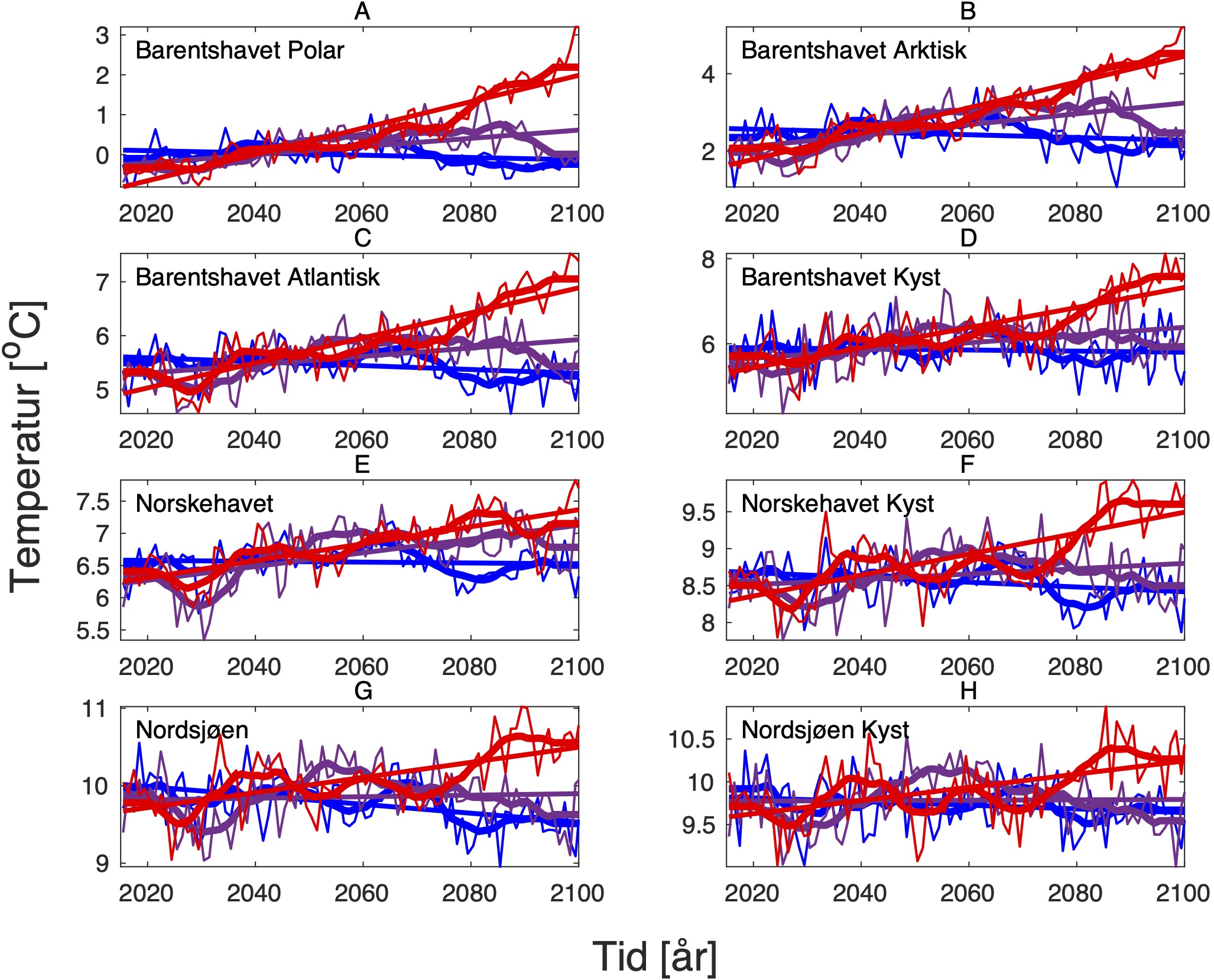
Den svakeste trenden er i Nordsjøen, mens den sterkeste trenden er i Barentshavet Arktis som er sterkt dominert av vannet som kommer fra Norskehavet. Den sterkeste effekten av global oppvarming sees i SSP5-8.5-scenarioet der overflatetemperaturene mot slutten av det 21. århundre skiller seg sterkt ut fra de andre scenariene (Tabell 1-7), med overflatetemperaturtrender i Barentshavet Arktis på opptil 2,6±0,9 oC i mars og 4,5±1,5 oC i juli.
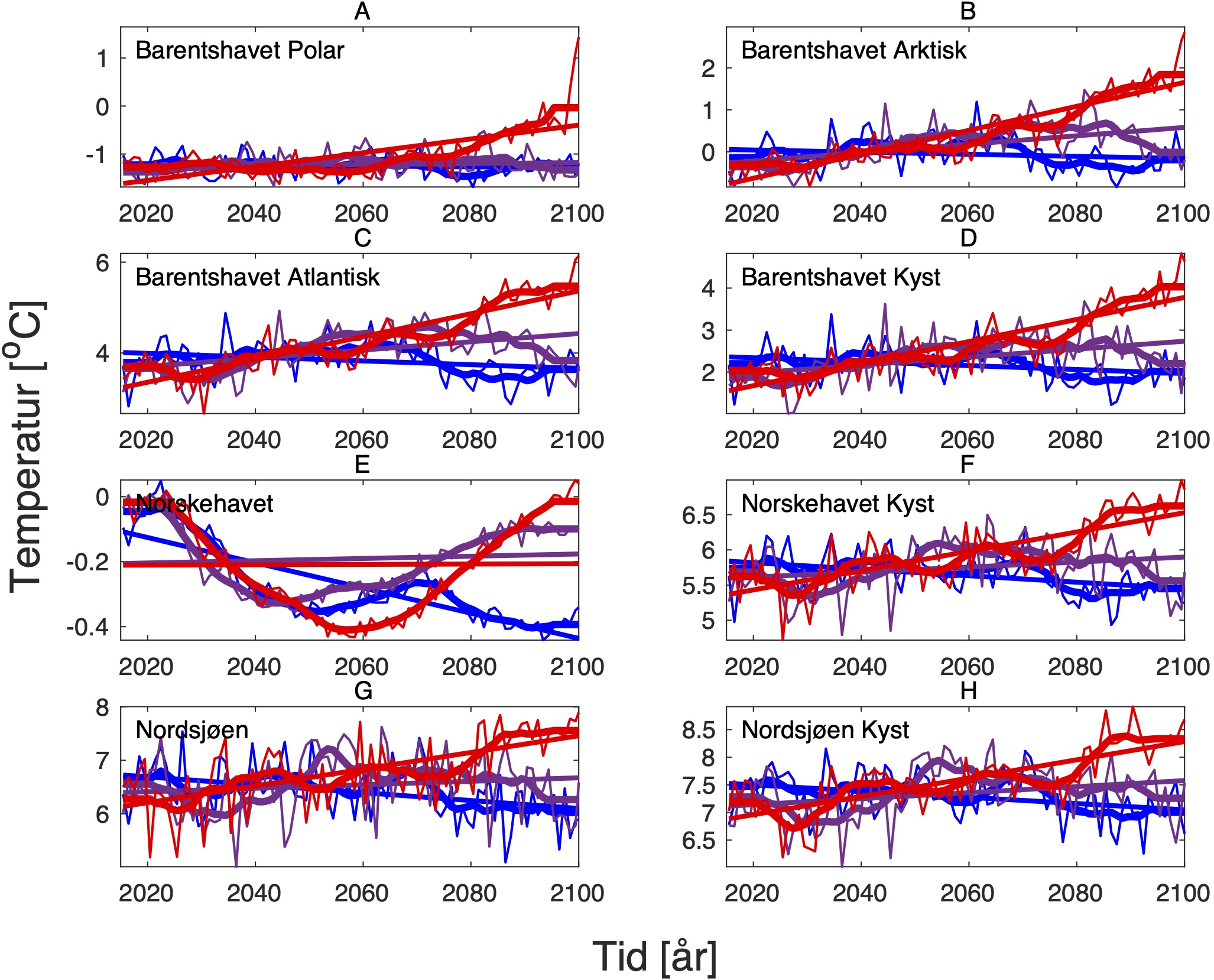
Både negative og positive trender dempes for det meste når fokus flyttes til kjernen av Atlanterhavsvannet på 100 m dybde, bortsett fra vannmasser i de isdekkede områdene (Barentshavet Arktisk) der trendene er ganske sterke sammenlignet med de på overflaten for alle tre scenariene. De romlige mønstrene til endringene i de forskjellige dybdene og for de tre scenariene er vist i Figur 14.
4.3 - Oksygeninnhold og pH
Endringen i oksygeninnhold øker fra nær 0 i SSP1-2.6 til rundt -0.6 (ml l−1) i SSP5-8.5 i de nordligste områdene av Barentshavet (Tabell 8, Figur 10 og 15). Det samme gjelder for pH, men her er nedgangen på -0.3 (-) størst i de arktiske vannmassene lengst øst i Barentshavet (Tabell 9, Figur 11 og 15). På grunnlag av det vi vet om de kritiske oksygenmetningsverdiene for bestandene i denne analysen og de simulerte endringene i oksygeninnhold, så har vi i neste avsnitt jevnt over vektet retningseffektene for oksygen relativt svakt. Det samme gjelder for pH.
|
O2 |
Endring±SD |
||
|---|---|---|---|
|
|
SSP1-2.6 |
SSP2-4.5 |
SSP5-8.5 |
|
BS Pol |
0.0 ± 0.1 (8.0 - 8.0) |
-0.2 ± 0.1 (8.0 - 7.8) |
-0.6 ± 0.2 (8.1 - 7.6) |
|
BS Ark |
0.0 ± 0.1 (7.5 - 7.6) |
-0.3 ± 0.1 (7.6 - 7.4) |
-0.6 ± 0.2 (7.7 - 7.1) |
|
BS Atl |
0.1 ± 0.1 (6.7 - 6.7) |
-0.2 ± 0.1 (6.8 - 6.6) |
-0.4 ± 0.1 (6.8 - 6.4) |
|
BS K |
0.0 ± 0.1 (6.5 - 6.5) |
-0.2 ± 0.1 (6.6 - 6.4) |
-0.3 ± 0.1 (6.6 - 6.2) |
|
NH |
-0.0 ± 0.1 (6.8 - 6.8) |
-0.2 ± 0.1 (6.9 - 6.7) |
-0.3 ± 0.1 (6.9 - 6.6) |
|
NH K |
0.0 ± 0.1 (5.8 - 5.9) |
-0.1 ± 0.1 (5.9 - 5.8) |
-0.3 ± 0.1 (6.0 - 5.7) |
|
NS |
0.1 ± 0.1 (6.2 - 6.2) |
-0.1 ± 0.1 (6.2 - 6.2) |
-0.2 ± 0.1 (6.2 - 6.1) |
|
NS K |
0.0 ± 0.1 (5.9 - 5.9) |
-0.1 ± 0.1 (5.9 - 5.8) |
-0.3 ± 0.1 (6.0 - 5.7) |
|
pH |
Endring±SD |
||
|---|---|---|---|
|
|
SSP1-2.6 |
SSP2-4.5 |
SSP5-8.5 |
|
BS Pol |
0.0 ± 0.0 (8.2 - 8.2) |
-0.1 ± 0.0 (8.2 - 8.1) |
-0.2 ± 0.1 (8.2 - 8.0) |
|
BS Ark |
0.0 ± 0.0 (8.1 - 8.2) |
-0.1 ± 0.0 (8.1 - 8.1) |
-0.3 ± 0.1 (8.2 - 7.9) |
|
BS Atl |
0.0 ± 0.0 (8.1 - 8.2) |
-0.1 ± 0.0 (8.1 - 8.1) |
-0.2 ± 0.1 (8.2 - 8.0) |
|
BS K |
0.0 ± 0.0 (8.1 - 8.1) |
-0.1 ± 0.0 (8.1 - 8.0) |
-0.2 ± 0.1 (8.1 - 7.9) |
|
NH |
0.0 ± 0.0 (8.1 - 8.2) |
-0.0 ± 0.0 (8.1 - 8.1) |
-0.1 ± 0.0 (8.2 - 8.0) |
|
NH K |
0.0 ± 0.0 (8.0 - 8.1) |
-0.0 ± 0.0 (8.0 - 8.0) |
-0.2 ± 0.1 (8.1 - 7.9) |
|
NS |
0.0 ± 0.0 (8.1 - 8.1) |
-0.0 ± 0.0 (8.1 - 8.0) |
-0.1 ± 0.0 (8.1 - 8.0) |
|
NS K |
0.0 ± 0.0 (8.1 - 8.1) |
-0.1 ± 0.0 (8.1 - 8.0) |
-0.2 ±0.0 (8.1 - 7.9) |
4.4 - Netto primær produksjon (NPP) og gross sekundærproduksjon (GSP)
NPP-trendene i Barentshavet Polar og Arktis øker fra SSP1-2.6 til SSP5-8.5, mens trendene i Nordsjøen er negative, spesielt i SSP5-8.5 (Tabell 10, Figur 12). De største endringene finner vi i de nordligste områdene hvor havisen trekker seg tilbake, og er spesielt tydelig i SSP5- 8.5-scenarioet med middelverdier på over 50 gCm−2 for Barentshavet Polar, og enda høyere i enkelte mindre områder innenfor disse (Figur 15).
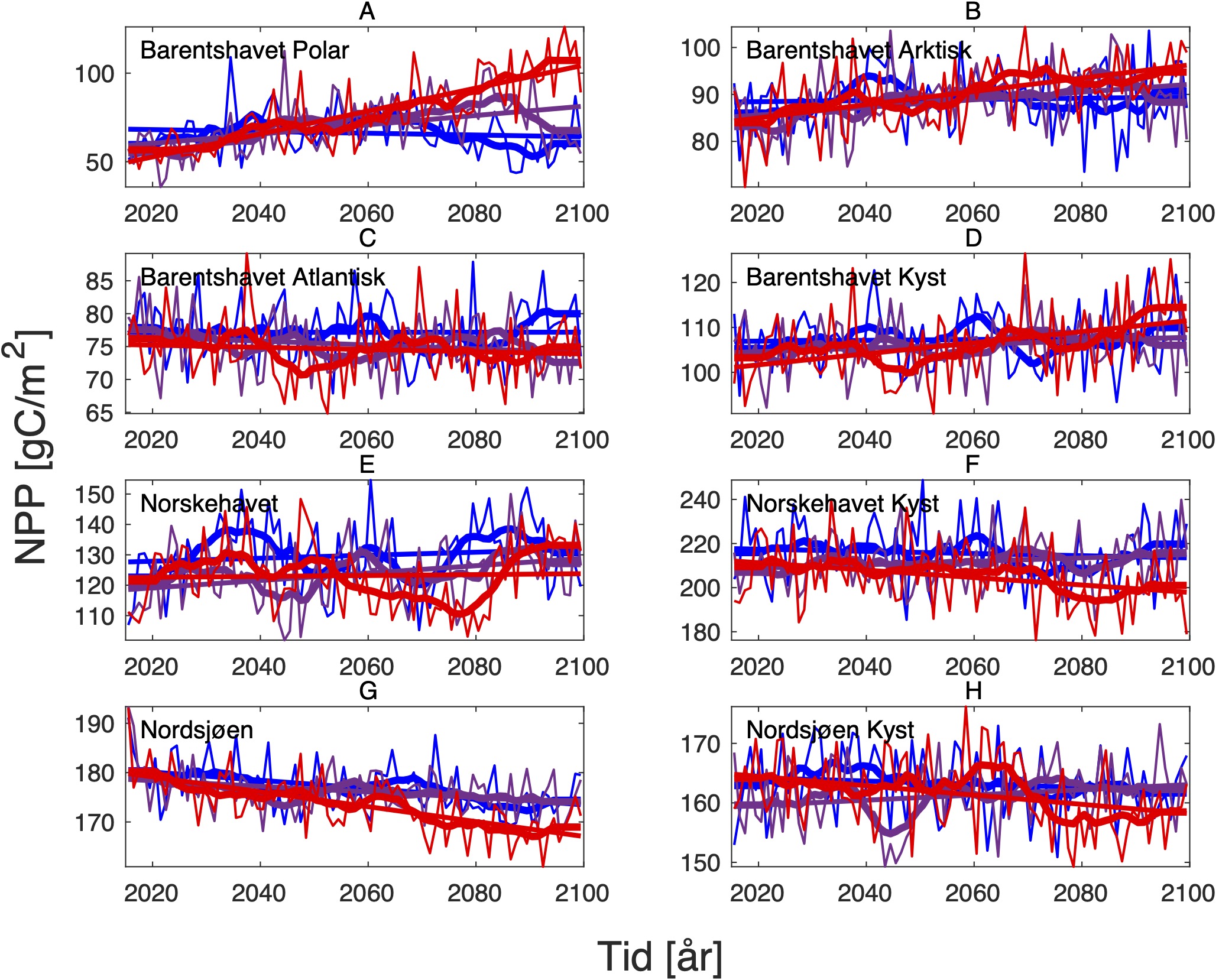
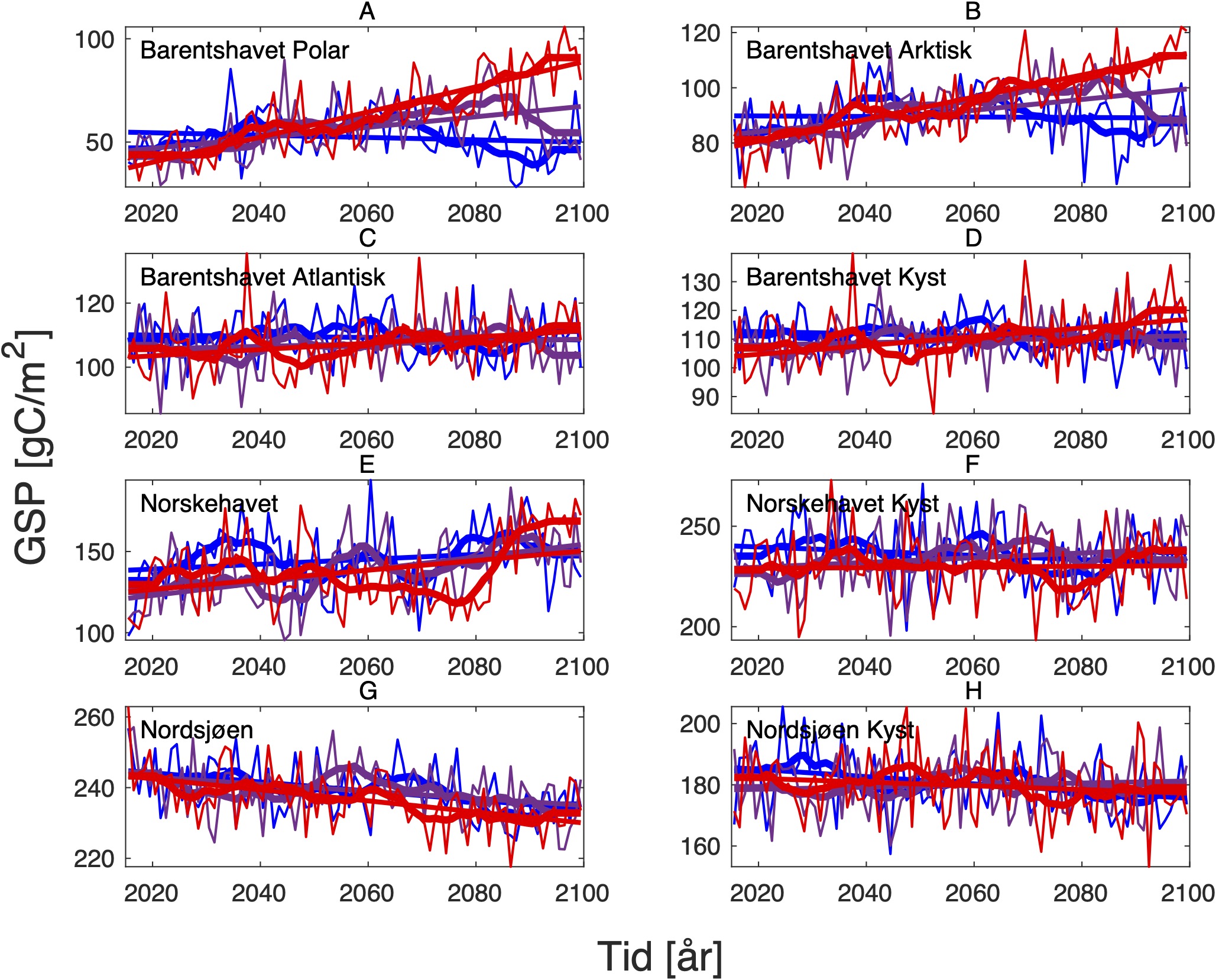
Det samme scenarioet har betydelige negativetrender i de sørlige regionene, og da spesielt i Nordsjøen (∼ -10 gCm−2). Trendene i GSP avspeiler i stor grad disse endringene i NPP (Tabell 11, Figur 13 og Figur 15).
|
NPP |
Endring ±SD |
||
|---|---|---|---|
|
|
SSP1-2.6 |
SSP2-4.5 |
SSP5-8.5 |
|
BS Pol |
-4.3 ± 12.1 (68.4 - 64.1) |
22.0 ± 14.9 (59.2 - 81.2) |
54.3 ± 19.8 (49.8 - 104.2)) |
|
BS Ark |
1.0 ± 6.5 (88.4 - 89.4) |
6.9 ± 6.2 (85.2 - 92.1) |
11.9 ± 6.7 (84.4 - 96.2) |
|
BS Atl |
0.0 ± 4.5 (77.1 - 77.2) |
-2.5 ± 4.2 (76.5 - 74.1) |
-1.4 ± 4.6 (75.3 - 73.9) |
|
BS K |
0.8 ± 6.4 (106.9 - 107.7) |
3.4 ± 5.8 (104.4 - 107.8) |
10.3 ± 7.6 (101.1 - 111.5) |
|
NH |
4.2 ± 11.0 (127.7 - 131.8) |
10.2 ± 10.2 (118.6 - 128.8) |
1.2 ±10.8 (122.5 - 123.8) |
|
NH K |
-4.2 ± 13.1 (217.7 - 213.5) |
6.5 ± 11.3 (208.5 - 215.0) |
-14.1 ± 14.2 (212.1 - 197.9) |
|
NS |
-7.0 ± 4.8 (180.5 - 173.5) |
-4.8 ± 4.4 (178.6 - 173.8) |
-12.7 ± 5.7 (179.8 - 167.1) |
|
NS K |
-2.2 ± 5.3 (164.3 - 162.1) |
3.7 ±5.1 (159.4 - 163.1) |
-6.6 ± 6.1 (164.8 - 158.2) |
|
GSP |
Endring ±SD |
||
|---|---|---|---|
|
|
SSP1-2.6 |
SSP2-4.5 |
SSP5-8.5 |
|
BS Pol |
-4.8 ± 11.2 (54.8 - 50.0) |
21.4 ± 13.3 (45.8 - 67.2) |
51.1 ± 18.0 (37.5 - 88.6) |
|
BS Ark |
-0.8 ± 9.3 (89.8 - 89.0) |
16.4 ± 10.3 (83.2 - 99.6) |
33.6 ± 12.8 (78.8 - 112.4) |
|
BS Atl |
-1.6 ± 7.4 (110.1 - 108.5) |
3.1 ± 7.6 (105.6 - 108.7) |
8.2 ± 8.5 (103.1 - 111.3) |
|
BS K |
-3.2 ± 7.3 (112.8 - 109.6) |
3.4 ± 7.8 (107.7 - 111.2) |
12.8 ± 10.2 (104.0 - 116.8) |
|
NH |
12.6 ± 19.4 (138.5 - 151.1) |
33.1 ± 20.3 (121.2 - 154.2) |
25.0 ± 21.9 (125.3 - 150.2) |
|
NH K |
-8.9 ±14.9 (240.2 - 231.3) |
9.9 ± 15.1 (229.1 - 239.0) |
1.4 ± 15.7 (229.0 - 230.4) |
|
NS |
-10.8 ± 7.4 (244.8 - 233.9) |
-8.4 ± 7.5 (243.4 - 235.0) |
-13.1 ± 7.8 (243.2 - 230.1) |
|
NS K |
-10.0 ± 9.9 (185.6 - 175.6) |
2.8 ± 9.0 (178.4 - 181.2) |
-5.1 ± 10.8 (182.4 - 177.3) |
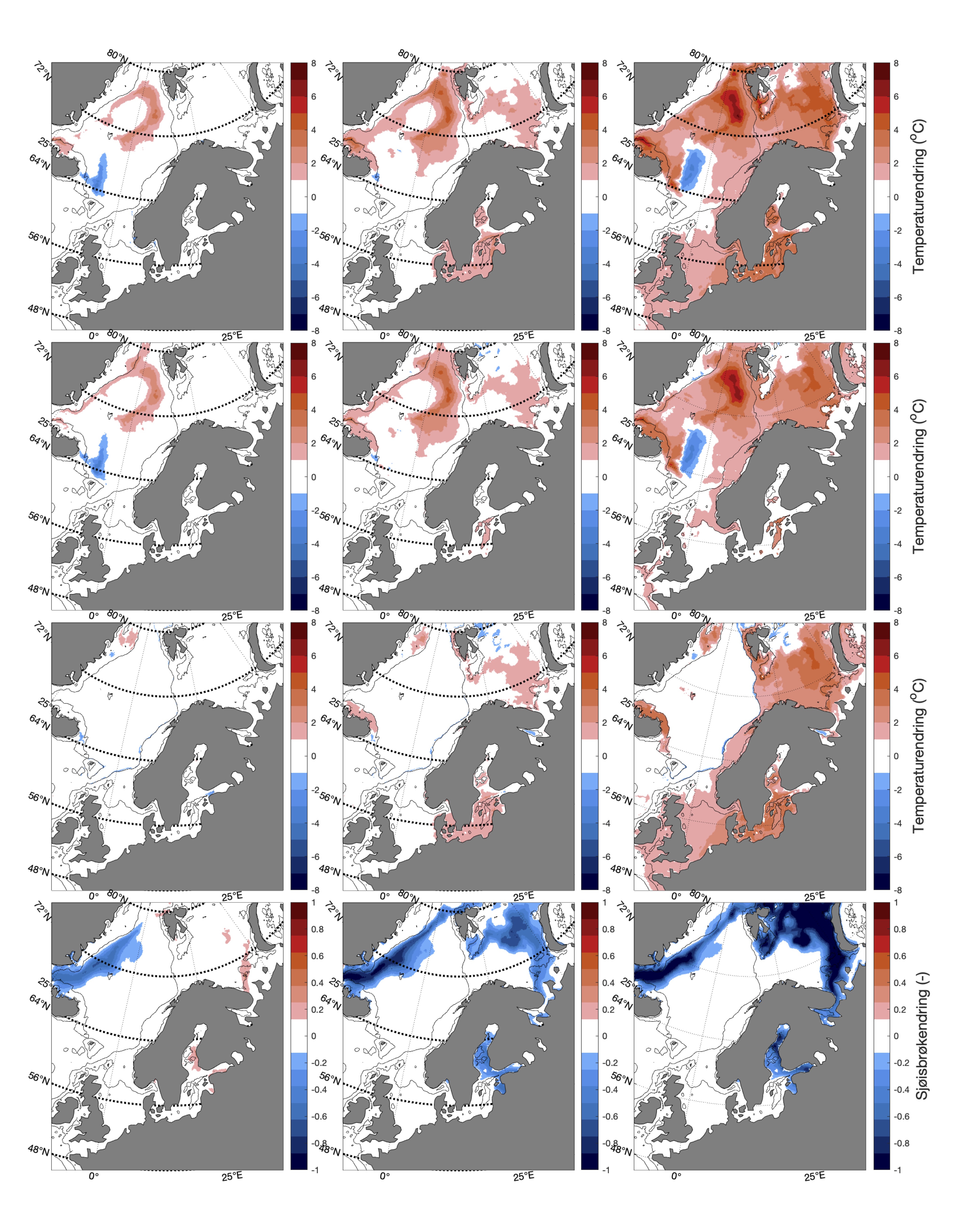
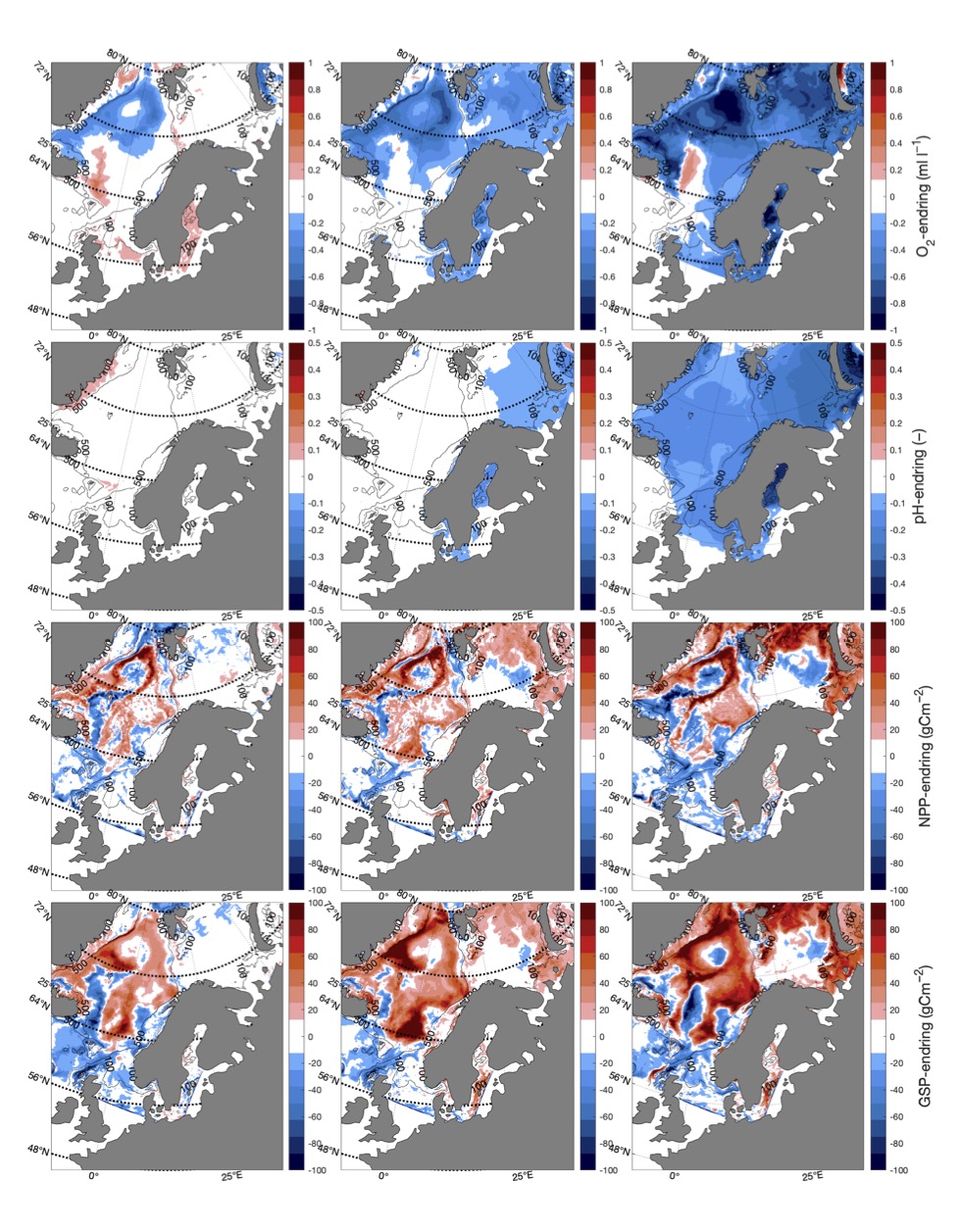
4.5 - Analyse av klimaeksponeringer og retningseffekter for utvalgte bestander i Nordsjøen, Norskehavet og Barentshavet
Basert på modellerte verdier i år 2100 (Tabell 1-11) og informasjon om ulike sensitivitetsattributter beskrevet i Seksjon 3.5 og 3.6, har vi i det følgende beregnet de akkumulerte retningseffektene for hver enkelt bestand. Dette gjøres ved først å vekte de ulike klimapåvirkningene i de tre scenariene på en skala fra 1 til 10. Deretter blir disse vektene gitt en positiv, nøytral eller negativ verdi ettersom hvordan bestanden forventes å bli påvirket i et endret klima. Til slutt blir disse tallene summert til en akkumulert retningseffekt.
4.5.1 - Nordlig lysing (Lysing i Nordsjøen)
For nordlig lysing har vi lagt mest vekt på bunntemperatur. Denne gir negativ retningseffekt i SSP1-2.6 og positive effekter i SSP2-4.5 og SSP5-8.5 ettersom nordlig lysing har en optimal veksthastighet som er høyere enn den man finner i Nordsjøen i dag (Tabell 12). På tross av at sekundærprodukjonen ser ut til å bli noe redusert i alle scenarier regner vi med at stigende temperatur i SSP2-4.5 og SSP5-8.5 vil veie opp for dette (Tabell 12).
|
Nordlig lysing |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 100 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 1000 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Bunntemperatur |
3 |
-1 |
3 |
0 |
7 |
1 |
|
O2 (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
0 |
|
pH (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
0 |
|
Netto primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Gross primærproduksjon |
2 |
-1 |
2 |
-1 |
2 |
-1 |
|
Sjøiskonsentrasjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Akkumulert retningseffekt |
|
-5,0 |
|
-2.0 |
|
5,0 |
4.5.2 - Nordsjøsild
Tabell 13 viser at nordsjøsild er godt innenfor temperaturtålegrensen i alle scenarier, men nærmere øvre tålegrense SSP5.8.5 enn i SSP2-4.5. Negativ trend i GSP i alle scenarier, vil påvirke nordsjøsild negativt. Bestanden som helhet er ikke truet, men de sørligste bestandene kan komme til å slite. En samlet vurdering av retningseffektene viser likevel at nordsjøsild vil bli mindre negativt påvirket enn f.eks. nordsjøtorsk (Tabell 14).
|
Nordsjøsild |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 100 m |
2 |
1 |
1 |
0 |
3 |
-1 |
|
Temperatur 1000 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Bunntemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
O2 (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
-1 |
|
pH (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
0 |
|
Netto primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Gross primærproduksjon |
2 |
-1 |
2 |
-1 |
2 |
-1 |
|
Sjøiskonsentrasjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Akkumulert retningseffekt |
|
0,0 |
|
-2,0 |
|
-6,0 |
4.5.3 - Nordsjøtorsk
I Tabell 14 har vi lagt stor vekt på temperatur i beitehabitatet på 100 m, samt kritisk temperatur for modning av egg og gyting i november. Denne er svært nær tålegrensen for modning av gonader i alle scenarier, og spesielt i SSP5-8.5 hvor temperaturen er over 10.5 oC. Rikelig tilgang på GSP, og da spesielt raudåte, er også viktig for de tidlige livsstadier. Basert på trendene i temperatur og raudåte forventer vi derfor en sterk nedgang i nordsjøtorsk i SSP2-4.5 og SSP5-8.5. Enkelte studier konkluderer med at forsuring relatert til SSP5-8.5 kan gi økt dødelighet på torskelarver, og vi har derfor gitt pH en økt negativ effekt i SSP2-4.5 og SSP5-8.5 i forhold til SSP1-2.6.
|
Nordsjøtorsk |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 100 m |
8 |
1 |
1 |
0 |
10 |
-1 |
|
Temperatur 1000 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Bunntemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
O2 (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
-1 |
|
pH (intermediære vannmasser) |
1 |
0 |
1 |
-1 |
3 |
-1 |
|
Netto primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Gross primærproduksjon |
2 |
-1 |
4 |
-1 |
6 |
-1 |
|
Sjøiskonsentrasjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Akkumulert retningseffekt |
|
6,0 |
|
-5,0 |
|
-20,0 |
4.5.4 - Raudåte i Nordsjøen
Tabell 15 oppsummerer vurderingene. For klimaeksponering er det utført justeringer mellom scenarioene for temperatur, NPP og GSP. I Nordsjøen vurderer vi raudåte til å være mest påvirket av overflatetemperatur og NPP, og noe mindre av bunntempertur (ved overvintring). Trendene i disse variablene tilsier derfor reduksjon i raudåte i alle scenarier.
|
Raudåte i Nordsjøen |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
1 |
1 |
3 |
-1 |
5 |
-1 |
|
Temperatur 100 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 1000 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Bunntemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
O2 (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
-1 |
|
pH (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
0 |
|
Netto primærproduksjon |
3 |
-1 |
2 |
-1 |
6 |
-1 |
|
Gross primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Sjøiskonsentrasjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Akkumulert retningseffekt |
|
-2,0 |
|
-5,0 |
|
-12,0 |
4.5.5 - Lysing langs norskekysten
Som for nordlig lysing (Tabell 12) har vi også her lagt mest vekt på bunntemperatur, altså en negativ retningseffekt i SSP1-2.6 og positive effekter i SSP2-4.5 og SSP5-8.5 (Tabell 16). Til forskjell fra habitatet til nordlig lysing er habitatet til lysing langs norskekysten preget av en oppgang i GSP i SSP2-4.5 og SSP5-8.5, og de akkumulerte retningseffektene vil derfor være mer positiv. Lysing har derfor et stort utviklingspotensiale nordover i Norskehavet, men mye av usikkerheten ligger i om den kan gyte nord for kritisk breddegrad (64-66o N).
|
Lysing langs norskekysten |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 100 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 1000 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Bunntemperatur |
3 |
-1 |
3 |
1 |
7 |
1 |
|
O2 (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
0 |
|
pH (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
0 |
|
Netto primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Gross primærproduksjon |
2 |
-1 |
2 |
1 |
3 |
1 |
|
Sjøiskonsentrasjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Akkumulert retningseffekt |
|
-5,0 |
|
5,0 |
|
10,0 |
4.5.6 - Raudåte i Norskehavet
Overflatetemperatur og NPP er, som for raudåte i Nordsjøen, vurdert å være de viktigste faktorene for raudåte i Norskehavet. Den vil være innenfor det akseptable temperaturintervallet for alle scenarioer. Om vinteren befinner arten seg i dypet og også innenfor temperaturintervallet. Tabell 17 oppsummerer vurderingene og gir negativ akkumulert retningseffekt for SSP1-2.6, og positive effekter for SSP2-4.5 og SSP5-8.5.
|
Raudåte i Norskehavet |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
1 |
-1 |
3 |
1 |
4 |
1 |
|
Temperatur 100 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 1000 m |
1 |
0 |
1 |
0 |
0 |
0 |
|
Bunntemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
O2 (intermediære vannmasser) |
1 |
0 |
1 |
-1 |
1 |
-1 |
|
pH (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
0 |
|
Netto primærproduksjon |
1 |
0 |
1 |
1 |
1 |
0 |
|
Gross primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Sjøiskonsentrasjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Akkumulert retningseffekt |
|
-1,0 |
|
3,0 |
|
3,0 |
4.5.7 - Nordøstatlantisk makrell
Makrell er en byttedyrsgeneralist og vil trolig kunne utvide sitt habitat nordover i takt med temperaturøkningene. Tabell 18 oppsummerer retningseffektene. Bestanden er godt innenfor tålegrensen for temperatur på 100 m i alle scenarier, men har såpass høy foretrukket temperatur at det vil være en spesielt positiv retningseffekt fra temperatur i de scenariene der denne stiger (SSP2-4.5 og SSP5-8.5).
|
Nordøstatlantisk makrell |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 100 m |
2 |
-1 |
4 |
1 |
7 |
1 |
|
Temperatur 1000 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Bunntemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
O2 (intermediære vannmasser) |
2 |
0 |
2 |
-1 |
2 |
-1 |
|
pH (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
0 |
|
Netto primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Gross primærproduksjon |
1 |
0 |
5 |
1 |
5 |
1 |
|
Sjøiskonsentrasjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Akkumulert retningseffekt |
|
-2,0 |
|
7,0 |
|
10,0 |
4.5.8 - Norsk vårgytende sild
Tabell 19 oppsummerer retningseffektene. Bestanden er godt innenfor tålegrensen for temperatur på 100 m i alle scenarier. En økning i GSP i alle scenarier, spesielt SSP2-4.5 og SSP5-8.5 vil virke positivt.
|
Norsk vårgytende sild |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 100 m |
1 |
-1 |
3 |
1 |
3 |
1 |
|
Temperatur 1000 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Bunntemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
O2 (intermediære vannmasser) |
1 |
0 |
1 |
-1 |
1 |
-1 |
|
pH (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
0 |
|
Netto primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Gross primærproduksjon |
1 |
0 |
5 |
1 |
5 |
1 |
|
Sjøiskonsentrasjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Akkumulert retningseffekt |
|
-1,0 |
|
7,0 |
|
7,0 |
4.5.9 - Nordøstarktisk torsk
Temperaturforholdene for moding av gonader i området som dekker kysten i Norskehavet kan bli for høye i SSP5-8.5, men inkluderer vi kysten i Barentshavet, så er man godt innenfor de foretrukne temperaturintervallene i alle scenariene. For beiting i Barentshavet utgjør de økte temperaturene heller ingen begrensning i noen av scenariene. I motsetning til nordsjøtorsk vil nordøstarktisk torsk ha fordel av økende temperatur da dagens temperatur i de nordligste delene av Barentshavet ligger godt under optimal temperatur.
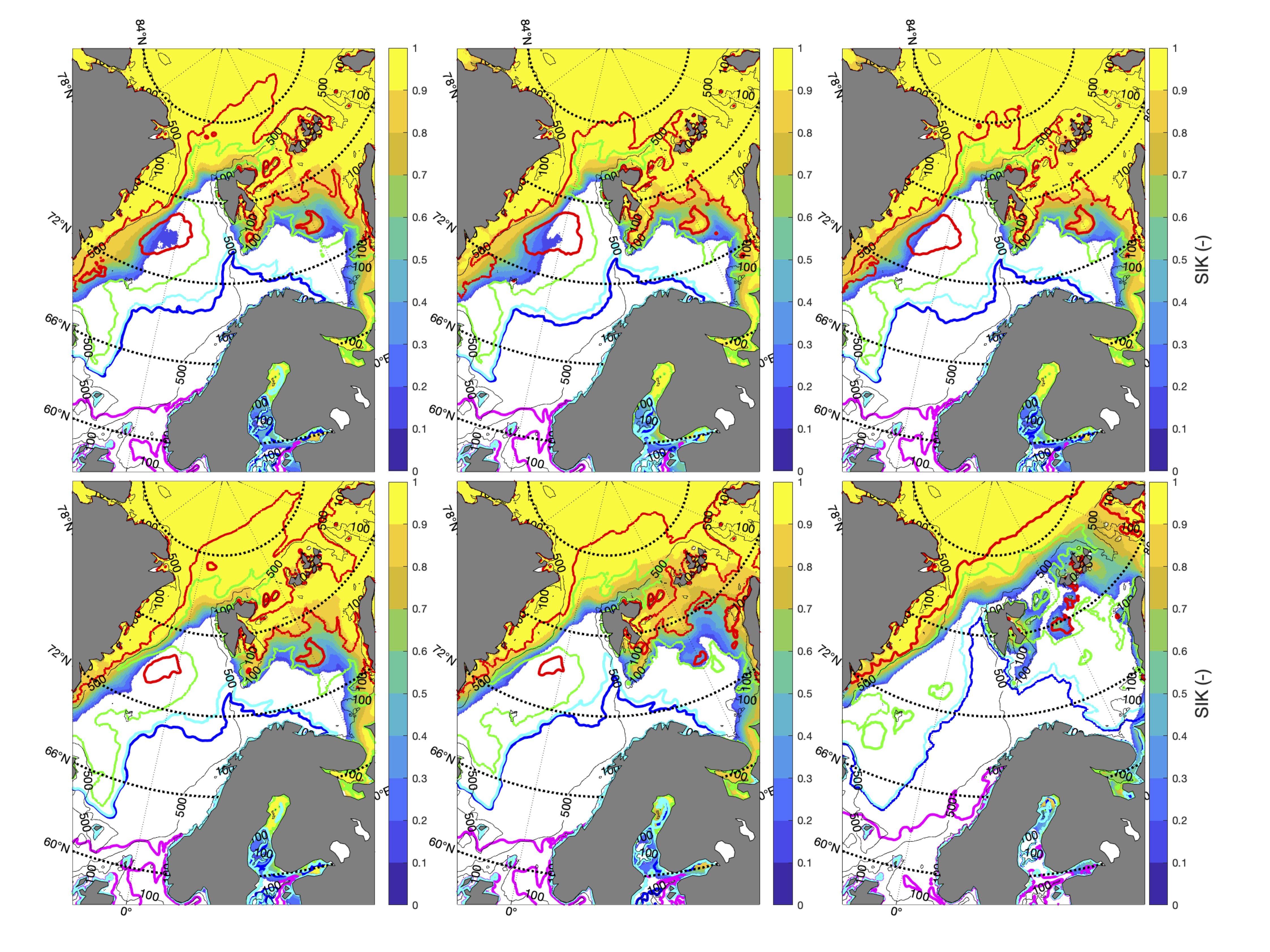
Med økende temperatur vil også isen trekke nordover (Figur 16), noe som vil resultere i økt primær- og sekundærproduksjon. Da enkelte studier konkluderer med at utslipp av drivhussgasser kan gi økt dødelighet på torskelarver har vi gitt pH en økt negativ effekt i SSP2-4.5 og SSP5-8.5 i forhold til SSP1-2.6. De aktuelle klimaeksponeringene med tilhørende retningseffekter er oppsummert i Tabell 20.
|
Nordøstarktisk torsk |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 100 m |
1 |
-1 |
3 |
1 |
7 |
1 |
|
Temperatur 1000 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Bunntemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
O2 (intermediære vannmasser) |
1 |
0 |
1 |
-1 |
1 |
-1 |
|
pH (intermediære vannmasser) |
1 |
0 |
2 |
-1 |
3 |
-1 |
|
Netto primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Gross primærproduksjon |
1 |
-1 |
4 |
1 |
9 |
1 |
|
Sjøiskonsentrasjon |
1 |
0 |
4 |
1 |
8 |
1 |
|
Akkumulert retningseffekt |
|
-2,0 |
|
8,0 |
|
20,0 |
4.5.10 - Raudåte i Barentshavet
Tabell 21 oppsummerer vurderingene. Som allerede nevnt vil økende temperatur bidra til at iskanten forflyttes nordover (Figur 16), og primærproduksjonen vil øke til fordel for raudåte i de nordligste delene av Barentshavet i både SSP2-4.5 og SSP5-8.5.
|
Raudåte i Barentshavet |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
1 |
1 |
3 |
1 |
7 |
1 |
|
Temperatur 100 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 1000 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Bunntemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
O2 (intermediære vannmasser) |
1 |
0 |
1 |
-1 |
1 |
-1 |
|
pH (intermediære vannmasser) |
1 |
0 |
1 |
0 |
1 |
0 |
|
Netto primærproduksjon |
1 |
-1 |
4 |
1 |
9 |
1 |
|
Gross primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Sjøiskonsentrasjon |
1 |
0 |
4 |
1 |
8 |
1 |
|
Akkumulert retningseffekt |
|
0,0 |
|
10,0 |
|
23,0 |
4.5.11 - Lodde i Barenthavet
Alle scenariene tilfredsstiller temperaturer for modning i den arktiske delen av Barentshavet, gyting langs kysten i den sørlige delen av Barentshavet, samt beiting mellom arktiske og atlantiske vannmasser. Bestanden vil trolig dra nytte av en sterk økning i GSP i det nordlige Barentshavet og da spesielt i SSP5-8.5. De aktuelle klimaeksponeringene med tilhørende retningseffekter er oppsummert i Tabell 22.
|
Lodde i Barentshavet |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 100 m |
1 |
-1 |
3 |
1 |
7 |
1 |
|
Temperatur 1000 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Bunntemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
O2 (intermediære vannmasser) |
1 |
0 |
1 |
-1 |
1 |
-1 |
|
pH (intermediære vannmasser) |
1 |
0 |
1 |
-1 |
1 |
-1 |
|
Netto primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Gross primærproduksjon |
1 |
-1 |
4 |
1 |
9 |
1 |
|
Sjøiskonsentrasjon |
1 |
0 |
4 |
1 |
8 |
-1 |
|
Akkumulert retningseffekt |
|
-2,0 |
|
9,0 |
|
6,0 |
4.5.12 - Snøkrabbe
Figur 17 viser at snøkrabbe er innenfor foretrukket temperaturintervall i hele Barentshavet for alle scenariene. Ettersom snøkrabben er en generalist, vil den trolig dra nytte av en økning i GSP, ved at økt dyreplankton kan bidra til mer mat til bunnlevende organismer, som igjen vil føre til økt mattilgang for snøkrabben. De aktuelle klimaeksponeringene med tilhørende retningseffekter er oppsummert i Tabell 23.
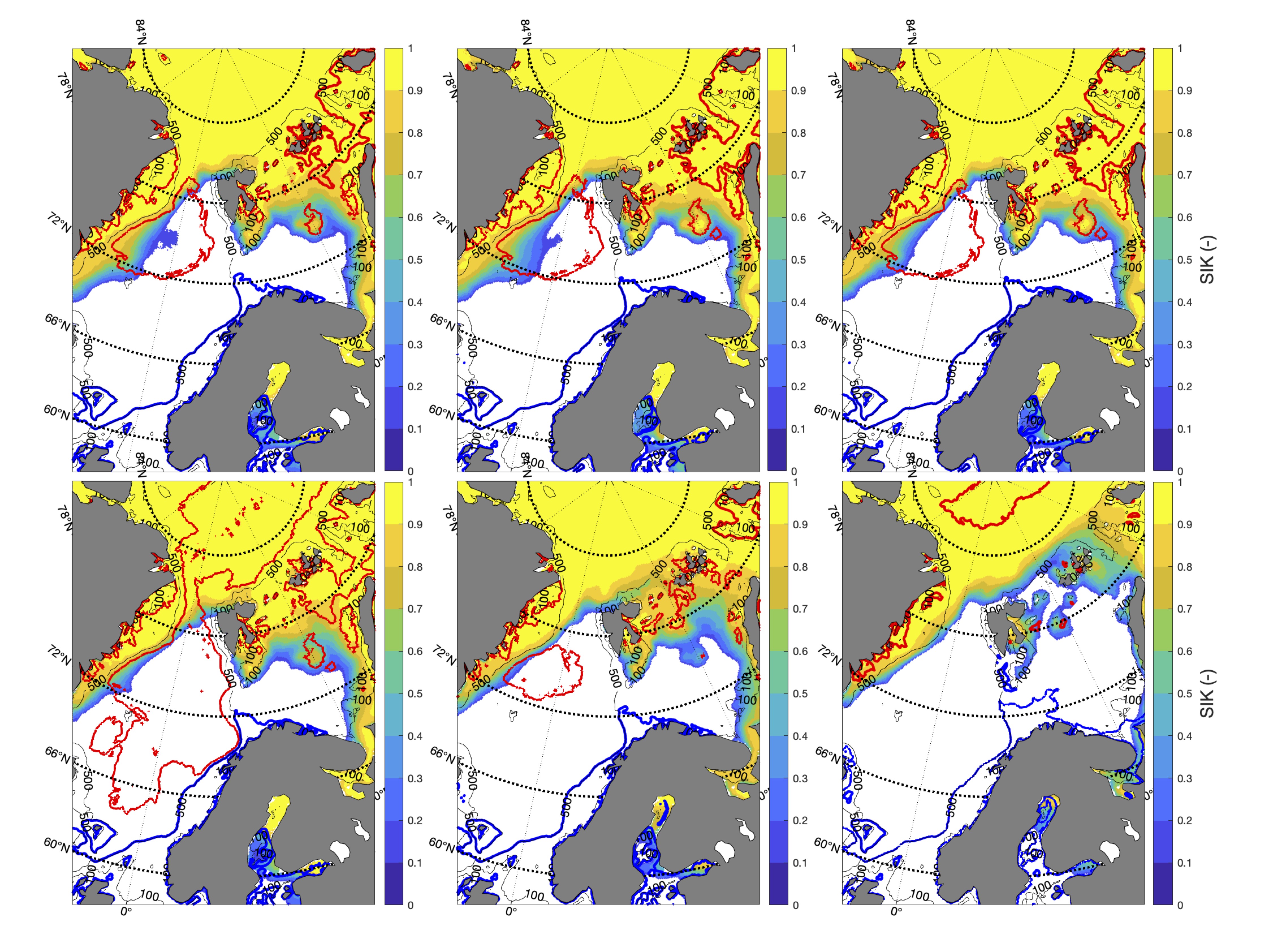
|
Snøkrabbe |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 100 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 1000 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Bunntemperatur |
1 |
-1 |
1 |
1 |
3 |
1 |
|
O2 (intermediære vannmasser) |
1 |
0 |
1 |
-1 |
1 |
-1 |
|
pH (intermediære vannmasser) |
1 |
0 |
1 |
-1 |
1 |
-1 |
|
Netto primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Gross primærproduksjon |
1 |
-1 |
4 |
1 |
9 |
1 |
|
Sjøiskonsentrasjon |
1 |
0 |
1 |
0 |
1 |
0 |
|
Akkumulert retningseffekt |
|
-2,0 |
|
3,0 |
|
10,0 |
4.5.13 - Polartorsk
Polartorsk gyter under isen i perioden desember-mars og isen beskytter eggene mot predasjon. Et redusert isdekke som følge av et varmere klima vil derfor endre sårbarheten under de tidlige livsstadiene. Tabell 24 oppsummerer vurderingene for polartorsk. I SSP2-4.5 blir selve iskanten i Barentshavet lengre, mens isdekket blir mindre (Figur 16). Hvordan dette vil påvirke polartorsken er høyst usikkert. I SSP5-8.5 er så og si hele isdekket med tilhørende iskant borte i slutten av dette århundret (Figur 9), noe som regnes som svært negativt. I motsetning til hovedpredatoren, nordøstarktisk torsk, er polartorskens habitat ikke begrenset til kontinentalsokkelen. Om dette forflyttes lengre inn i Polhavet kan polartorsken dermed bli vanskeligere tilgjengelig som byttedyr for nordøstarktisk torsk. Oppvarmming kan gi negative konsekvenser for polartorskens arktiske byttedyr, men dette vil trolig kompenseres ved økning i boreale arter.
|
Polartorsk |
||||||
|---|---|---|---|---|---|---|
|
Scenario |
1-2.6 |
2-4.5 |
5-8.5 |
|||
|
Klimapåvirkning |
Vekt |
RE |
Vekt |
RE |
Vekt |
RE |
|
Overflatetemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
Temperatur 100 m |
1 |
1 |
1 |
0 |
1 |
-1 |
|
Temperatur 1000 m |
0 |
0 |
0 |
0 |
0 |
0 |
|
Bunntemperatur |
0 |
0 |
0 |
0 |
0 |
0 |
|
O2 (intermediære vannmasser) |
1 |
0 |
1 |
-1 |
1 |
-1 |
|
pH (intermediære vannmasser) |
1 |
0 |
1 |
-1 |
1 |
-1 |
|
Netto primærproduksjon |
0 |
0 |
0 |
0 |
0 |
0 |
|
Gross primærproduksjon |
1 |
-1 |
2 |
0 |
3 |
0 |
|
Sjøiskonsentrasjon |
2 |
0 |
3 |
1 |
9 |
-1 |
|
Akkumulert retningseffekt |
|
0,0 |
|
1,0 |
|
-12,0 |
4.6 - Effekter av høstningsregler
Fra de seks simuleringene som er kjørt med NoBa Atlantis, ser vi at for makrell og kolmule er det små forskjeller på grunn av temperatur alene. Høstningsreglene gir derimot en reduksjon i biomasse i bestandene på over 50 . Dette er forårsaket av at biomassenivå ved maksimal fiskeridødelighet er satt relativt lavt, slik at det høstes ved høye nivåer gjennom mesteparten av simuleringen (Figur 18).
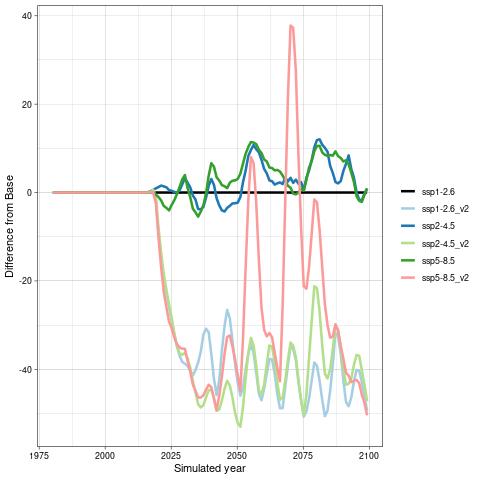
Sild har en svært vanskelig rekrutteringsfunksjon, med sterke årsklasser som kommer inn med 7-10 års mellomrom. Dette har ikke vært mulig å gjenskape i modellsystemet og vi har sett oss nødt til å inkludere de sterke årsklassene gjennom forcing av antall rekrutter, ved at vi ved tilfeldige år (8±2 år) forsterker rekrutteringen. Da forcingen av sterke årsklasser vil skje på forhåndsbestemte tidspunkt, vil kun utslaget variere mellom de tre klimascenariene (Figur 18). Det var større forskjeller mellom sildebiomassene da høstningsreglene ble benyttet, og da særlig i SSP5-8.5-scenariet, hvor svingingene i biomassen ble kraftigere. Da høstningsregelen benyttet er den samme for alle tre klimascenariene, er det temperaturpåvirkningen som gjennom rekruttering påvirker den totale silde-bestanden. Sildens rekrutteringsfunksjon er tett knyttet opp mot nivåer av plankton, og dermed indirekte også mot temperatur. (Figur 19).
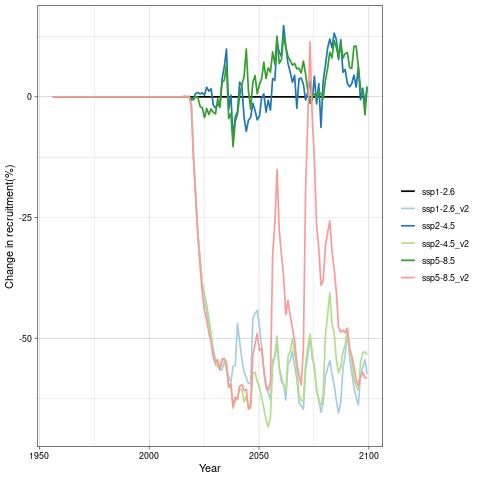
Ved bruk av høstningregler hadde sild generelt en lavere biomasse. Hverken makrell eller kolmule har tilsvarende variasjon. Dette skyldes blant annet forskjeller rekrutteringsfunksjon og at disse to bestandene ikke har tilsvarende forcing av sterke årsklasser. På grunn av størrelsen på NoBa Atlantis-polygonene, var det vanskelig å se endringer i utbredelser. Vi valgte dermed å regne på tyngdepunkt i biomasse. Sildens biomassetyngdepunkt flytter seg nordøstover (5 km) sammenlignet mellom SSP1-2.6 og SSP2-4.5, for de siste ti årene av simuleringene (2090-2100), og ytterligere 2.5 km lenger nordøst i SSP5-8.5. Hos makrell er det ikke tatt hensyn til om den eventuelt velger å være i området i lengre tidsperioder, slik at den fremdeles migrerer ut/inn og er tilstede i modellen kun for sommerbeite. Den viser ingen endring i sitt område, mens kolmule kun viser en svak nordøstlig endring i utbredelse (<1 km) sammenlignet med SSP1-2.6, mens forflytningen øker til 1.5 km nordøst i SSP5-8.5.
5 - Diskusjon
En risiko er sammensatt av sannsynlighet for at noe skal skje kombinert med konsekvensen av dette dersom det skjer. Dersom sannsynligheten er liten, men konsekvensen er stor blir også risikoen stor. I denne analysen representerer de ulike scenariene mulige utviklinger i ulike klimaeksponeringer. Metoden vi har brukt bygger på et publisert arbeid av Kjesbu et al. (2021), men vi har her utvidet RCP4.5-scenariet (SSP2-4.5) med to scenarier (2 oC-målet (SSP1-2.6) og business-as-usual (SSP5-8.5)), samt at fremskrivningene er forlenget med 30 år fram til år 2100. Å si noe om sannsynligheten for hvilket scenario som vil bli fulgt i fremtiden er vanskelig, så vi har derfor valgt å analysere disse tre scenariene som spenner utfallsrommet fra det mest beskjedne utslippsscenariet til det mest ekstreme av IPCCs scenarier (Meinshausen et al., 2020). For hvert scenario har vi så gjort en analyse av hvilke påvirkninger de ulike klimaeksponeringene vil ha på de ulike bestandene i Nordsjøen, Norskehavet og Barentshavet. Valg av klimapåvirkninger vi har brukt i denne analysen er basert på tilgjengelig kunnskap om hvordan disse påvirker de ulike artene. Med unntak av hvordan endringer i de fysiske variablene som salt og temperatur påvirker sirkulasjon og vertikale tetthetsgradienter, og deretter primær- og sekundærproduksjon, er det i denne analysen ingen modellert effekt av hvordan de ulike bestandene påvirker hverandre. Slike effekter har vi derfor prøvd å inkludere i den samlede ekspertvurderingen av hver enkelt bestand. Raudåte er et eksempel på en art som er svært viktig for ulike fiskebestander, og de akkumulerte retningseffektene for denne arten som byttedyr har derfor inngått i analysen av de aktuelle bestandene. Utover dette er det vanskelig å si så mye om artsinteraksjon basert på de tidsseriene vi opererer med her. Andre sensitivitetsattributter som habitabitatsspesifisitet, voksenmobilitet, gytesyklus, spredning av overlevelse ved tidlige livsstadier har som regel alltid vært en del av vurderingen ved vekting av klimaeksponeringene.
Akkumulert retningseffekt for alle bestandene og klimascenariene som er studert i denne analysen er vist i Figur 20, og de ulike bestandene er hovedsaklig sortert etter deres utbredelsesområde fra sør mot nord.
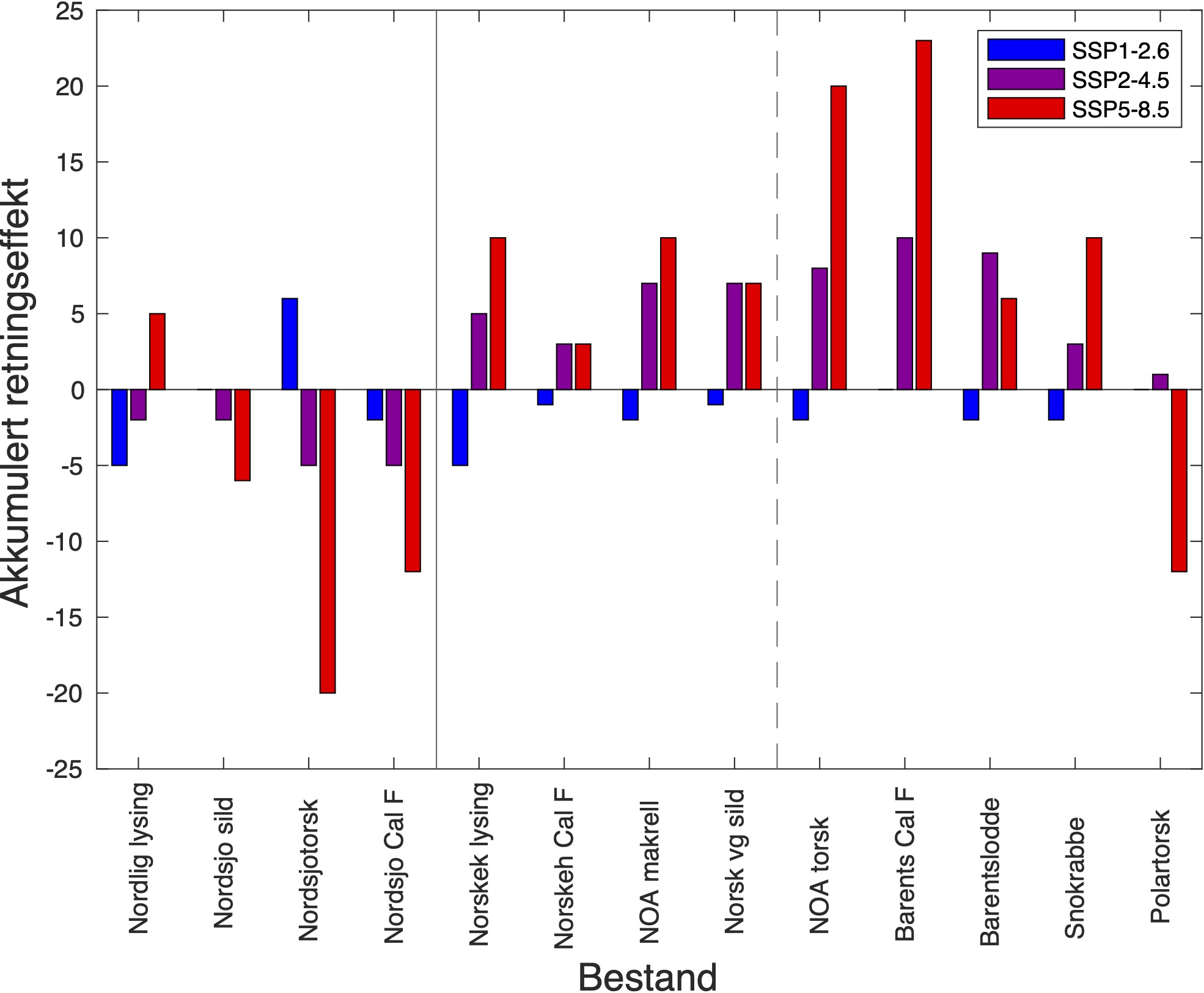
Vi finner at bestanden av den tempererte nordlige lysingen vil ha positiv effekt med økte klimagassutslipp. Andre bestander i Nordsjøen som nordsjøsild, nordsjøtorsk og raudåte ser derimot ut til å bli negativt påvirket, og da spesielt nordsjøtorsk. Den sterke negative effekten på torsk er relatert både til at temperatur i forbindelse med gonademodning og gyting stiger over den kritiske terskelverdi på 9.6 oC, og til at det er en forventet nedgang i sekundærproduksjon (Figur 15) og raudåte (basert på historiske sammenhenger til temperatur i Nordsjøen (Kjesbu et al.)). Merk at temperatureffektene illustrert i Figur 21 kan varierere mellom de ulike bestandene for samme havområde og samme scenario avhengig av hvilket dyp og hvilken sesong temperaturtrenden er hentet fra.
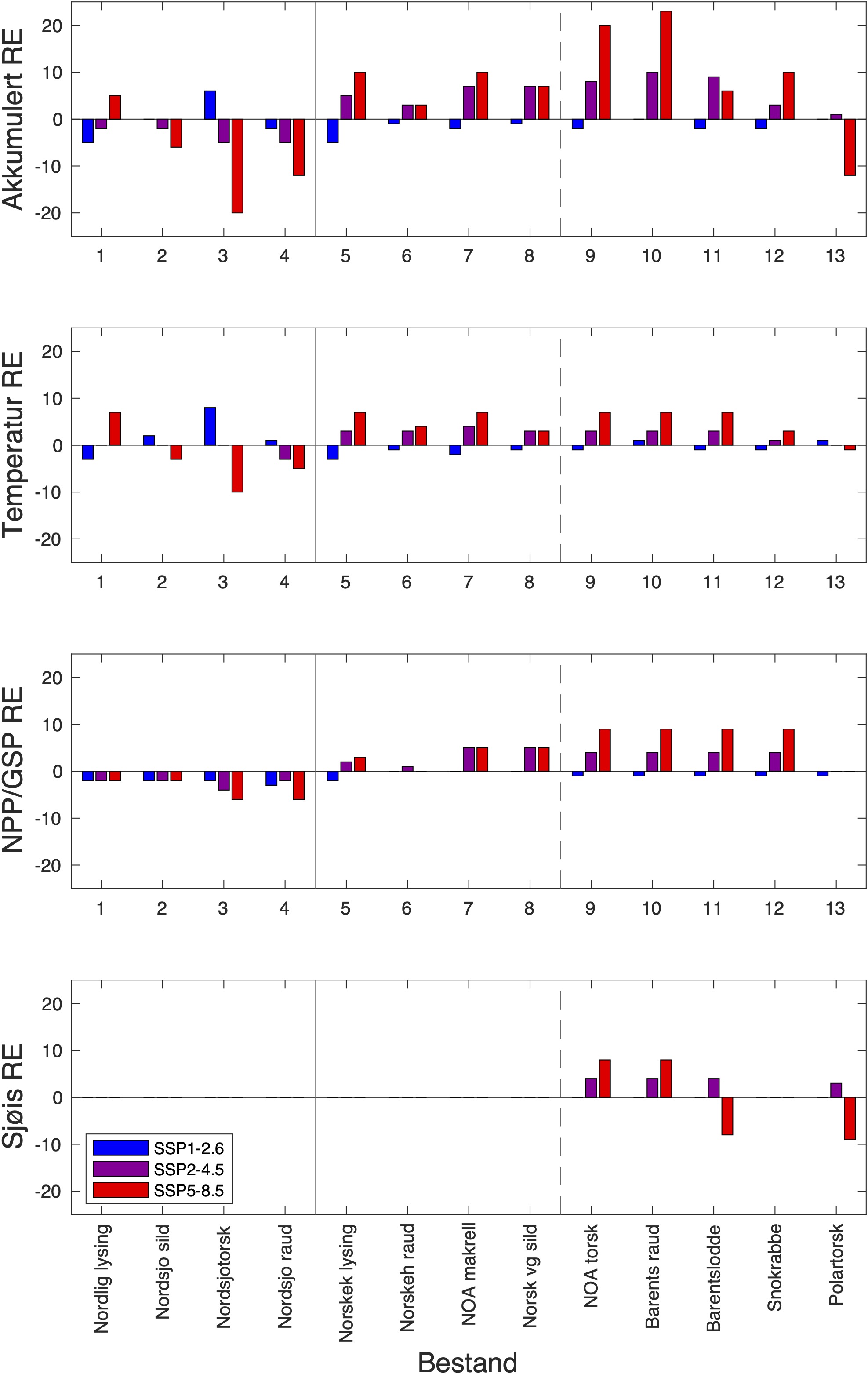
Når det gjelder bestandene i Norskehavet, så finner vi at både kystlysing, nordøstatlantisk makrell og norsk vårgytende sild alle drar nytte av klimaendringer med økte temperaturer. Dette baseres på at bestandene får økt utbredelse som følge av høyere temperaturer og større sekundærproduksjon Norskehavet som vist i Figur 14, 15 og 21, og dermed økt tilgang på mat. Tilsvarende viser Figur 21 at vi forventer at nordøstarktisk torsk i Barentshavet vil å øke sterkt med økende temperatur og økt sekundærproduksjon. Det spesielt sterke utslaget i dette havområdet henger sammen med at sjøisen smelter i takt med økt temperatur som i sin tur gir økt primær- og sekundærproduksjon i de samme områdene. Matfatet for nordøstarktisk torsk og andre boreale arter som raudåte blir med andre ord trolig større med økende temperatur. Bestander som er nærmere knyttet til iskanten i Barentshavet som lodde og polartorsk vi høyst trolig påvirkes negativt av at isen forsvinner i SSP5-8.5-scenariet (Figur 21). Deler av denne effekten vil motvirkes av økt primær- og sekundærproduksjon, og ettersom ingen av artene overstiger den øvre temperaturgrensen i de respektive habitatene vil heller ikke den direkte temperaturøkningen være spesielt negativ for noen av disse bestandene. Den eneste av de analyserte bestandene i Barentshavet som anatas å kunne bli svært negativt påvirket av økte klimagassutslipp og strålingspådrag er polartorsk. Den gyter under sjøisen og er sterkt knyttet til iskanten. Iskanten i SSP2-4.5-scenariet blir riktignok lenger enn i SSP1-2.6 (Figur 16) og vil på den måten kanskje ha en positiv effekt på den totale akkumulerte retningseffekten i SSP2-4.5 (Figur 21), men dette er høyst usikkert. Er polartorsk mer knyttet til selve isdekket, vil den få en negativ akkumulert retningseffekt også i SSP2-4.5.
Ettersom kunnskapen om hvordan de forskjellige klimaeksponeringene påvirker hver enkelt art er høyst variabel i omfang, er det en viss usikkerhet forbundet med denne form for analyse. For noen bestander, og da gjerne de økonomisk viktigste, har man relativt god detaljkunnskap om sensitivitetsattributtene, mens for andre er denne kunnskapen mer begrenset. I noen tilfeller vet man f.eks. mye om hvor temperatursensitiv bestanden er på grunnlag av detaljerte eksperimenter i laboratoriene, mens for andre bestander er de antatte temperaturgrensene i habitatet gjerne basert på omgivelsestemperaturen der bestanden er observert og trenger dermed ikke være absolutte. En annen kilde til usikkerhet er at kunnskapen om sensitivitetsattributter hovedsaklig er knyttet til dagens klima. I hvilken grad man kan bruke disse sammenhengene mellom klimaekponeringer og sensitivitetsattributter, og kombinasjoner av disse, i et fremtidig (og varmere) klima er derfor forbundet med noe usikkerhet. Kunnskapsgrunnlaget for hvor mye og hvordan ulike arter responderer på ytre påvirkninger vil endre seg med tiden, og denne analysen bør derfor gjentas når ny kunnskap blir tilgjengelig.
Endringer i bestandsstørrelsen vil sannsyligvis også utgjøre en betydelig usikkerhet i forhold til fremtidig utbredelse. Individer i en liten bestand vil nødig bevege seg lenger vekk fra sitt optimale habitat enn nødvendig, mens individer i en stor bestand vil trolig være nødt til spre seg utover et større område for å finne nok mat. Kun en bestands absolutte habitatgrenser vil derfor sette grenser for hvor langt en bestand kan forflytte seg, og disse grensene er ikke nøyaktig bestemt for alle bestander.
Manglende respons i en del bestander i NoBa til temperaturendringer skyldes blant annet størrelsen på NoBa Atlantis-polygonene. Dels fordi parametersettinger om hvor sensitive artene er til temperaturendringer har blitt endret for å kunne representere historiske tidsserier, dels fordi det til tross for at middeltemperaturen i polygonet kan være utenfor artens temperaturområde fremdeles kan være områder som er egnet for arten innenfor polygonet, noe modellen ikke har anledning til å ta høyde for. Det kreves en stor mengde simuleringer (Hansen et al., 2019b) for å kunne ta hensyn til usikkerhet knyttet til rekrutteringsfunksjoner, høstningsregler og temperatursensitivitet (inkludert funksjonell respons til temperaturer), noe vi ikke har hatt anledning til å gjøre innenfor dette prosjektet. Siden hvert av scenariene nå kun har en realisasjon, må disse resultatene sees på som svært usikre og foreløpige, og mer en indikasjon på hva NoBa Atlantis kan bidra med i klimarisikosammenheng.
6 - Konklusjon
Basert på modellerte endringer i fysiske og biogeokjemiske variable og kunnskap om 13 forskjellige bestanders habitater og respons til klimavariasjoner, har vi vektet klimapåvirkningene og retningene disse har i fremtidige klimascenarier. Resultatene viser at det er dagens bestander av sild, torsk, og raudåte i Nordsjøen og polartorsk i Barentshavet, altså de sørligste og nordligste delene av våre havområder, som vil bli mest negativt påvirket av klimaendringene. Bestander som kan migrere nordover og inn i våre havområder eller bestander som befinner seg nær midten av det foretrukne temperaturintervallet er de som er vinnerne i et varmere klima.
I denne analysen studerer vi ulike scenarier som gir tildels svært ulike konsekvenser. Det er utenfor vårt mandat å gå inn på hvilket scenario som er mest sannsynlig, men konkluderer med at det er følgene av SSP5-8-5-scenariet som for de aller fleste bestandene gir størst utslag, både i positiv og negativ retning.
7 - Referanser
Agnalt, A.-L., Grefsrud, E. S., Farestveit, E., Larsen, M., and Keulder, F. 2013. Deformities in larvae and juvenile European lobster (Homarus gammarus) exposed to lower ph at two different temperatures. Biogeosciences, 10: 7883–7895. URL https://bg.copernicus.org/articles/10/7883/2013/.
Aksnes, D., Ulvestad, K., Baliño, B., Berntsen, J., Egge, J., and Svendsen, E. 1995. Ecological modelling in coastal waters: Towards predictive physical-chemical-biological simulation models. Ophelia, 41: 5–36.
Aksnes, D. L. and Blindheim, J. 1996. Circulation patterns in the North Atlantic and possible impact on population dynamics of Calanus finmarchicus. Ophelia, 44: 7–28.
Alvarez, P., Fives, J., Motos, L., and Santos, M. 2004. Distribution and abundance of European hake Merluccius merluccius (L.), eggs and larvae in the North East Atlantic waters in 1995 and 1998 in relation to hydrographic conditions. Journal of Plankton Research, 26: 811–826. URL https://doi.org/10.1093/plankt/fbh074.
Bailey, A., Thor, P., Browman, H. I., Fields, D. M., Runge, J., Vermont, A., Bjelland, R., et al. 2016. Early life stages of the Arctic copepod Calanus glacialis are unaffected by increased seawater pCO2. ICES Journal of Marine Science, 74: 996–1004. URL https://doi.org/10.1093/icesjms/fsw066.
Bentsen, M., Bethke, I., Debernard, J. B., Iversen, T., Kirkevåg, A., Seland, Ø., Drange, H., et al. 2013. The Norwegian Earth System Model, NorESM1-M Part 1: Description and basic evaluation of the physical climate. Geoscientific Model Development, 6: 687–720. URL https://www.geosci-model-dev.net/6/687/2013/.
Björnsson, B., Steinarsson, A., and Oddgeirsson, M. 2001. Optimal temperature for growth and feed conversion of immature cod ( Gadus morhua L.) . ICES Journal of Marine Science, 58: 29–38. URL https://doi.org/10.1006/jmsc.2000.0986.
Bogstad, B., Haug, T., and Mehl, S. 2000. Who eats whom in the Barents Sea? NAMMCO Sci. Pubi., 2: 98–119.
Brander, K. M. 1994. The location and timing of cod spawning around the British Isles. ICES Journal of Marine Science, 51: 71–89. URL https://doi.org/10.1006/jmsc. 1994.1007.
Broms, C., Melle, W., and Horne, J. K. 2012. Navigation mechanisms of herring during feeding migration: the role of ecological gradients on an oceanic scale. Marine Biology Research, 8: 461–474. URL https://doi.org/10.1080/17451000.2011.640689.
Browman, H. I. 2016. Applying organized scepticism to ocean acidification research. ICES Journal of Marine Science, 73: 529–536. URL https://doi.org/10.1093/icesjms/ fsw010.
Brunel, T., van Damme, C. J. G., Samson, M., and Dickey-Collas, M. 2018. Quantifying the influence of geography and environment on the Northeast Atlantic mackerel spawning distribution. Fisheries Oceanography, 27: 159–173. URL https://onlinelibrary.wiley.com/doi/abs/10.1111/fog.12242.
Carscadden, J., G., W., and D., M. 1985. An indirect method of estimating maturation rates of cohorts of capelin (Mallotus villosus). Journal of Northwest Atlantic Fishery Science, 6: 135–140.
Chabot, D. and Claireaux, G. 2008. Environmental hypoxia as a metabolic constraint on fish: The case of atlantic cod, Gadus morhua. Marine Pollution Bulletin, 57: 287–294. URL https://www.sciencedirect.com/science/article/pii/S0025326X08001963. 5th International Conference on Marine Pollution and Ecotoxicology.
Cheung, W., Close, C., Lam, V., Watson, R., and DJ, P. 2008. Application of macroecological theory to predict effects of climate change on global fisheries potential. Marine Ecology Progress Series, 365: 187–197.
Cheung, W. W., Lam, V. W., Sarmiento, J. L., Kearney, K., Watson, R., and Pauly, D. 2009. Projecting global marine biodiversity impacts under climate change scenarios. Fish and Fisheries, 10: 235–251.
Cheung, W. W. L., Watson, R., and Pauly, D. 2013. Signature of ocean warming in global fisheries catch. Nature, 497: 365–368.
Coombs, S. H. and Mitchell, C. E. 1982. The development rate of eggs and larvae of the hake, Merluccius merluccius (L.) and their distribution to the west of the British Isles. ICES Journal of Marine Science, 40: 119–126. URL https://doi.org/10.1093/icesjms/40.2.119.
Cormon, X., Loots, C., Vaz, S., Vermard, Y., and Marchal, P. 2014. Spatial interactions between saithe (Pollachius virens) and hake (Merluccius merluccius) in the North Sea. ICES Journal of Marine Science, 71: 1342–1355. URL https://doi.org/10.1093/icesjms/fsu120.
Dalpadado, P., Ellertsen, B., Melle, W., and Dommasnes, A. 2000. Food and feeding conditions of Norwegian spring-spawning herring (Clupea harengus) through its feeding migrations. ICES Journal of Marine Science, 57: 843–857. URL https://doi.org/10.1006/jmsc.2000.0573.
Dalpadado, P. and Mowbray, F. 2013. Comparative analysis of feeding ecology of capelin from two shelf ecosystems, off Newfoundland and in the Barents Sea. Progress in Oceanography, 114: 97–105. URL https://www.sciencedirect.com/science/article/pii/S0079661113000499. Norway-Canada Comparison of Marine Ecosystems (NORCAN).
Domenici, P., Ferrari, R. S., Steffensen, J. F., and Batty, R. S. 2002. The effect of progressive hypoxia on school structure and dynamics in Atlantic herring Clupea harengus.Proc. R. Soc. Lond. B, 269: 2103–2111.
dos Santos Schmidt, T. C., Hay, D. E., Sundby, S., Devine, J. A., Óskarsson, G. J., Slotte, A., Wuenschel, M. J., et al. 2021. Adult body growth and reproductive investment vary markedly within and across Atlantic and Pacific herring: a meta-analysis and review of 26 stocks. Reviews in Fish Biology and Fisheries, 31: 685–708. URL https: //doi.org/10.1007/s11160-021-09665-9.
Dulvy, N. K., Rogers, S. I., Jennings, S., Stelzenmller, V., Dye, S. R., and Skjoldal, H. R. 2008. Climate change and deepening of the North Sea fish assemblage: a biotic indicator of warming seas. Journal of Applied Ecology, 45: 1029–1039.
Ellertsen, B., Fossum, P., Solemdal, P., Sundby, S., and Tilseth, S. 1984. A case study on the distribution of cod larvae and availability of prey organisms in relation to physical processes in Lofoten. in: The propagation of cod. Report 0333-2594:453-478, Flødevigen, Arendal.
Eriksen, E., Benzik, A. N., Dolgov, A. V., Skjoldal, H. R., Vihtakari, M., Johannesen, E., Prokhorova, T. A., et al. 2020a. Diet and trophic structure of fishes in the Barents Sea: The Norwegian-Russian program “Year of stomachs” 2015 – Establishing a baseline. Progress in Oceanography, 183: 102262. URL https://www.sciencedirect.com/science/article/pii/S0079661119304422.
Eriksen, E., Huserbråten, M., Gjøsæter, H., Vikebø, F., and Albretsen, J. 2020b. Polar cod egg and larval drift patterns in the Svalbard archipelago. Polar Biology, 43: 1029–1042.
Eriksen, E., Ingvaldsen, R., Nedreaas, K., and Prozorkevich, D. 2015. The effect of recent warming on polar cod and beaked redfish juveniles in the Barents Sea. Regional Studies in Marine Science, 2: 105–112. URL https://www.sciencedirect.com/science/ article/pii/S2352485515000511.
Fiksen, , Utne, A., Aksnes, D., Eiane, K., Helvik, J., , and Sundby, S. 1998. Modelling the influence of light, turbulence and ontogeny on ingestion rates in larval cod and herring. Fisheries Oceanography, 7 (3/4): 355–363.
Foy, R. J., Long, W. C., and Swiney, K. M. 2018. Ocean acidification does not affect embryo development, hatch success, or calcification in snow crab, Chionoecetes opilio. Franke, A. and Clemmesen, C. 2011. Effect of ocean acidification on early life stages of Atlantic herring (clupea harengus l.). Biogeosciences, 8: 3697–3707. URL https: //bg.copernicus.org/articles/8/3697/2011/.
Friedland, K. D., Stock, C., Drinkwater, K. F., Link, J. S., Leaf, R. T., Shank, B. V., Rose, J. M., et al. 2012. Pathways between primary production and fisheries yields of large marine ecosystems. PLOS ONE, 7: 1–11. URL https://doi.org/10.1371/ journal.pone.0028945.
Frommel, A. Y., Maneja, R., Lowe, D., Malzahn, A. M., Geffen, A. J., Folkvord, A., Piatkowski, U., et al. 2012. Severe tissue damage in Atlantic cod larvae under increasing ocean acidification. Nature Clim. Change, 2: 42–46.
Frommel, A. Y., Maneja, R., Lowe, D., Pascoe, C. K., Geffen, A. J., Folkvord, A., Piatkowski, U., et al. 2014. Organ damage in Atlantic herring larvae as a result of ocean acidification. Ecological Applications, 24.
Frommel, A. Y., Schubert, A., Piatkowski, U., and Clemmesen, C. 2013. Egg and early larval stages of Baltic cod, Gadus morhua, are robust to high levels of ocean acidification. Mar. Biol., 160.
Gjøsæter, H. and Loeng, H. 1987. Growth of the Barents Sea capelin, Mallotus villosus, in relation to climate. Environmental Biology of Fishes, 20: 293–300.
Gjøsæter, H. 1998. The population biology and exploitation of capelin (Mallotus villosus) in the Barents Sea. Sarsia, 83: 453–496. URL https://doi.org/10.1080/00364827.1998.10420445.
Guevara-Fletcher, C., Alvarez, P., Sanchez, J., and Iglesias, J. 2017. The effect of temperature on the development of yolk-sac larvae of European hake (Merluccius merluccius L.) under laboratory conditions. Aquaculture Research, 48: 1392–1405. URL https://onlinelibrary.wiley.com/doi/abs/10.1111/are.12975.
Hansen, C., Drinkwater, K. F., Jähkel, A., Fulton, E. A., Gorton, R., and Skern-Mauritzen, M. 2019a. Sensitivity of the Norwegian and Barents Sea Atlantis end-to-end ecosystem model to parameter perturbations of key species. PLOS ONE, 14: 1–24. URL https://doi.org/10.1371/journal.pone.0210419.
Hansen, C., Nash, R. D. M., Drinkwater, K. F., and Hjøllo, S. S. 2019b. Management scenarios under climate change – a study of the Nordic and Barents Seas. Frontiers in Marine Science, 6: 668. URL https://www.frontiersin.org/article/10.3389/ fmars.2019.00668.
Hare, J. A., Morrison, W. E., Nelson, M. W., Stachura, M. M., Teeters, E. J., Griffis, R. B., Alexander, M. A., et al. 2016. A vulnerability assessment of fish and invertebrates to climate change on the Northeast U.S. continental shelf. PLOS ONE, 11: 1–30. URL https://doi.org/10.1371/journal.pone.0146756.
Hirche, H.-J. 1987. Temperature and plankton ii. respiration and swimming activity of copepods from the Greenland Sea at different temperatures. Marine biology, 94: 347–356.
Hjøllo, S., Huse, G., Skogen, M. D., and Melle, W. 2012. Modelling secondary production in the Norwegian Sea with a fully coupled physical/primary production/individualbased Calanus finmarchicus model system. Marine Biology Research, 8: 508–526.
Hoegh-Guldberg, O., Cai, R., Poloczanska, E., Brewer, P., Sundby, S., Hilmi, K., Fabry, V., et al. 2014. Climate Change 2014: Impacts, Adaptation, and Vulnerability. Part B: Regional Aspects. Contribution of Working Group II to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change,. pp. 1655–1731. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA.
Hofmann, A., Peltzer, E.,Walz, P., and Brewer, P. 2011. Hypoxia by degrees: Establishing definitions for a changing ocean. Deep Sea Research Part I: Oceanographic Research Papers, 58: 1212–1226. URL https://www.sciencedirect.com/science/article/pii/S0967063711001701.
Holt, R. E., Bogstad, B., Durant, J. M., Dolgov, A. V., and Ottersen, G. 2019. Barents Sea cod (Gadus morhua) diet composition: long-term interannual, seasonal, and ontogenetic patterns. ICES Journal of Marine Science, 76: 1641–1652. URL https://doi.org/10.1093/icesjms/fsz082.
Hop, H. and Gjøsæter, H. 2013. Polar cod (boreogadus saida) and capelin (mallotus villosus) as key species in marine food webs of the Arctic and the Barents Sea. Marine Biology Research, 9: 878–894. URL https://doi.org/10.1080/17451000.2013.775458.
Hordoir, R., Skagseth, Ø., Ingvaldsen, R. B., Sandø, A. B., Löptien, U., Dietze, H., Gierisch, A. M. U., et al. 2022. Changes in arctic stratification and mixed layer depth cycle. JGR Oceans. URL https://doi.org/10.1093/icesjms/fsab100.
ICES, O. 2021. Arctic fisheries working group (AFWG). ICES Scientific Reports 3(58).
IPCC 2013. Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change, Cambridge University Press. p. 1535pp. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA.
Kaartvedt, S., Røstad, A., and Titelman, J. 2021. Sleep walking copepods? Calanus diapausing in hypoxic waters adjust their vertical position during winter. Journal of Plankton Research, 43: 199–208. URL https://doi.org/10.1093/plankt/fbab004.
Kahru, M., Gille, S. T., Murtugudde, R., Strutton, P. G., Manzano-Sarabia, M., Wang, H., and Mitchell, B. G. 2010. Global correlations between winds and ocean chlorophyll. Journal of Geophysical Research: Oceans, 115. URL https://agupubs.onlinelibrary.wiley.com/doi/abs/10.1029/2010JC006500.
Kawaguchi, S., Ishida, A., King, R., Raymond, B., Waller, N., Constable, A., Nicol, S., et al. 2013. Risk maps for antarctic krill under projected southern ocean acidification. Nature Climate Change, 3: 843–847.
Kjesbu, O. S., Sandø, A. B., Strand, E., Alix, M., Wright, P. J., Edwards, M., Thorsen, A., et al.Atlantic cod face reproductive failure in the south and extreme spawning migrations in the north.
Kjesbu, O. S., Sundby, S., Sandø, A. B., Alix, M., Hjøllo, S., Tiedemann, M., Skern-Mauritzen, M., et al. 2021. Highly mixed impacts of near-future climate change on stock productivity proxies in the north east Atlantic. Fish and Fisheries, n/a. URL https://onlinelibrary.wiley.com/doi/abs/10.1111/faf.12635.
Kolts, J. M., Lovvorn, J. R., North, C. A., , Grebmeier, J. M., and Cooper, L. W. 2013. Effects of body size, gender, and prey availability on diets of snow crabs in the northern Bering Sea. Mar. Eco. Prog. Ser., 483: 209–220.
Kristiansen, T., Drinkwater, K. F., Lough, R. G., and Sundby, S. 2011. Recruitment variability in north Atlantic cod and match-mismatch dynamics. PLOS ONE, 6: 1–11. URL https://doi.org/10.1371/journal.pone.0017456.
Kunz, K. L., Claireaux, G., Pörtner, H.-O., Knust, R., and Mark, F. C. 2018. Aerobic capacities and swimming performance of polar cod (Boreogadus saida) under ocean acidification and warming conditions. Journal of Experimental Biology, 221. URL https://doi.org/10.1242/jeb.184473. Jeb184473.
Langehaug, H. R., Geyer, F., Smedsrud, L. H., and Gao, Y. 2013. Arctic sea ice decline and ice export in the CMIP5 historical simulations. Ocean Modelling, 71: 114–126.
Langehaug, H. R., Sandø, A. B., Årthun, M., and Ilıcak, M. 2019. Variability along the Atlantic water pathway in the forced Norwegian Earth System Model. Climate Dynamics, 52: 1211–1230.
Langøy, H., Nøttestad, L., Skaret, G., Broms, C., and Fernö, A. 2012. Overlap in distribution and diets of Atlantic mackerel (Scomber scombrus), Norwegian springspawning herring (Clupea harengus) and blue whiting (Micromesistius poutassou) in the Norwegian Sea during late summer. Marine Biology Research, 8: 442–460. URL https://doi.org/10.1080/17451000.2011.642803.
Lien, V. S. and Ådlandsvik, B. 2014. Bottom water formation as a primer for springblooms on Spitsbergenbanken? Journal of Marine Systems, 130: 241 – 247. URL http://www.sciencedirect.com/science/article/pii/S0924796311002855.
Lind, S., Ingvaldsen, R. B., and Furevik, T. 2018. Arctic warming hotspot in the northern Barents Sea linked to declining sea-ice import. Nature Climate Change, 8: 634–639. URL https://doi.org/10.1038/s41558-018-0205-y.
Lucas, M. C., Johnstone, A., and Tang, J. 1993. AN ANNULAR RESPIROMETER FOR MEASURING AEROBIC METABOLIC RATES OF LARGE, SCHOOLING FISHES. Journal of Experimental Biology, 175: 325–331. URL https://doi.org/10.1242/jeb.175.1.325.
MacKenzie, B. R., Miller, T. J., Cyr, S., and Leggett, W. C. 1994. Evidence for a domeshaped relationship between turbulence and larval fish ingestion rates. Limnology and Oceanography, 39: 1790–1799.
Madec, G. and the NEMO system team. 2015. Nemo ocean engine, version 3.6 stable. Report. URL http://www.nemo-ocean.eu/Morison.
Madonna, E. and Sandø, A. B. 2022. Understanding differences in north atlantic poleward ocean heat transport and its variability in global climate models. Geophysical Research Letters, 49: e2021GL096683. URL https://agupubs.onlinelibrary.wiley.com/doi/abs/10.1029/2021GL096683. E2021GL096683 2021GL096683.
Maneja, R., Frommel, A., Browman, H., Geffen, A., Folkvord, A., Piatkowski, U., Durif, C., et al. 2015. The swimming kinematics and foraging behavior of larval Atlantic herring (Clupea harengus L.) are unaffected by elevated pCO 2. Journal of Experimental Marine Biology and Ecology, 466.
Maneja, R. H., Frommel, A., Geffen, A., Folkvord, A., et al. 2013. Effects of ocean acidification on the calcification of otoliths of larval Atlantic cod Gadus morhua. Marine Ecology Progress Series, 477: 251-258.
Marshall, S., Nicholls, A.G., , and Orr, A. 1935. On the biology of Calanus finmarchicus. Part VI. Oxygen consumption in relation to environmental conditions. Journal of the Marine Biological Association of the United Kingdom, 20: 1–27.
Meeren, T. v. d. and Ivannikov, V. P. 2006. Seasonal shift in spawning of Atlantic cod (Gadus morhua L.) by photoperiod manipulation: egg quality in relation to temperature and intensive larval rearing. Aquaculture Research, 37: 898–913.
Meinshausen, M., Nicholls, Z. R. J., Lewis, J., Gidden, M. J., Vogel, E., Freund, M., Beyerle, U., et al. 2020. The shared socio-economic pathway (ssp) greenhouse gas concentrations and their extensions to 2500. Geoscientific Model Development, 13: 3571–3605. URL https://gmd.copernicus.org/articles/13/3571/2020/.
Mendiola, D., Alvarez, P., Cotano, U., Etxebeste, E., and de Murguia, A. M. 2006. Effects of temperature on development and mortality of Atlantic mackerel fish eggs. Fisheries Research, 80: 158–168. URL https://www.sciencedirect.com/science/article/pii/S0165783606001755.
Moloney, C. L., St John, M. A., Denman, K. L., Karl, D. M., Köster, F. W., Sundby, S., and Wilson, R. P. 2011. Weaving marine food webs from end to end under global change. Journal of Marine Systems, 84: 106–116. URL https://www.sciencedirect.com/science/article/pii/S0924796310001235.
Olafsdottir, A. H., Slotte, A., Jacobsen, J. A., Oskarsson, G. J., Utne, K. R., and Nøttestad, L. 2015. Changes in weight-at-length and size-at-age of mature Northeast Atlantic mackerel (Scomber scombrus) from 1984 to 2013: effects of mackerel stock size and herring (Clupea harengus) stock size. ICES Journal of Marine Science, 73: 1255–1265. URL https://doi.org/10.1093/icesjms/fsv142.
Østerhus, S., Turrell, W. R., Jónsson, S., and Hansen, B. 2005. Measured volume, heat, and salt fluxes from the Atlantic to the Arctic Mediterranean. Geophysical Research Letters, 32: L07603.
Otterlei, E., Nyhammer, G., Folkvord, A., and Stefansson, S. O. 1999. Temperatureand size-dependent growth of larval and early juvenile Atlantic cod (Gadus morhua): a comparative study of Norwegian coastal cod and northeast Arctic cod. Canadian Journal of Fisheries and Aquatic Sciences, 56: 2099–2111. URL https://doi.org/10.1139/f99-168
Plante, S., Chabot, D., and Dutil, J.-D. 1998. Hypoxia tolerance in Atlantic cod. Journal of Fish Biology, 53: 1342–1356. URL https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1095-8649.1998.tb00253.x.
Poloczanska, E. S., Brown, C. J., Sydeman, W. J., Kiessling, W., Schoeman, D. S., Moore,P. J., Brander, K., et al. 2013. Global imprint of climate change on marine life. Nature Climate Change, 3: 919–925.
Rothschild, B. 1998. Year class strengths of zooplankton in the North Sea and then relation to cod and herring abundance 12. Journal of Plankton Research, 20: 1721–1741. URL https://doi.org/10.1093/plankt/20.9.1721.
Rothschild, B. and Osborn, T. 1988. Small-scale turbulence and plankton contact rates. Journal of plankton Research, 10: 465–474.
Runge, J. A., Fields, D. M., Thompson, C. R. S., Shema, S. D., Bjelland, R. M., Durif, C. M. F., Skiftesvik, A. B., et al. 2016. End of the century CO2 concentrations do not have a negative effect on vital rates of Calanus finmarchicus, an ecologically critical planktonic species in North Atlantic ecosystems. ICES Journal of Marine Science, 73:937–950. URL https://doi.org/10.1093/icesjms/fsv258.
Salvanes, A. G. V., AC, U.-P., B, C., and VA, B. 2011. Behavioural and physiological adaptations of the bearded goby, a key fish species of the extreme environment of the northern Benguela upwelling . Marine Ecology Progress Series, 425: 193–202.
Salvanes, A. G. V., Bartholomae, C., Yemane, D., Gibbons, M. J., Kainge, P., Krakstad, J.-O., Rouault, M., et al. 2015. Spatial dynamics of the bearded goby and its key fish predators off Namibia vary with climate and oxygen availability. Fisheries Oceanography, 24: 88–101. URL https://onlinelibrary.wiley.com/doi/abs/10.1111/fog.12068.
Sandø, A. B., Melsom, A., and Budgell, W. P. 2014. Downscaling IPCC control run and future scenario with focus on the Barents Sea. Ocean Dynamics, 64: 927–949.
Sandø, A. B., Mousing, E. A., Budgell, W. P., Hjøllo, S. S., Skogen, M. D., and Ådlandsvik, B. 2021. Barents Sea plankton production and controlling factors in a fluctuating climate. ICES Journal of Marine Science. URL https://doi.org/10.1093/icesjms/fsab067.
Schlesinger, M. E. and Ramankutty, N. 1994. An oscillation in the global climate system of period 65-70 years. Nature, 367: 723–726.
Seland, Ø., Bentsen, M., Olivié, D., Toniazzo, T., Gjermundsen, A., Graff, L. S., Debernard, J. B., et al. 2020. Overview of the Norwegian Earth System Model (NorESM2) and key climate response of CMIP6 DECK, historical, and scenario simulations. Geoscientific Model Development, 13: 6165–6200. URL https://gmd.copernicus.org/articles/13/6165/2020/.
Siikavuopio, S. I., Bakke, S., Sæther, B. S., Thesslund, T., and Christiansen, J. S. 2019. Temperature selection and the final thermal preferendum of snow crab (chionoecetes opilio, decapoda) from the Barents Sea. Polar Biology, 42: 1911–1914. URL https://doi.org/10.1007/s00300-019-02530-3.
Skagseth, Ø., Drinkwater, K. F., and Terrile, E. 2011. Wind-induced transport of the Norwegian Coastal Current in the Barents Sea. J. Geoph. Res., 116: 1–15.
Skaret, G., Dalpadado, P., Hjøllo, S., Skogen, M., and Strand, E. 2014. Calanus finmarchicus abundance, production and population dynamics in the Barents Sea in a future climate. Progress in Oceanography, 125: 26–39.
Skogen, M. and Søiland, H. 1998. A user’s guide to NORWECOM v2.0. The NORWegian ECOlogical Model system. Tech. Rep. Fisken og Havet 18/98, Institute of Marine Research, Pb.1870, NO-5024 Bergen. 42 pp.
Skogen, M., Svendsen, E., Berntsen, J., Aksnes, D., and Ulvestad, K. 1995. Modelling the primary production in the North Sea using a coupled 3 dimensional Physical Chemical Biological Ocean model. Estuarine, Coastal and Shelf Science, 41: 545–565.
Skogen, M. D., Budgell, W. P., and Rey, F. 2007. Interannual variability in Nordic Seas primary production. ICES Journal of Marine Science, 64: 1–10.
Stiasny, M. H., Mittermayer, F. H., Sswat, M., Voss, R., Jutfelt, F., Chierici, M., Puvanendran, V., et al. 2016. Ocean Acidification Effects on Atlantic Cod Larval Survival and Recruitment to the Fished Population. PLOS ONE, 11: 1–11. URL https://doi.org/10.1371/journal.pone.0155448.
Stock, C. A., John, J. G., Rykaczewski, R. R., Asch, R. G., Cheung, W. W. L., Dunne, J. P., Friedland, K. D., et al. 2017. Reconciling fisheries catch and ocean productivity. Proceedings of the National Academy of Sciences, 114: E1441–E1449. URL https://www.pnas.org/doi/abs/10.1073/pnas.1610238114.
Sundby, S. 1983. A one-dimensional model for the vertical distribution of pelagic fish eggs in the mixed layer. Deep-Sea Research, 30: 645–661.
Sundby, S. 1991. Factors affecting the vertical distribution of eggs. ICES Marine Science Symposia, 192: 33–38.
Sundby, S. 1995. Wind climate and foraging of larval and juvenile Arcto-Norwegian cod. Spec. Publ. Fish. Aquat. Sci., 191: 405–415.
Sundby, S. 2000. Recruitment of Atlantic cod stocks in relation to temperature and advection of copepod populations. Sarsia, 85: 277–298.
Sundby, S. 2006. Lecture notes in Lectures in Physical-biological processes, GEOF 230.
Sundby, S. 2009. Lecture notes in Lectures in Physical-biological processes, GEOF 230.
Sundby, S., Boyd, A. J., Hutchings, L., O’Toole, M. J., Thorisson, K., and Thorsen, A. 2001. Interaction between Cape hake spawning and the circulation in the northern Benguela upwelling ecosystem. South African Journal of Marine Science, 23: 317–336.
Sundby, S., Drinkwater, K. F., and Kjesbu, O. S. 2016. The North Atlantic spring-bloom system — where the changing climate meets the winter dark. Frontiers in Marine Science, 3: 1–12.
Sundby, S. and Fossum, P. 1990. Feeding conditions of Arcto-norwegian cod larvae compared with the Rothschild–Osborn theory on small-scale turbulence and plankton contact rates. Journal of Plankton Research, 12: 1153–1162. URL https://doi.org/10.1093/plankt/12.6.1153.
Sundby, S. and Kristiansen, T. 2015. The principles of buoyancy in marine fish eggs and their vertical distributions across the world oceans. PLOS ONE, 10: 1–23. URL https://doi.org/10.1371/journal.pone.0138821.
Sutton, R. T. and Hodson, D. L. R. 2005. Atlantic Ocean Forcing of North American and European Summer Climate. Science, 309: 115–118. URL https://www.science.org/doi/abs/10.1126/science.1109496.
Sverdrup, H. U. 1953. On Conditions for the Vernal Blooming of Phytoplankton. ICES Journal of Marine Science, 18: 287–295. URL https://doi.org/10.1093/icesjms/18.3.287.
Thor, P., Bailey, A., Dupont, S., Calosi, P., Søreide, J. E., De Wit, P., Guscelli, E., et al. 2018. Contrasting physiological responses to future ocean acidification among Arctic copepod populations. Global Change Biology, 24: e365–e377.
Thorarensen, H., Gústavsson, A., Gunnarsson, S., Árnason, J., Steinarsson, A., Björnsdóttir, R., and Imsland, A. K. 2017. The effect of oxygen saturation on the growth and feed conversion of juvenile Atlantic cod (Gadus morhua L.). Aquaculture, 475: 24–28. URL https://www.sciencedirect.com/science/article/pii/S0044848616311851.
van Damme, C., Hoek, R., Beare, D., Bolle, L., Bakker, C., van Barneveld, E., Lohman, M., et al. 2011. Shortlist master plan wind monitoring fish eggs and larvae in the southern north sea: Final report parts a and b. Report C098/11.
Vancoppenolle, M., Fichefet, T., and Goosse, H. 2009. Simulating the mass balance and salinity of Arctic and Antarctic sea ice. 2. Importance of sea ice salinity variations. Ocean Modelling, 27: 54–69. URL https://www.sciencedirect.com/science/article/pii/S1463500308001625.
Vikebø, F., Sundby, S., Ådlandsvik, B., and Fiksen, 2005. The combined effect of transport and temperature on distribution and growth of larvae and pelagic juveniles of Arcto-Norwegian cod. ICES Journal of Marine Science, 62: 1375–1386. URL https://doi.org/10.1016/j.icesjms.2005.05.017.
Vikebø, F., Sundby, S., Ådlandsvik, B., and Otterå, O. H. 2007. Impacts of a reduced thermohaline circulation on transport and growth of larvae and pelagic juveniles of Arcto-Norwegian cod (Gadus morhua). Fisheries Oceanography, 16: 216–228.
Vilhjálmsson, H. 2002. Capelin ( Mallotus villosus ) in the Iceland–East Greenland–Jan Mayen ecosystem . ICES Journal of Marine Science, 59: 870–883. URL https://doi.org/10.1006/jmsc.2002.1233.
Voss, R., Quaas, M. F., Stiasny, M. H., Hänsel, M., Stecher Justiniano Pinto, G. A., Lehmann, A., Reusch, T. B., et al. 2019. Ecological-economic sustainability of the Baltic cod fisheries under ocean warming and acidification. Journal of Environmental Management, 238: 110–118. URL https://www.sciencedirect.com/science/article/pii/S0301479719302658.
Werner, K. 2015. A first examination of its biology, ecology and fisheries: What is the role of European Hake (Merluccius merluccius) in the waters of the northern North Sea and along the Norwegian coast? Master’s thesis, University of Bergen.
